Introdução
A endometriose foi descrita formalmente em 1896 e é definida pela existência de tecido endometrial fora da cavidade uterina1,2,3. Estima-se que afete cerca de 10% das mulheres em idade reprodutiva e 3 a 5% das mulheres pós-menopáusicas2,4,5. No entanto, como o diagnóstico gold-standard é histológico e muitas das mulheres com endometriose são assintomáticas, a sua prevalência real é difícil de determinar.
Embora seja considerada uma doença benigna, vários estudos descrevem a sua associação a um aumento do risco de cancro (ginecológico e não ginecológico)6-18.
A endometriose é, desde há longa data, apontada como eventual fator de risco para cancro do endométrio e do ovário. Relativamente ao cancro do endométrio não existe evidência definitiva e consistente que suporte uma relação causa-efeito, estando a associação entre estas duas patologias assente na partilha de mecanismos patogénicos comuns que atuam sinergicamente promovendo a proliferação do tecido endometrial eutópico e ectópico dependente de estrogénio e inflamação crónica, num fundo genético partilhado17-19.
Esta revisão da literatura apresentará a mais recente evidência científica relativa à associação entre endometriose e cancro do ovário e abordará as implicações clínicas que dela advêm.
Métodos
Pesquisa bibliográfica baseada na Pubmed utilizando como palavras-chave: endometriose e cancro do ovário. Foram incluídos artigos em inglês, publicados entre janeiro de 2000 e outubro de 2021 (exceção para aqueles com interesse histórico), com destaque para meta-análises e revisões sistemáticas.
Resultados e discussão
Em 1925, Sampson propôs, pela primeira vez, a associação entre a endometriose ovárica e um caso de carcinoma endometrióide do ovário20. Em 1953, Scott demonstrou a existência de continuidade morfológica entre o epitélio benigno e maligno na endometriose21. No entanto, só em 1979 é que Czernobilsky e Morris descreveram a existência de áreas de atipia epitelial severa, que poderiam constituir um potencial neoplásico, surgindo assim a lesão intermediária que faltava no processo de transformação maligna da endometriose ovárica22. Posteriormente, as diferentes fases desta progressão - epitélio normal de revestimento de endometriomas/endometriose atípica/tumor borderline/carcinoma in situ/carcinoma invasivo - foram observados em peças de quistectomia, fornecendo provas inequívocas de que os endometriomas podem progredir para carcinomas do ovário associados a endometriose (EAOC)23-27.
Estima-se que o cancro do ovário se desenvolva em 1 a 5% dos casos de endometriose do ovário, mas este valor pode estar subestimado28. Uma limitação para o cálculo do risco real de transformação maligna da endometriose prende-se com os critérios histológicos utilizados para definir EAOC (Quadros I e II). Os autores que aplicam os critérios originais de Sampson e Scott (que implicam a documentação da transição da endometriose para cancro) mostraram uma prevalência menor de transformação maligna, uma vez que raramente todas estas características são cumpridas29. Outro fator a ter em consideração decorre do facto de o tecido neoplásico provavelmente destruir os focos de endometriose, eliminando a possibilidade de confirmação histológica do continuum que será a transformação da endometriose em cancro30,31. Atualmente, a maioria dos autores utilizam a classificação Van Gorp, segundo a qual basta existir documentação de endometriose (ovárica ou extra-ovárica) na doente com carcinoma do ovário32.
A associação entre os carcinomas de células claras (CCC) e carcinomas endometrióides e a endometriose tem sido demonstrada de modo consistente pelos diferentes estudos, já a associação com tumores seromucinosos borderline e os carcinomas serosos de baixo grau é mais modesta e menos consensual, particularmente no que ao subtipo seroso de baixo grau diz respeito17,33-37. Nenhuma associação foi identificada entre endometriose e carcinomas de tipo mucinoso ou seroso de alto grau, assim como com os tumores borderline de tipo seroso e mucinoso33,34.
1. Evidência epidemiológica
A associação entre a endometriose e o cancro do ovário começou por assentar na partilha de fatores de risco, incluindo obesidade, diabetes mellitus tipo 2, hiperestrogenismo e características reprodutivas. Evidência epidemiológica mais consistente surge com os estudos de Brinton et al e Melin et al, que demonstraram um risco acrescido para cancro do ovário em doentes hospitalizados por endometriose (SIR 1.9 IC 95% 1.3-2.8 e 1.43 IC 95% 1.49-1.71, respetivamente)8,38. Desde então essa associação foi validada em sucessivas análises conjuntas de estudos e meta-análises17,29,33,34. Na mais recente meta-análise, Li et al concluíram que a endometriose se associou a um aumento significativo na incidência do cancro do ovário (RR 1.964; IC 95% 1.685-2.290), com maior significado se considerarmos a análise por subtipo histológico: CCC - RR 3.39; IC 95% 2.85-4.02; carcinoma endometrióide - RR 2.10; IC 95% 1.74-2.5317.
Apesar do diagnóstico gold-standard de endometriose ser histológico, uma proporção significativa de doentes vê o seu diagnóstico assente em critérios clínicos, pelo que amostras histológicas nem sempre estão disponíveis. Este facto poderia constituir um viés nos estudos epidemiológicos, conferindo um risco estimado de EAOC inferior ao real39. No entanto, apesar da associação da endometriose e do cancro do ovário ter mostrado ser mais forte para a endometriose laparoscopicamente confirmada (OR 2.14; IC 95% 1.45-3.15), em comparação com a doença auto-reportada (RR 1.81; IC 95% 1.26-2.58), a precisão do auto-relato é ainda assim elevada15.
2. Endometriose como condição pré-maligna do cancro do ovário
Na transformação maligna da endometriose em EAOC parecem concorrer fatores genéticos, epigenéticos, imunológicos, hormonais, microambientais (do ovário, com o stress oxidativo induzido pelo ferro da hemorragia menstrual repetida a assumir um papel de destaque) e ambientais - Figura 1 40-47.

Figura 1 Principais fatores envolvidos nas etapas de desenvolvimento dos EAOC. Legenda: ↑ - aumento, ADN - ácido desoxirribonucleico, NK - células natural killers, RE/RP: recetores de estrogénio/recetores de progesterona, TNF-α - fator de necrose tumoral alfa, VEGF - fator de crescimento endotelial vascular.
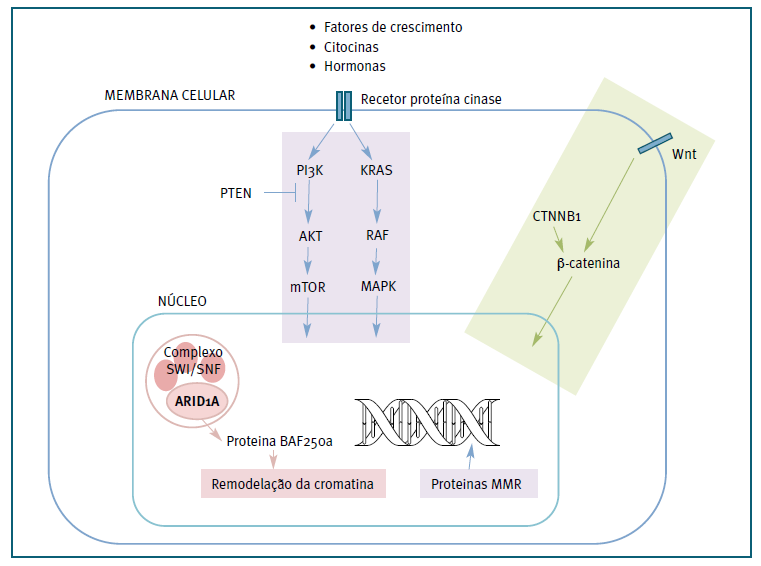
Nos últimos anos, a análise genética por sequenciação de nova geração tem permitido caracterizar as alterações genéticas que contribuem para a transformação maligna da endometriose ovárica. As principais vias e mecanismos moleculares com alterações partilhadas entre endometriose e EAOC surgem representadas na Figura 2.
Legenda: Via de remodelação da cromatina: As mutações somáticas do gene ARID1A condicionam perda de expressão da proteína BAF250a (e perda consequente da sua função de supressor tumoral), são um evento molecular precoce e são consideradas a alteração genética mais importante e eventual biomarcador da transformação maligna da endometriose.40,48,49 Mutações em ARID1A contribuem para a instabilidade de microssatélites.50Instabilidade de microssatélites: É um tipo de instabilidade genómica causada por um défice de reparação de erros de emparelhamento (MMR), de causa genética ou epigenética. Esse défice promove a acumulação de mutações que podem levar a transformações malignas e formação de tumores com um fenótipo hipermutado.40 A perda de expressão de proteínas MMR foi identificada no componente estromal dos focos de endometriose assim como nos EAOC.51Vias de sinalização PI3K-AKT¬mTOR e KRAS/RAF/MAPK: participam na proliferação e sobrevivência celulares em resposta a fatores de crescimento, hormonas e citocinas. Mutações supressoras da ARID1A e ativadoras no PIK3CA cooperam promovendo crescimento tumoral através da produção aumentada de interleucina 6 (IL-6).52 O gene PTEN codifica um regulador negativo da via de sinalização PI3K-AKT-mTOR.53 Mutações do oncogene KRAS foram identificadas em cerca de 30% dos carcinomas endometrióides do ovário associados a endometriose e em apenas 3% dos tumores sem endometriose associada.54Via de sinalização Wnt/β-catenina: O gene CTNNB1 codifica a proteína β-catenina 1 que desempenha um papel importante na proliferação e diferenciação celular.55
Apesar de a primeira evidência que suporta a teoria de que a endometriose é um precursor clonal dos EAOC ter sido apresentada por Jiang et al em 1998, evidências mais conclusivas surgiram em 2010 com a descoberta da mutação ARID1A nos CCC e endometrióides48,56. Em 2015, Lu et al identificaram alterações genéticas partilhadas entre a endometriose e todos os subtipos histológicos de cancro do ovário (exceto o subtipo mucinoso), sendo o CCC aquele que apresenta maior correlação genética com a endometriose (r g 0.51; IC 95% 0.18-0.84) seguida do subtipo endometrióide (r g 0.48; IC 95% 0.07-0.89)57. No entanto, o CCC e o carcinoma endometrióide parecem desenvolver-se através de diferentes mecanismos genéticos e epigenéticos, o que lhes confere diferentes perfis moleculares e achados imunohistoquímicos - Quadro III.
Quadro III Principais alterações moleculares e achados imunohistoquímicos dos EAOC.
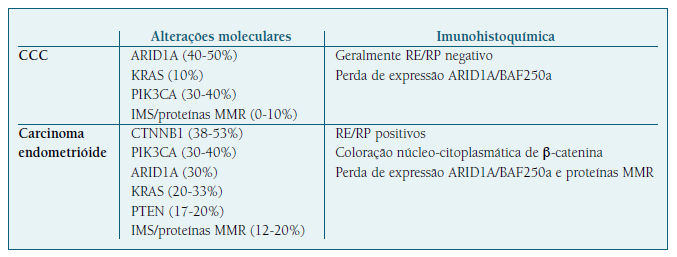
Legenda: IMS - Instabilidade de microssatélites, MMR - mismatch repair (reparação de erros de emparelhamento), RE - recetores de estrogénio, RP - recetores de progesterona. Adaptado de Matias-Guiu et al (2017)58 e OMS (2020)59.
Com base na evidência genética crescente, admite-se que as células de endometriose possam acumular mutações somáticas, levando à atipia histológica e à transformação em cancro do ovário. Permanecem, no entanto, por identificar todos os genes e vias implicados nesta transição.
3. Fatores de risco para EAOC
O risco de EAOC aumenta de forma consistente com a idade, estando as mulheres peri e pós-menopáusicas em maior risco60-62. A prevalência da endometriose na menopausa ronda os 2-4%63. Gianella et al, numa revisão sistemática sobre a transformação maligna da endometriose pós-menopausa, identificaram algumas condições clínicas recorrentes: história pessoal de endometriose/adenomiose, cirurgia ginecológica pré-menopausa por endometriose e terapia de reposição hormonal com estrogénio isolado63.
Apesar da existência de dados contraditórios, a maioria dos estudos sugere que o risco de EAOC é maior em mulheres com histórico de endometriose de longa data8. Numa análise conjunta de estudos caso-controlo, Pearce et al verificaram que a endometriose se associava a um risco acrescido de cancro epitelial do ovário, mesmo quando o intervalo de tempo que mediava o diagnóstico de endometriose e o diagnóstico de cancro era de cinco e dez anos33.
O tamanho dos endometriomas foi considerado por Kobayashi et al um preditor independente do desenvolvimento de EAOC, nomeadamente aqueles com diâmetro superior a nove centímetros [HR 1.00 (IC 95% 2.09-9.22,), valor p:0.031]61. Para Taniguchi et al, mais do que o tamanho, o crescimento rápido de um endometrioma (duplicação do tamanho nos seis meses que antecedem o diagnóstico de malignidade) deve ser usado como um indicador de transformação maligna64. Admite-se que mutações somáticas sejam adquiridas durante o crescimento destas lesões, uma vez que para que tal aconteça é necessário que as células originais que formam o quisto passem por várias divisões celulares, aumentando o risco de alterações genéticas65.
A maioria dos fatores de risco partilhados entre a endometriose e o cancro epitelial do ovário está associada à longa exposição ao estrogénio, seja ele endógeno (por ex., menarca precoce, menopausa tardia, nuliparidade ou ovulação incessante) ou exógeno66. A terapia hormonal da menopausa, nomeadamente o uso prolongado de estrogénios isolados, é um fator de risco reconhecido para a transformação maligna da endometriose, pelo que as orientações atuais recomendam formulações combinadas (estroprogestativos) de uso contínuo ou tibolona nas mulheres com antecedente de endometriose63,67.
4. Características clínicas e prognóstico
Em comparação com o cancro epitelial do ovário não associado à endometriose, os EAOC têm maior probabilidade de serem diagnosticados em mulheres mais jovens e nulíparas, na pré-menopausa. Apresentam-se também mais frequentemente em estádios iniciais68-73. Além disso, são geralmente doenças de baixo grau, o que é particularmente verdade para o carcinoma endometrióide, uma vez que o CCC é considerado um carcinoma de alto grau69,70. Os resultados da meta-análise de Kim et al confirmaram o anteriormente enunciado: os EAOC foram diagnosticados mais frequentemente em nulíparas (RR 1.327; IC 95% 1.245-1.415), nos estádios I-II (RR 1.959; IC 95% 1.367-2.807) e na forma de doença de baixo grau (grau 1 - RR 1.319; IC 95% 1.149-1.514)34.
Os dados sugerem que o comportamento biológico dos EAOC pode ser mais favorável, traduzindo-se em melhores desfechos33,73. Porém, estes resultados devem ser interpretados com cautela, uma vez que a maioria dos casos é diagnosticada em estádios iniciais. De facto, Garrett et al confirmaram que uma melhoria da sobrevida estava associada ao estádio, ao grau e à histologia endometrióide70.
Doentes com CCC diagnosticado no estádio IA têm uma sobrevida aos 5 anos de 80-90%74-76. Já quando diagnosticados em estádios avançados, o prognóstico é pior que aquele dos carcinomas serosos de alto grau em estádios semelhantes77-79. O mesmo parece ser verdade relativamente ao estádio IC, com o estudo de Sugiyama et al a apresentar uma taxa de recidiva de 37% e taxas de sobrevida inferiores comparativamente aos carcinomas serosos de alto grau74. Estes dados reforçam a importância da cirurgia primária, nomeadamente a não rotura intraoperatória da cápsula tumoral.
Os CCC têm sido apontados como sendo intrinsecamente resistentes à quimioterapia, o que poderá explicar, em parte, o pior desfecho quando diagnosticados em estádios avançados78. A resposta dos carcinomas endometrióides do ovário à quimioterapia é menos clara e tem sido menos estudada, no entanto, no estudo retrospetivo de Ren et al que visava analisar as características clínicas e fatores relacionados com a resistência à quimioterapia baseada em platina das doentes com CCC e carcinoma endometrióide, o subtipo histológico não foi um fator de risco independente, sugerindo que a quimiorresistência pode ter semelhanças nos dois tipos de tumores80.
5. Implicações clínicas e perspetivas futuras
5.1. Rastreio e diagnóstico precoce
Atualmente, não há nenhum método de rastreio validado para a endometriose nem para o cancro do ovário, mas algumas particularidades do EAOC podem ser tidas em consideração.
Ao contrário do carcinoma seroso de alto grau, com origem em lesões serosas intraepiteliais nas fímbrias da trompa de Falópio, que não são detetáveis ecograficamente, os EAOC surgem no contexto de endometriomas já conhecidos. Esta característica pode ser explorada com intuito de uma deteção precoce78,81. Comparando as características ecográficas do EAOC com o endometrioma típico, o EAOC é, geralmente, de maiores dimensões, unilateral, multilocular e apresenta componentes sólidos, sendo este último o achado mais sugestivo de malignidade - Figura 3. Adicionalmente, o endometrioma raramente cursa com a presença de ascite62,82. Deve ser prestada especial atenção a mulheres nulíparas, na peri-menopausa, com endometriose de longa duração, por serem estas as que apresentam maior risco de transformação maligna.
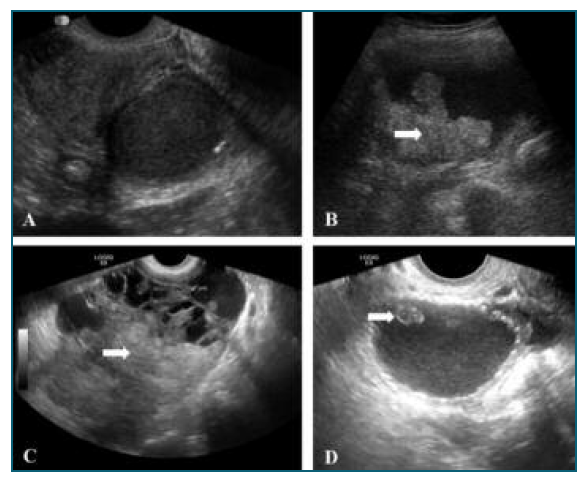
Figura 3 Imagens ecográficas de A) endometrioma, B) carcinoma de células claras, C) carcinoma endometrióide e D) tumor seromucinoso borderline, do ovário. Legenda: componentes sólidos identificados pela seta.
A clínica dos EAOC é inespecífica. Zapardiel et al consideram que a exacerbação aguda ou subaguda de sintomas sugestivos de endometriose pode sugerir a presença de um EAOC, mas que tal deve ser complementado com exames radiológicos e doseamento sérico de CA125 e HE483. No entanto, as diferenças entre os valores séricos de CA 125 das doentes com endometriomas e com EAOC não foram estatisticamente significativas e nem se correlacionaram com o processo de transformação maligna62,64. Já o doseamento sérico de HE4 mostrou ser um biomarcador útil no diagnóstico diferencial entre endometriose e malignidade83.
5.2. Prevenção
No futuro, as diferentes variáveis conhecidas poderão ser combinadas num modelo preditivo de risco de EAOC que possa ser usado para orientar medidas preventivas.
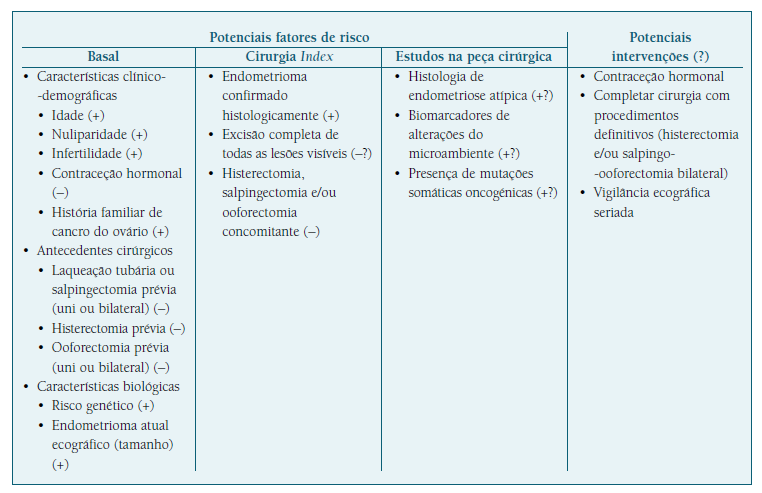
Em 2017, Anglesio e Yong apresentaram uma proposta para cálculo de risco e decisão quanto a eventuais medidas preventivas dos EAOC14. Os autores consideram que mulheres com múltiplos fatores de risco para EAOC que lhe confiram um risco final acima de um determinado limiar (ainda por definir), poderiam ser propostas para intervenções preventivas que podem ir desde uma vigilância ecográfica mais apertada até cirurgias redutoras de risco - Quadro IV.
É amplamente aceite que a salpingectomia reduz o risco de cancro do ovário, particularmente do carcinoma seroso de alto grau, mas o benefício da ooforectomia profilática (incluindo em mulheres com alto risco de EAOC) está por definir84. No entanto, admite-se que, numa base de avaliação caso a caso, em mulheres na peri ou pós-menopausa, com endometriose de longa duração, com lesões ováricas unilaterais, de maiores dimensões, multiloculares e/ou que apresentaram crescimento rápido, a (salpingo)ooforectomia eletiva ou oportunista durante uma histerectomia por outra indicação, pode ser uma melhor opção do que esperar pela teórica regressão espontânea do endometrioma. A título de exemplo, no Japão (com maior prevalência de CCC), as recomendações nacionais enfatizam o risco de transformação maligna da endometriose e referem que, em mulheres com mais de 40 anos, a ooforectomia deve ser ponderada no tratamento da endometriose ovárica85.
Existe um racional teórico para acreditar que o controlo cirúrgico e hormonal da endometriose diminua o risco de EAOC. A utilização de contracetivos orais por mais de 10 anos diminuiu o risco de cancro do ovário em mulheres com e sem endometriose37. Mas foram identificados EAOC no contexto de endometriomas recorrentes, isto é, após quistectomia, com uma prevalência estimada de 0.8%86,87.
Múltiplos estudos mostraram que vários tipos de antioxidantes, como a glutationa ou as vitaminas C e E, podem impedir a produção de radicais livres de oxigénio ou removê-los antes que causem danos no ADN, atuando assim como agentes preventivos do cancro; no entanto, a sua utilização no contexto específico da transformação maligna da endometriose permanece pouco explorada88,89.
5.3. Medicina de precisão
O tratamento primário padrão do cancro do ovário é cirúrgico, seguido de quimioterapia adjuvante na maioria dos casos90. No entanto, o mau prognóstico com diminuição da eficácia terapêutica da quimioterapia está omnipresente nos estádios avançados ou na recidiva. Assim, nos últimos anos, os esforços têm-se concentrado na otimização da terapêutica de primeira linha, quer através da melhoria da qualidade cirúrgica para obtenção de uma citorredução ótima, quer através da utilização de novos esquemas de terapia sistémica, com adição de terapias dirigidas e/ou imunoterapia91. Estas últimas ganham particular relevância nos subtipos histológicos menos quimiossensíveis, como os EAOC, que apresentam um nível moderado de carga mutacional, utilizada como biomarcador da suscetibilidade à imunoterapia92.
A identificação dos mecanismos genéticos subjacentes e de biomarcadores imunes tem permitido explorar novas terapêuticas dirigidas às vias afectadas, como por exemplo: anticorpo anti-PD-(L)1, inibidores da via PIK3K/AKT/mTOR, inibidores da PARP (poli-ADP-ribose polimerase), anticorpo anti-IL6 ou inibidores da histona deacetilase 6 (HDAC6) associada a mutações ARID1A86.
Até à data, nenhum fármaco foi aprovado para utilização neste subgrupo de tumores mas a investigação prossegue para se estabelecer qual a combinação terapêutica mais eficaz e as candidatas a esta terapêutica. A aprovação pela Food and Drug Administration da utilização do inibidor de checkpoint imunitário PD-L1 - pembrolizumab - no tratamento de tumores sólidos com instabilidade de microssatélites criou uma nova oportunidade terapêutica para os EAOC (especialmente os CCC) que apresentem défice das proteínas de mismatch repair (MMR)50.
5.4. Centros/unidades especializados
Está comprovado que o prognóstico de doentes oncológicos é melhor quando estes são avaliados por uma equipa multidisciplinar em unidades/centros especializados93. A endometriose e o cancro do ovário compartilham alguns desafios diagnósticos e terapêuticos, incluindo o atraso e a dificuldade no diagnóstico, a distorção grave da anatomia pélvica e infiltração nos espaços retroperitoneais e a possibilidade de “metástases” para estruturas não ginecológicas, como intestino, ureter, bexiga, diafragma ou mesmo gânglios linfáticos e pulmões94. É por isso que organizações como a Sociedade Mundial de Endometriose recomendam que mulheres com sinais e os sintomas sugestivos de endometriose devem ser concentradas em centros especializados, com equipas multidisciplinares de profissionais de saúde dedicados e especializados, a fim de melhorar os resultados, incluindo a melhoria da qualidade de vida95.
As mulheres com endometriose sintomática e refratária à terapêutica farmacológica ou com endometriose atípica devem ter a sua doença completamente removida cirurgicamente e aquelas com suspeita de EAOC devem ser encaminhadas a um centro com ginecologia oncológica para avaliação e tratamento37.
Conclusões
A associação entre endometriose e cancro do ovário (principalmente o CCC e o carcinoma endometrióide) tem sido provada de modo consistente por diversos estudos e validada por sucessivas revisões sistemáticas da literatura e meta-análises.
A transformação maligna da endometriose é um fenómeno em várias etapas onde participam fatores genéticos, epigenéticos, imunitários, hormonais, ambientais e microambientais do ovário. Os principais fatores de risco para EAOC são a idade, a endometriose de longa duração, o tamanho dos endometriomas e a exposição prolongada a estrogénios.
Não existe nenhum método de rastreio para o EAOC nem estão validadas medidas preventivas, pelo que o diagnóstico precoce é essencial. Deve suspeitar-se da presença de um EAOC perante uma lesão ovárica unilateral, multiloculada, de crescimento rápido (principalmente na peri e pós-menopausa), que apresenta componentes sólidos e que curse com elevação do HE4.
Casos de endometriose devem ser acompanhados em Unidades/Centros especializados, com equipas multidisciplinares, e qualquer mulher com suspeita de EAOC deve ser encaminhada a um centro com profissionais diferenciados em ginecologia oncológica.
Os EAOC são mais frequentemente diagnosticados em mulheres mais jovens e em estádios iniciais. No entanto, quando diagnosticados em estádios avançados, a quimiorresistência que os caracteriza confere-lhes um pior prognóstico. O conhecimento crescente do seu microambiente imunitário e a sua caracterização genética têm permitido explorar novos alvos terapêuticos, com destaque para a imunoterapia.
Agradecimentos
À Dra. Teresa Margarida Cunha, autora das imagens ecográficas apresentadas na Figura 3.
Contribuição individual de cada autor para o artigo
LC foi a responsável pela pesquisa bibliográfica e escrita do artigo. CF procedeu à revisão do mesmo.
Conflitos de interesse
Os autores não apresentam conflitos de interesses. O presente artigo representa uma versão parcial da monografia intitulada “Endometriose e Cancro do Endométrio e do Ovário´ apresentada no Curso de Ginecologia Oncológica organizado pelo Colégio da Subespecialidade de Ginecologia Oncológica.