Introdução
O cancro na gravidez é aquele que é diagnosticado desde a conceção até 12 meses após o parto, ocorrendo em cerca de 1 em cada 1000 gestações1-6. O diagnóstico é feito no pós-parto na maioria dos casos2 e representa a segunda causa de morte em mulheres em idade reprodutiva7. Em países onde a maternidade tem sido adiada, é expectável que a incidência aumente8-10.
Os tipos de cancro mais frequentes na gravidez são: mama, colo do útero, melanoma, tiróide, ovário, linfoma e leucemia1,5,6,9,11. No cancro da mama associado à gravidez, a incidência estimada é de 15-35 por 100000 partos, a maioria diagnosticados após o parto; estudos comparativos que avaliaram especificamente o prognóstico da doença entre mulheres com cancro associado à gravidez e mulheres não grávidas mostraram que não há impacto negativo na sobrevida quando se considera idade, estádio, subtipo de tumor e tratamento12-14. Cerca de um terço dos melanomas é diagnosticado em mulheres em idade reprodutiva. A sua incidência na gravidez é cerca de 0,05 a 0.1%15,16. O prognóstico é semelhante aos casos diagnosticados em mulheres não grávidas17,18. O cancro do colo do útero tem uma incidência estimada de 0,8-1,4 casos por 10000 nascimentos2,6. Os dados relativamente ao prognóstico são limitados, mas parece não haver diferença entre mulheres grávidas com cancro cervical invasivo quando comparadas com mulheres não grávidas18-21. O cancro da tiróide tem uma incidência estimada de 14,4 por 100000 partos22. Vários estudos demonstraram que a gravidez não afeta o prognóstico da doença23. Já para o cancro do ovário, a incidência é de 1 em 15000 - 1 em 32000 gravidezes. A maioria tem bom prognóstico na gravidez, devido ao diagnóstico precoce24.
O diagnóstico de cancro na gravidez impõe um dilema médico e ético, uma vez que o tratamento agressivo imediato é, muitas vezes, indispensável para a sobrevivência materna, mas os fármacos utilizados podem potencialmente ameaçar o bem-estar fetal através da sua passagem transplacentária25,26.
No geral, o tratamento oncológico deve seguir os mesmos protocolos usados para as mulheres não grávidas, de forma a melhorar o prognóstico materno27.
A interrupção médica da gravidez pode ser considerada em casos de cancro em estádio avançado ou de comportamento agressivo, diagnosticados no início da gravidez. Quando possível, deve ser evitado o parto pré-termo iatrogénico com o objetivo de iniciar tratamento oncológico, devido à morbilidade a curto e longo prazo da prematuridade1,9.
Diagnóstico e estadiamento
O diagnóstico de cancro na gravidez é muitas vezes tardio, por vários motivos3,28:
Semelhança dos sintomas neoplásicos com os de uma gravidez normal: náuseas/vómitos, alterações mamárias, dor abdominal, anemia e fadiga;
Receio em usar exames complementares de diagnóstico e realizar procedimentos cirúrgicos na gravidez;
Eventual alteração da sensibilidade e especificidade dos meios complementares de diagnóstico na gravidez.
A investigação de lesões suspeitas deve seguir os protocolos recomendados para doentes não grávidas, mas tendo em conta algumas particularidades que podem alterar resultados ou contraindicar a realização de exames.
Marcadores tumorais
Alguns marcadores tumorais elevam-se na gravidez, pelo que a sua especificidade e sensibilidade é baixa e não devem ser usados por rotina (CA125, CA15-3, AFP, SCC). Podem usar-se o CEA, CA19-9, LDH, AMH e HE-4, pois os seus níveis não estão habitualmente aumentados durante a gravidez1,28.
Métodos de imagem
Existe alguma preocupação relativamente à segurança dos métodos de imagem, nomeadamente ao risco de exposição à radiação, contrastes e efeito térmico.
Aquando da escolha de um exame de imagem é necessário ter em conta a segurança para o feto, o risco de metástases e viabilidade do feto28.
Quando um exame acarreta um risco acrescido para a grávida e feto, deve ser ponderado o seu risco/benefício, devendo apenas ser realizado caso a informação diagnóstica e/ou de estadiamento contribua definitivamente para a abordagem oncológica29-31.
Métodos de imagem sem radiação
A ecografia envolve o uso de ultrassons, não existindo casos reportados de efeitos adversos fetais ou maternos, incluindo o uso de doppler9,29,31-33.
Métodos de imagem com radiação ionizante
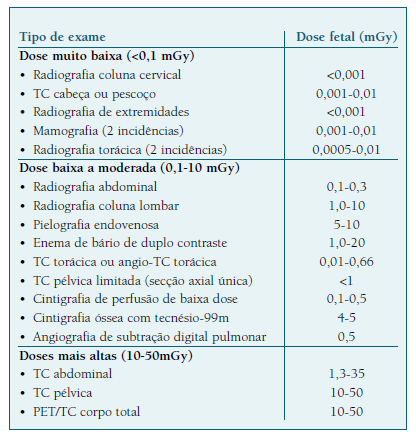
O uso de métodos com radiação ionizante deve ser minimizado. A evidência demonstra uma ligação entre a dose cumulativa de radiação recebida pela grávida, a idade gestacional e os danos para o feto16-18. Durante a organogénese (entre a 2.a e 8.a semana de gravidez), há um risco acrescido de malformações quando é usada uma dose de radiação superior a 100 mGy33. Contudo, nas décadas mais recentes, as técnicas ionizantes evoluíram e as doses de radiação a elas associadas, diminuíram (Quadro I).
O risco de carcinogénese fetal pela exposição a radiação ionizante não está bem definido mas provavelmente é baixo34, não devendo ser proposta a interrupção da gravidez com base na exposição a radiação diagnóstica32.
A restrição do crescimento fetal, microcefalia e a disfunção intelectual são os efeitos adversos mais comuns associados à exposição a altas doses de radiação32 (Quadro II).
A radiografia é segura, pela quantidade mínima de radiação envolvida, devendo utilizar-se proteção abdominal sempre que possível34. Também a mamografia é segura, embora as imagens sejam difíceis de interpretar pela hipervascularização e densidade mamária característica da gravidez28.
A TC pode ser utilizada quando apresenta benefício clínico, devendo ser evitada no 1.o trimestre.
Relativamente à PET/TC, o seu uso na gravidez é controverso, mas deve ser evitada pelo uso de altas doses de radiação18,21.
Métodos de imagem com radiação não ionizante
Quanto à ressonância magnética, não existem precauções ou contraindicações relativamente ao seu uso em mulheres grávidas. Não envolve radiação ionizante e não existem evidências de efeitos adversos fetais29,31-34.
Contraste
As preocupações relacionam-se com a utilização de contraste iodado e gadolínio29-31.
Há situações clínicas em que existe benefício em usar contraste com gadolínio, nomeadamente para avaliar tumores primários ou metastáticos do sistema nervoso central ou para deteção e caracterização de massas hepáticas, renais, suprarrenais, pancreáticas, intestinais, sistema coletor urinário, útero, anexos. A sua administração na gravidez é controversa, uma vez que atravessa a barreira placentária35. Em estudos animais, revelou-se teratogénico em doses altas e repetidas. O uso de gadolínio deve ser limitado a situações em que os benefícios superem os riscos, usando a mínima dose possível. Deve ser evitado no 1.o trimestre9,31,32,35.
O contraste iodado intravenoso pode atravessar a barreira placentar. Contudo, estudos em animais não demonstraram efeito teratogénico nem houve casos reportados de crianças com doença tiroideia após exposição29,35. Este tipo de contraste é utilizado para o diagnóstico de tumores cerebrais, cervicais, pulmonares, gastro-intestinais, génito-urinários, entre outros.
O contraste oral iodado está indicado para o estudo do tubo digestivo e a sua utilização na gravidez não está contraindicada.
Tratamento
Após o diagnóstico e o estadiamento, o tratamento da doença neoplásica é possível durante a gravidez, em circunstâncias bem definidas, sem prejudicar a segurança fetal (Figura 1).
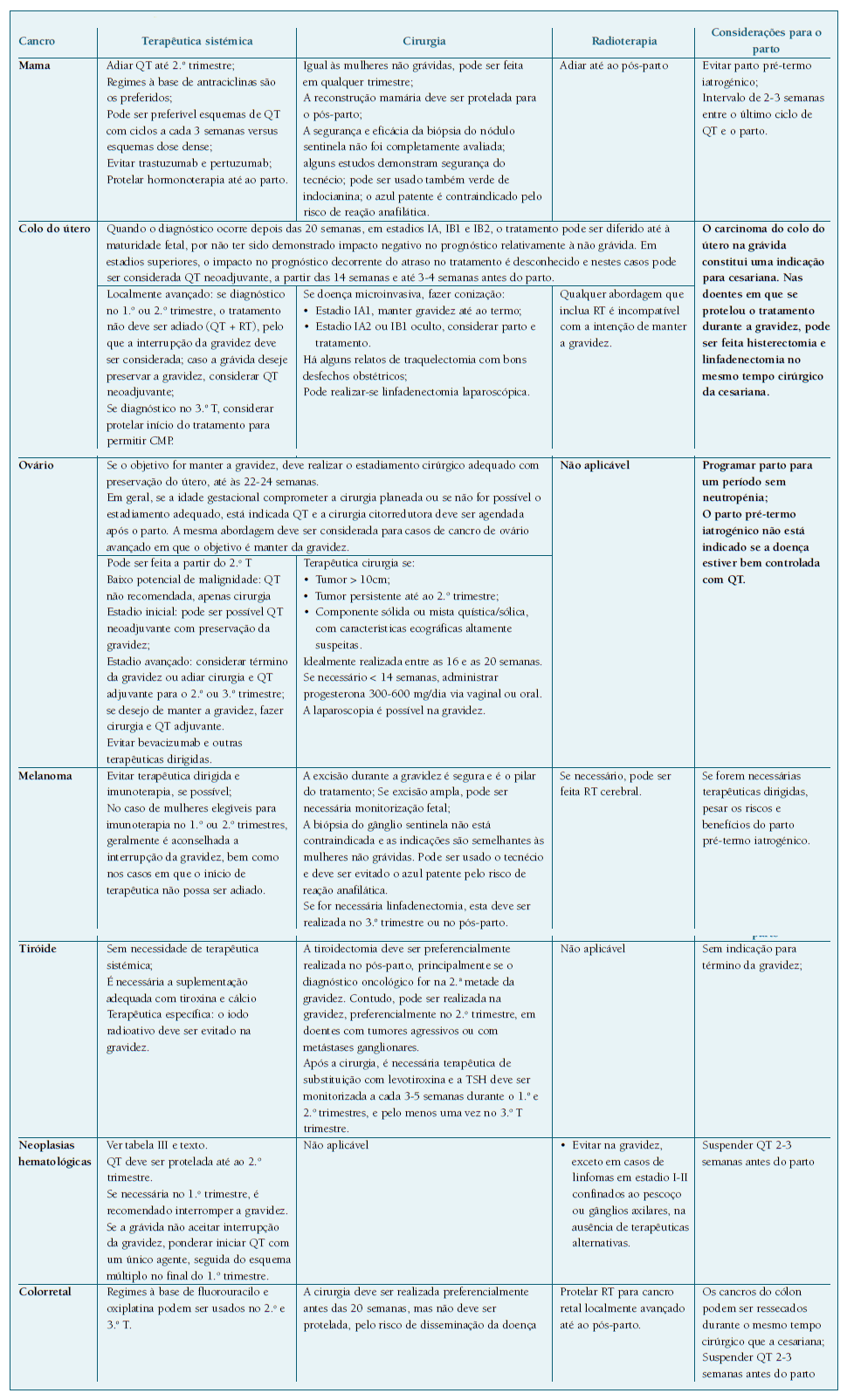
Dependendo do estadiamento, tipo de tumor e idade gestacional, o tratamento poderá ser diferido até à maturidade fetal (como o caso do carcinoma do colo do útero em estádio precoce), sem que tenha sido demonstrado impacto negativo da atitude expectante36,37.
Cirurgia
Em muitos casos, a cirurgia é um pilar fundamental no tratamento oncológico. Geralmente, esta pode ser realizada em qualquer trimestre, com clara evidência de que os procedimentos cirúrgicos e a maioria dos fármacos anestésicos parecem ser seguros para o feto, não devendo ser protelada, se for crucial para o tratamento.
Os riscos obstétricos mais importantes são a perda gestacional, parto pré-termo e a hipóxia fetal, pela redução da perfusão placentária38.
Pelo risco aumentado de aborto, especialmente no 1.o trimestre (1-2%), a cirurgia abdominal deve idealmente ser diferida para o início do 2.o trimestre, após realização do rastreio combinado de aneuploidias1,3,9,30.
Nas cirurgias abdomino-pélvicas major, há um incremento do risco de parto pré-termo e feto leve para a idade gestacional, bem como um aumento da taxa de complicações intra-operatórias e morbilidade, devido ao aumento das dimensões uterinas e aumento do suprimento sanguíneo pélvico1,3,30.
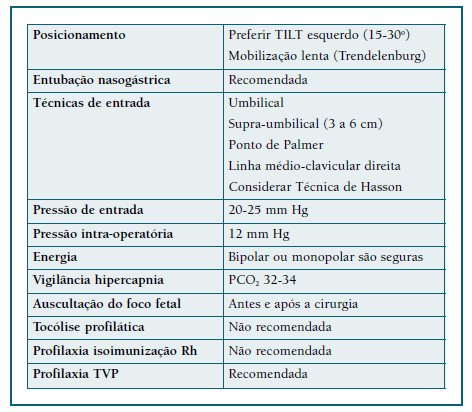
A grávida deve ser colocada em “tilt” esquerdo a partir das 20 semanas, para reduzir a compressão da veia cava inferior pelo útero e manter a pré-carga cardíaca38. Em todas as cirurgias devem ser utilizadas sistemas de compressão pneumática nos membros inferiores. Deve ser feita profilaxia de tromboembolismo venoso com enoxaparina.
Não está indicada tocólise durante a cirurgia, a não ser que haja contractilidade. Se a manipulação uterina for inevitável, considerar tocólise pós-operatória durante 48 horas a partir do fim do 2.o trimestre24,25. Esta pode ser feita com os seguintes fármacos:
Atosiban endovenoso em bomba de perfusão: bólus de 6,75 mg, seguido de 24 ml/h durante 3 horas e, por último, 8 ml/h durante 45 horas;
Nifedipina 10 mg oral de 20 em 20 minutos até três tomas, depois 10-20 mg de 6/6 horas (máximo 120 mg/dia);
Indometacina 100 mg retal, seguido de 25 mg a 6/6 h oral/retal (máximo 200 mg/dia), podendo usar-se até às 32 semanas;
Relativamente à escolha entre a via laparotómica e laparoscópica, a última tem menos efeitos adversos maternos e fetais, pelo que deve ser a preferida, se oncologicamente segura40-45. Os riscos específicos da laparoscopia na gravidez são a hipercapnia, perfuração uterina e redução do fluxo sanguíneo devido ao aumento da pressão intra-abdominal e uso de dióxido de carbono42. No que respeita à técnica: as portas de entrada devem ter em conta a altura do fundo uterino; relativamente à via de entrada, embora nenhuma das técnicas esteja contraindicada, muitos autores dão preferência à via aberta43,46; a pressão intra-abdominal de trabalho deve ser entre 12-15 mmHg (Figura 2).
A escolha pela via laparoscópica na cirurgia abdomino-pélvica deve implicar a presença de equipa multidisciplinar e experiência do cirurgião. Sempre que a cirurgia é realizada após as 24 semanas de gestação, deve ocorrer em hospital com apoio perinatal diferenciado.
As recomendações clássicas para a abordagem laparoscópica na gravidez defendem a sua realização no início do segundo trimestre; contudo, a literatura mais recente demonstrou que pode ser realizada em qualquer trimestre da gravidez de forma segura, não havendo idade gestacional limite para a sua utilização43. Alguns exemplos de cirurgias abdomino-pélvicas major que podem ser realizadas na gravidez por ambas as abordagens, são: colectomia e linfadenectomia regional (cancro colorretal localizado Dukes B-C); gastrectomia (tumores gástricos ressecáveis), anexectomia39.
Quando o feto já atingiu a viabilidade (24 semanas), deve ser discutida a realização de maturação pulmonar fetal e/ou neuroprotecção fetal.
Por último, pelo risco de hipotensão e hipóxia maternas condicionadas pela cirurgia, existe um aumento do risco para o feto, sendo essencial a monitorização materna para prevenção do bem-estar fetal47,48.
Radioterapia (RT)
Os efeitos biológicos da radioterapia são incompatíveis com a gravidez devido à radiossensibilidade e rápido crescimento embrionário/fetal. Os seus efeitos dependem da idade gestacional e da dose de radiação. Portanto, a radioterapia não é recomendada por rotina e deve ser protelada para o período pós-parto, sempre que possível. Contudo, se o atraso for prejudicial para a mãe, pode ser considerada radioterapia não pélvica com proteção abdominal, especialmente no 1.o e 2.o trimestres, em que a distância entre o feto e o local irradiado ainda é grande, reduzindo a exposição fetal. Também deve ser usada em casos de emergências oncológicas (compressão medular, metástases do sistema nervoso central). A RT pélvica é contraindicada na gravidez. Nos casos em que não se pode evitar a RT abdominal e/ou pélvica, deve ser ponderada interrupção da gravidez1,3,9,28,38,49.
Quimioterapia (QT)
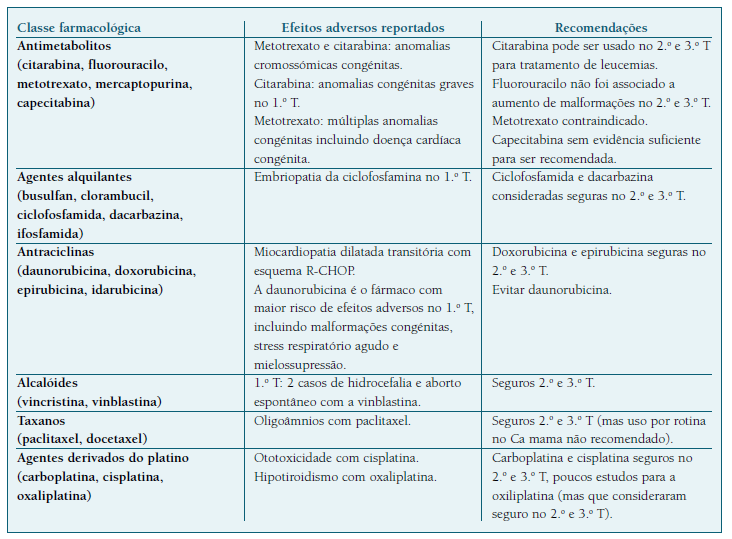
Devido ao seu relativo baixo peso molecular, a maioria dos fármacos citotóxicos conseguem atravessar a placenta. Estudos sobre farmacocinética demonstraram que a placenta atua como tampão, sendo a concentração no compartimento fetal inferior à materna. Este efeito difere consoante a classe de fármacos utilizada: passagem elevada de fármacos à base de platina (57% para a carboplatina) e baixa taxa de passagem para os taxanos (1,4% para o paclitaxel e indetetável para docetaxel) e antraciclinas (4% para epirubicina e 7,5% para doxorubicina) 25-27.
A toxicidade fetal da QT depende da idade gestacional (Quadro III), da dose e do grau de passagem transplacentar. A idade gestacional em que é realizada e o número de ciclos administrados são fatores cruciais para o prognóstico fetal. O 1.o trimestre é o período de maior risco, particularmente durante o período de organogénese, havendo aumento do risco de malformações congénitas, aborto e disfunção orgânica fetal, pelo que a QT não deve ser administrada. Em doentes elegíveis para QT no 1.o trimestre, a interrupção médica da gravidez deve ser considerada3,9,11,38,50.
No 2.o e 3.o trimestres, a maioria dos fármacos são considerados relativamente seguros, sem um risco acrescido de malformações fetais e complicações neonatais major a curto prazo. Foram descritas algumas associações minor a parto pré-termo, restrição de crescimento fetal e feto leve para a idade gestacional38,50-57. Até à data, os benefícios da administração de QT no 2.o e 3.o trimestres superam as desvantagens e não há evidência de que a exposição fetal a QT resulte em problemas de saúde a longo prazo38. Contudo, são necessários mais estudos relativamente à segurança de cada fármaco a longo prazo, nomeadamente no que toca ao neurodesenvolvimento, função cardíaca, problemas dentários, fertilidade futura e neoplasias secundárias.
Relativamente às doses a administrar, apesar da gravidez poder alterar a farmacocinética dos fármacos citotóxicos, as doses não devem diferir relativamente às administradas a mulheres não grávidas3,41.
Esquemas semanais estão associados a menor toxicidade hematológica e a períodos de nadir mais curtos, pelo que devem ser considerados1.
O tempo entre a administração do último ciclo de QT e o parto deve ser pelo menos 3 semanas e deve ser evitado após as 35 semanas, para permitir a recuperação funcional da medula óssea materna e fetal entre o último ciclo e o parto1,3,28.
Terapêutica dirigida
A evidência relativamente ao uso destes fármacos na gravidez é escassa.
Relativamente ao trastuzumab, foi associado a oligoâmnios grave/anidrâmnios, pulmão hipoplásico e morte fetal quando administrado no 2.o e 3.o trimestres, não devendo ser utilizado. Em situações em que os benefícios superem substancialmente os riscos, pode ser considerado o seu uso no 1.o trimestre3,11,27,50.
O Rituximab foi associado a citopénia neonatal. A escassa evidência sugere que possa ser considerado seguro no 2.o e 3.o T3,11,27,50.
O Imatinib foi associado a malformações congénitas e aborto no 1.o trimestre, pelo que não deve ser utilizado nesta fase. Dados relativos à segurança no 2.o e 3.o trimestres são limitados mas não foram descritas malformações major ou minor, podendo ser usado com precaução3,11,27,50.
Os inibidores da angiogénese (como por exemplo o bevacizumab, sorafenib ou sunitinib) estão contraindicados11,14.
Imunoterapia
Dado o seu risco teórico substancial de inibição de resposta imunológica para o feto, o uso de inibidores de CDTA-4 e/ou de PD-1 é apenas aconselhado se o benefício para a mãe superar largamente o risco para o feto11,14.
Hormonoterapia
Apesar da maioria dos fetos expostos nascerem saudáveis, parece haver um aumento do risco de anomalias fetais (genitália ambígua, malformações crânio-vertebrais, Síndrome de Goldenhar e sequência de Pierre-Robin), mas a evidência é limitada e a relação causal ainda não foi estabelecida.
Apesar de não estar universalmente associado a dano fetal58, a maioria dos estudos desaconselha a sua utilização na gravidez27,38,59.
Terapêutica de suporte
Antieméticos: uso é seguro (metoclopramida - Classe não atribuída, Ondansetron - Classe B, após as 10 semanas);
Corticosteroides: hidrocortisona, prednisolona e metilprednisolona são preferíveis relativamente à betametasona e dexametasona;
Fatores de crescimento granulocitário e eritropoietina: a sua segurança ainda não foi extensivamente estudada9,14, mas tem vindo a demonstrar-se que o seu uso é viável na gravidez59. (Quadro IV)
Conduta obstétrica
Vigilância da gravidez
Estudos revelam que quer o cancro na gravidez quer o seu tratamento podem relacionar-se com morte intrauterina, parto pré-termo e alteração do crescimento fetal. Deste modo, a monitorização do crescimento fetal é um pilar fundamental no seguimento destas gravidezes60.
Não existem protocolos consensuais para a vigilância destas gravidezes.
Propomos que as avaliações obstétricas devam coincidir com vindas programadas da grávida ao Hospital (consultas oncológicas, ciclos de tratamento) e rotinas analíticas da gravidez coincidam com eventuais rotinas analíticas pré ou pós ciclo de quimioterapia, minimizando as deslocações ao hospital. Extrapolamos que a vigilância ecográfica deve ser semelhante à das grávidas com risco de restrição de crescimento fetal.
Propomos o seguinte esquema de vigilância:
1.o trimestre: rotinas analíticas habituais, rastreio combinado de aneuploidias entre as 11 e as 13 semanas e 6 dias;
2.o trimestre: rotinas analíticas habituais, ecografia morfológica às 20-22 semanas com medição do comprimento do colo do útero;
3.o trimestre: rotinas analíticas habituais, ecografias para avaliação do crescimento e fluxometrias às 28, 32 e 36 semanas, com avaliação do comprimento do colo do útero às 28 e 32 semanas;
Quando se planeiam usar antraciclinas, deve ser feito um ecocardiograma fetal de base antes de iniciar a terapêutica, com repetição periódica durante o tratamento.
Tanto a gravidez como o cancro aumentam o risco de tromboembolismo venoso. O cancro durante gravidez é uma indicação para ser considerada anticoagulação profilática, especialmente em mulheres com fatores de risco adicionais. O fármaco preferido é a enoxaparina9,11,61.
Parto
Sempre que possível, o parto no termo deve ser o objetivo. O parto não deve ser planeado nas 3 semanas que se seguem à administração de QT (ou intervalo inferior no caso de esquemas a cada 1-2 semanas). Esta janela temporal permite a recuperação da mielossupressão materna e fetal até ao parto, diminuindo o risco de anemia grave e infeção após o parto.
Nos casos em que a prematuridade seja expectável, deve ser feito ciclo de maturação pulmonar com betametasona/dexametasona e neuroprotecção fetal com sulfato de magnésio (até às 32 semanas) 1,3,28,59. A Sociedade Portuguesa de Obstetrícia e Medicina Materno-Fetal recomenda que a corticoterapia seja feita até às 33 semanas e 6 dias e consideramos que esta indicação deve ser semelhante nas grávidas com cancro.
A via de parto é por indicação obstétrica, exceto no cancro cervical ou vulvar, em que na maioria dos casos é recomendada cesariana, pelo risco de implantação de células neoplásicas na episiotomia/laceração62.
Envolvimento da placenta/feto
Há poucos estudos acerca das alterações placentárias em grávidas com cancro, tendo sido descrita a redução do peso da placenta em animais e hipoplasia vilositária. As metástases na placenta são maioritariamente descritas em mulheres com melanoma, neoplasias hematológicas ou neoplasias metastáticas de qualquer tipo e assume-se que se disseminam por via hematogénea. O envolvimento fetal é raro e é sempre precedido de invasão vilosa por células neoplásicas maternas. É essencial o exame histológico da placenta para identificar potencial envolvimento fetal e deve ser fortemente considerado nas mulheres com cancro, principalmente quando existe metastização10,15.
Conclusão
O tratamento de mulheres com cancro durante a gravidez é particularmente delicado, devido à possibilidade de afeção materna e fetal. Nas últimas décadas, houve um aumento da investigação relativamente à segurança do tratamento oncológico durante a gravidez, resultando numa menor taxa de atraso no tratamento destas grávidas.
Contudo, estas grávidas representam um grupo de risco para desfechos obstétricos adversos, sendo fundamental a vigilância da gravidez e o tratamento oncológico num centro experiente, com unidades de cuidados intensivos maternos e neonatais e envolvendo uma equipa multidisciplinar.