Introdução
O ritmo de mineralização óssea é mais acentuado nas fases da infância e da adolescência, estimando-se que 90% da massa óssea adulta é obtida neste período1. É na puberdade, nos estadios 3 e 4 de Tanner, tipicamente entre os 12 e os 14 anos, que a aquisição de massa óssea é mais importante2. A evidência científica existente sugere que a contraceção hormonal pode diminuir a taxa de formação óssea e contribuir para um pico mais baixo de densidade mineral óssea (DMO) nas adultas jovens3.
Tanto o estrogénio como a progesterona desempenham um importante papel ao regular o metabolismo do tecido ósseo4. O estradiol é o fator dominante a influenciar a formação e a manutenção da densidade mineral óssea ao longo da vida da mulher, principalmente inibindo a reabsorção óssea. A administração de estrogénio exógeno, através da contraceção hormonal combinada (CHC), inibe a follicle stimulating hormone (FSH) conduzindo a uma diminuição do estrogénio endógeno e, logo, a uma diminuição da concentração absoluta de estradiol no sangue5,6. Esta situação pode conduzir à diminuição de massa óssea na adolescência, à semelhança do que se passa nas mulheres após a menopausa7. Por isso, a CHC causa preocupação em relação ao impacto na produção de massa óssea.
Os efeitos da CHC na massa óssea são alvo de discussão, já que os estudos realizados até ao momento apresentam resultados discrepantes. Os resultados variam entre efeitos negativos, neutros ou positivos sobre a densidade mineral óssea8,9. Na perimenopausa, o uso de CHC aparenta prevenir a perda de massa óssea, mas a sua utilização deve considerar os critérios de elegibilidade para o uso de CHC neste grupo etário9. Durante a adolescência, em que remodelação óssea é maior, o impacto da CHC na formação do esqueleto e a sua relação com o aumento do risco futuro de complicações como osteopenia ou osteoporose é ainda pouco claro7,8,9.
Em Portugal, o uso de CHC na adolescência é comum não só pela sua efetividade contracetiva, mas também devido aos seus benefícios adicionais como redução da dismenorreia, da síndrome pré-menstrual, de sintomas relacionados com hiperandroginismo como acne e hirsutismo e do fluxo menstrual com prevenção de anemia. O Consenso sobre Contraceção da Sociedade Portuguesa da Contraceção recomenda que, nas adolescentes mais jovens ou com IMC <18 kg/m2, sejam preferidas as formulações com 30 mcg de etinilestradiol (EE) por terem menor impacto na densidade mineral óssea, em detrimento de concentrações mais baixas. Não obstante, é reconhecido o risco de eventos tromboembólicos dependentes da dose de etinilestradiol, principalmente em mulheres mais velhas, com outros fatores de risco associados como obesidade e tabagismo10,11,12,13,14.
Esta revisão tem como objetivo perceber se as formulações de CHC com concentrações mais baixas de EE (<30 μg) têm um impacto negativo a nível ósseo em relação às formulações com concentrações superiores de etinilestradiol (≥30 μg).
Métodos
Para responder ao objetivo deste trabalho foi elaborada uma revisão baseada na evidência. Foi colocada a questão PICO: “Nas adolescentes (População), a contraceção oral combinada contendo menos de 30 μg de EE (Intervenção), em comparação com 30 μg ou mais (Controlo), apresenta maior impacto negativo na densidade mineral óssea (Outcome)?”. Foi realizada a pesquisa de artigos científicos, em todas as línguas, nas categorias de ensaio clínico, metanálise e revisão sistemática na base de dados Pubmed, no dia 18 de fevereiro de 2022, utilizando as palavras-chave: (adolescent [MeSH] OR adolescence [MeSH]) AND (estrogen contraceptive agents [MeSH] OR hormonal oral contraceptives [MeSH]) AND (bone mineral density). Desta pesquisa foram obtidos 4 artigos. Um dos artigos foi excluído por não responder à PICO. Portanto, foram selecionados para leitura integral e elaboração da revisão baseada na evidência 3 artigos (1 ensaio clínico randomizado e 2 revisões sistemáticas). O nível de evidência (NE) e a força de recomendação (FR) dos artigos foram atribuídos usando a escala SORT da American Family Physician15.[9] A seleção dos artigos foi feita em duplicado por 4 autores, com uma taxa de concordância final de 100%. A leitura integral e a avaliação do NE e da FR dos artigos foram realizadas por 4 dos autores. A supervisão final do artigo foi realizado por todos os autores. Esta revisão sistemática foi elaborada com base nas recomendações de PRISMA for systematic review protocols (PRISMA-P) 16.
Resultados
A revisão baseada na evidência foi elaborada com base em três artigos: um ensaio clínico randomizado e duas revisões sistemáticas. O ensaio clínico de Gai et al17 compara a DMO da coluna lombar e do colo femoral, ao longo de 2 anos, entre utilizadoras de EE/desogestrel (30 μg/0,15 mg), utilizadoras de EE/ciproterona (35 μg/2 mg) e não utilizadoras de contraceção hormonal, em 450 adolescentes do sexo feminino entre os 16 e os 18 anos, sem encontrar diferenças estatisticamente significativas entre os três grupos.
Quadro I Estudos que relacionam administração de diferentes dosagens de EE em adolescentes e o seu impacto na DMO.
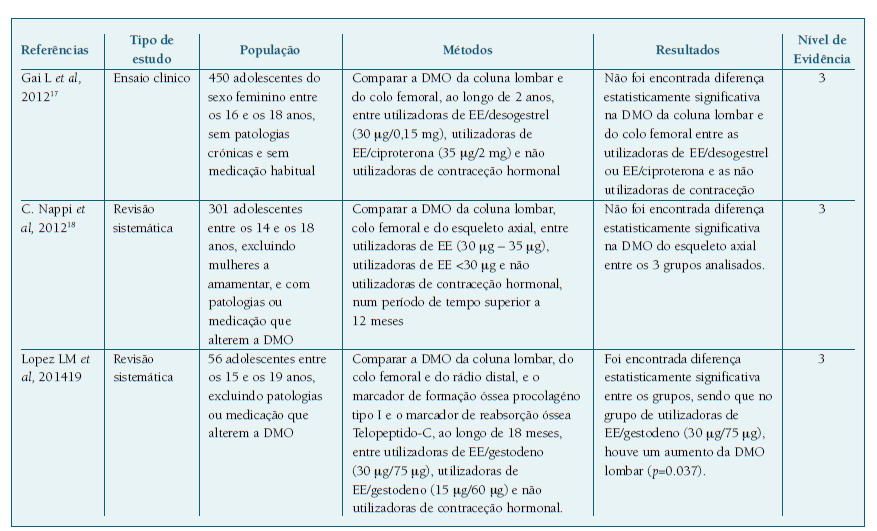
Na revisão sistemática de Nappi et al18 é incluído um estudo que engloba 301 adolescentes entre os 14 e os 18 anos em que é comparada a DMO da coluna lombar, colo femoral e do corpo inteiro entre utilizadoras de EE 30 μg - 35 μg, utilizadoras de EE <30 μg e não utilizadoras de contraceção hormonal, num período superior a 12 meses. Não foram encontradas diferenças estatisticamente significativas entre estes grupos. O mesmo não aconteceu, quando realizaram o mesmo estudo em jovens adultas (19 - 30 anos), verificando-se uma diminuição da DMO da coluna e do corpo inteiro, no grupo a fazer a dose inferior a 30 μg. Estes dados em jovens adultas foram usados para sugerir que uma dose inferior a 30 μg pode ser insuficiente para atingir o pico da densidade mineral óssea na adolescência e levantam a sugestão de se realizarem mais estudos aleatorizados e controlados nesta faixa etária da adolescência.
A revisão sistemática de Lopez 2014 et al19 inclui um artigo no qual se compara a DMO da coluna lombar, do colo femoral e do rádio distal e o marcador de formação óssea procolagéno tipo I e o marcador de rabsorção óssea Telopeptido-C, ao longo de 18 meses, entre utilizadoras de EE/gestodeno (30 μg/75 μg), utilizadoras de EE/gestodeno (15 μg/60 μg) e não utilizadoras de contraceção hormonal, em adolescentes entre os 15 e 19 anos. No grupo de utilizadoras de EE/gestodeno (30 μg/75 μg), houve um aumento estatisticamente significativo da DMO lombar (p=0.037).
Discussão
Com base nos artigos incluídos nesta revisão não é clara a relação entre a dose de EE da CHC e a DMO na adolescência. À data atual não existem estudos aleatorizados e controlados que demonstrem que uma dose inferior a 30 μg de EE condiciona a DMO das adolescentes. Contudo, Nappi et al18, aconselha a contraceção com doses iguais ou superiores a 30 μ, já que aparenta haver algum consenso de que esta é uma dose segura no ganho de DMO, enquanto a dose de 20 μg levanta algumas dúvidas. Lopez et al19 refere que não é possível associar a toma de CHC com a perda de DMO, sendo que só a utilização de acetato de medroxiprogesterona (AMDP) como método contracetivo pode alterar a DMO.
Esta revisão foi baseada em estudos de qualidade, nomeadamente um ensaio clínico randomizado e duas revisões sistemáticas, lidos na íntegra por quatro dos autores. No entanto, todos os estudos são classificados com nível de evidência 3 devido aos seus resultados não serem patient-oriented, ou seja, não refletirem resultados que diretamente melhoram ou prolongam a vida das pessoas. Todos os estudos avaliam a alteração na DMO, que, apesar de poder vir a ter impacto na qualidade de vida das mulheres no que diz respeito ao aumento do risco de fraturas ósseas, constitui um resultado disease-oriented.
A revisão apresenta algumas limitações. Todos os estudos incluídos tiveram uma duração inferior a 2 anos e nenhum incluiu a ocorrência de fraturas como resultado17,18,19. Além disso, o efeito na densidade mineral óssea do progestativo usado em conjunção com o EE não foi estudado e está descrito na literatura que as diferentes propriedades androgénicas podem afetar o processo de mineralização óssea20,21. O ensaio clínico de Gai L et al17 inclui adolescentes a partir dos 16 anos, estando já ultrapassada a fase de maior produção óssea2. Também não foi possível controlar as variáveis independentes que podem influenciar a DMO, como é o caso do peso, atividade física ou ingestão de cálcio5. É ainda importante saber se as participantes nestes estudos, não sofriam de nenhum distúrbio alimentar, como por exemplo a anorexia nervosa, já que esta leva a uma diminuição da DMO. Outro parâmetro não avaliado pelos autores foi o nível de exercício físico que as adolescentes praticavam. Sabemos que é comum em adolescentes que pratiquem exercício físico de alta competição que desenvolvam a tríade da atleta feminina, composta por distúrbios alimentares, amenorreia e osteoporose, o que pode baralhar a análise dos dados.
Conclusão
A AMDP parece ser, até ao momento, o único método com impacto negativo comprovado na DMO, devendo assim ser evitado na perimenopausa e ponderada a sua utilização por períodos prolongados nas adolescentes com IMC < 18 Kg/m2 ou que tomem medicação prejudicial à DMO.
A revisão realizada demonstra que em adolescentes deve ser priorizada a utilização de formulações com doses de etinilestradiol ≥ 30 mcg considerando o seu efeito sobre o metabolismo ósseo (FR C). O facto de só existirem três estudos passíveis de serem incluídos neste trabalho demonstra a falta de evidência robusta nesta área. Uma nova alternativa, que ainda necessita de mais estudos são os CHC com formulações que possuem estetrol, uma versão de estrogénio natural, e que aparentemente não têm efeito negativo na DMO, à luz da evidência atual22.