Introdução
A restrição do crescimento fetal (RCF) é uma complicação obstétrica na qual o feto não consegue atingir o seu potencial genético de crescimento1,2. É definida pela presença de uma estimativa de peso fetal (EPF) ou perímetro abdominal (PAB) inferior ao percentil 3 (P3) para a idade gestacional (IG), ou inferior ao percentil 10 (P10) para a IG, associada a alterações fluxométricas2-4. Pelo contrário, o termo leve para a idade gestacional (LIG) refere-se aos recém-nascidos (RN) com peso ao nascimento inferior ao P10 para a IG e aos fetos com uma EPF ou PAB inferior ao P10 para a IG, sem qualquer alteração na fluxometria Doppler3-5. A maioria dos RN LIG diz respeito a RN saudáveis, fisiologicamente mais pequenos, enquanto que uma percentagem menor apresenta uma verdadeira RCF1,3,6.
A RCF é uma importante causa de desfechos obstétricos adversos pré-natais e neonatais a curto e longo prazo, pelo que a investigação de uma terapêutica eficaz na profilaxia da RCF assume um carácter de extrema importância na área da obstetrícia1-3. Diversos fármacos têm sido estudados com o intuito de prevenir a RCF. Apesar dos vários estudos já desenvolvidos, não existe ainda nenhuma medicação com aprovação e consenso científicos para a profilaxia da RCF1,2.
O principal objetivo desta revisão é avaliar a eficácia e limitações do ácido acetilsalicílico (AAS), da heparina de baixo peso molecular (HBPM), da pravastatina e do sildenafil, de modo a aferir acerca da sua aplicabilidade clínica na profilaxia da RCF.
Metodologia
Na base de dados Pubmed, foi criada uma equação de pesquisa, com recurso aos Medical Subjects Heading Terms (MeSH): (“Fetal Growth Retardation”(Mesh)) AND ((“Aspirin”(Mesh)) OR (“Heparin, Low-Molecular-Weight”(Mesh)) OR (“Pravastatin”(Mesh)) OR (“Sildenafil Citrate”(Mesh))). Esta equação foi limitada ao período temporal de 2016 a dezembro de 2022 e restrita aos artigos publicados nas línguas inglesa, francesa e portuguesa, o que permitiu a obtenção de um total de 122 artigos. Foram incluídos ensaios clínicos randomizados, meta-análises, revisões sistemáticas, revisões narrativas, estudos coorte, estudos caso-controlo e estudos transversais. Foram excluídos estudos com animais, protocolos de estudos, comentários, artigos sem versão completa disponível e todos os artigos cujos objetivos eram díspares ao de esta revisão. Dos 122 artigos iniciais, foram selecionados 23.
Foram, adicionalmente, selecionados 11 artigos das bases de dados PubMed e ScienceDirect, face à sua pertinência em relação ao tema do trabalho. As guidelines da Federação Internacional de Ginecologia e Obstetrícia (FIGO) e o Protocolo do Hospital Universitário Sant Joan de Déu da Universidade de Barcelona foram igualmente incluídos na lista de referências.
Com base nos critérios de inclusão e exclusão supramencionados, selecionou-se um total de 36 artigos que foram o suporte literário desta revisão.
Discussão
Definições da restrição do crescimento fetal
De acordo com as guidelines da FIGO, a RCF é uma patologia definida pela incapacidade do feto atingir o seu potencial de crescimento1. O diagnóstico diferencial entre a RCF e LIG é feito através da determinação da EPF ou do PAB para a IG e da pesquisa de possíveis alterações fluxométricas na artéria umbilical (AU), artéria uterina (AUt) ou artéria cerebral média (ACM) 1,4,5. A maioria destes fetos são LIG, ou seja, constitucionalmente mais pequenos, apresentando um desvio estatístico na EPF, mas que está de acordo com o seu potencial genético de crescimento1,3,6,7.
A RCF pode ter etiologia materna, fetal ou placentária1. De entre as várias causas de RCF, a etiologia placentária é a mais frequente, principalmente devido a anomalias da placentação1,2,6,8. Durante a gravidez, verifica-se um conjunto de alterações na circulação uterina que permite uma correta placentação5. Ocorre a invasão das artérias espiraladas do útero materno pelo trofoblasto, o aumento da produção de óxido nítrico (ON) e a promoção da angiogénese pelo aumento da produção de fator do crescimento do endotélio vascular (VEGF) e do fator de crescimento placentário (PlGF) 5,8. Esta simbiose de fatores permite a criação de uma circulação uterina de alto fluxo e baixa resistência, que garante um aporte otimizado de oxigénio e nutrientes ao feto5. Por oposição, a incorreta placentação provoca um remodeling deficitário das artérias espiraladas do miométrio, redução do VEGF, do PlGF, aumento da forma solúvel da tirosina quinase-1 do tipo fms (sFlt1) e, por consequência, a circulação uterina torna-se de alta resistência e de baixo fluxo5,8. Estas anomalias culminam na anormal perfusão placentária, isquémia placentária e stress oxidativo, que comprometem o normal crescimento do feto. Clinicamente, esta disfunção placentária é a base fisiopatológica de diferentes eventos adversos da gravidez, como a RCF e a pré-eclâmpsia (PE) 8,9. Por outro lado, como consequência da alta resistência da circulação uterina, aumenta a propensão para um estado de hipercoagulabilidade da circulação materna, com maior risco de fenómenos de coagulação focal no espaço interviloso, deposição placentária de fibrina, trombose e enfartes placentários9.
A RCF pode ser classificada em RCF precoce ou tardia, consoante a IG em que é diagnosticada (Figura 1) 10. A RCF precoce é aquela que é diagnosticada antes das 32 semanas de IG e tem uma prevalência de 0,5 a 1%. É mais fácil de diagnosticar, mas mais difícil de abordar, uma vez que é necessário balancear os prós e contras entre o parto pré-termo (PPT) e o risco de hipóxia fetal11. A RCF tardia, diagnosticada a partir das 32 semanas de IG, inclusive, tem uma prevalência de 5 a 10% e é, geralmente, mais difícil de diagnosticar, mas mais fácil de abordar pela maior proximidade ao termo da gestação1.
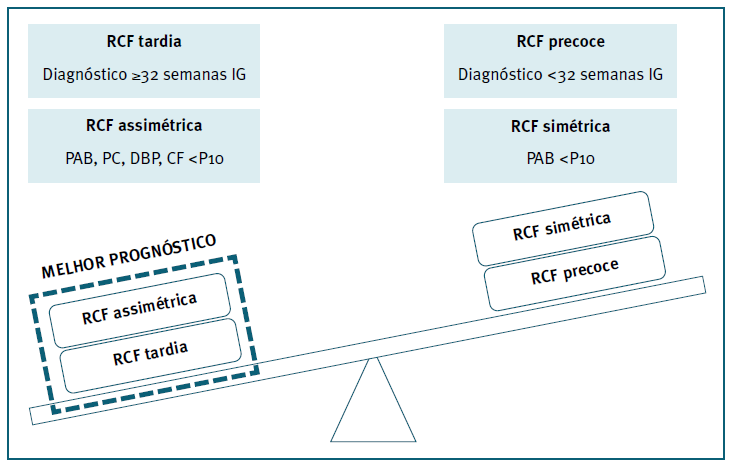
Figura 1 Classificação da RCF em precoce e tardia, consoante a IG de diagnóstico e em simétrica e assimétrica, consoante os parâmetros biométricos inferiores ao P102,6,10.
Quando os vários parâmetros biométricos (PAB, perímetro cefálico, diâmetro biparietal e comprimento do fémur) são proporcionalmente inferiores ao P10, a RCF é classificada como simétrica6. Esta representa 20 a 30% dos fetos com RCF e é devida, maioritariamente, a um evento adverso de etiologia materna ou fetal decorrente durante o primeiro trimestre. Está, por isso, associada à RCF precoce e a pior prognóstico2,6. A RCF assimétrica é caracterizada pela presença exclusiva de um PAB inferior ao P10 e representa 70 a 80% dos casos de RCF6. Ocorre preferencialmente no final do segundo trimestre e no terceiro trimestre. A sua principal causa assenta no desenvolvimento de anomalias da placentação, o que justifica a presença concomitante de PE6,7.
Complicações da restrição do crescimento fetal
A RCF é uma importante causa de complicações pré-natais e neonatais1. Durante a gravidez, pode causar complicações como PPT, PE e, in extremis, morte fetal in utero. Como complicações neonatais precoces destacam-se a mortalidade neonatal, hipoglicemia, hipotermia, hiperbilirrubinemia, dificuldade respiratória, hemorragia intraventricular e enterocolite necrotizante. A longo prazo, destacam-se alterações do neurodesenvolvimento, paralisia cerebral, síndrome metabólica, hipertensão arterial, diabetes mellitus, obesidade e doença cardiovascular1,3. Consequentemente a estas complicações, cerca de 10% de todos os custos de saúde com crianças estão associados a cuidados relacionados com baixo peso ao nascimento12.
Prevenção não farmacológica da restrição do crescimento fetal
Estima-se que após uma gravidez com RN LIG, a percentagem de recorrência seja de 20 a 30%3. Relativamente à recorrência da RCF, esta complicação obstétrica apresenta uma percentagem de recorrência de aproximadamente 25%1.
Numa fase inicial, a avaliação de fatores de risco, modificáveis e não modificáveis, adquire um papel fundamental na prevenção da RCF1. Vários estudos demonstram uma associação entre o desenvolvimento de RCF e a presença de certos fatores de risco, tais como: idade materna avançada, tabagismo, baixo índice de massa corporal, obesidade, diabetes mellitus, ferropenia, consumo de álcool e drogas ilícitas, síndrome antifosfolipídica e trombofilias hereditárias3,5,13,14. Idealmente, todas as mulheres deveriam ter um acompanhamento pré-concecional que promovesse uma dieta equilibrada e diversificada, a melhoria do estilo de vida, a cessação tabágica e alcoólica, a otimização do índice de massa corporal e de doenças crónicas maternas. Estas medidas são importantes, não apenas para a prevenção da RCF numa gravidez de risco, mas a sua implementação apresenta, simultaneamente, benefícios médicos para uma gravidez de baixo risco1,3,5.
Tendo em conta as complicações e desfechos obstétricos adversos que podem decorrer secundariamente à RCF e a significativa taxa de recorrência da mesma, a profilaxia farmacológica da RCF adquire um foco importante, visto que nenhum fármaco se encontra aprovado cientificamente para a prevenção da RCF1,3.
Prevenção farmacológica da restrição do crescimento fetal
Ácido acetilsalicílico
O AAS é um fármaco responsável pela inibição irreversível das enzimas ciclo-oxigenase 1 e 2. Para doses mais baixas (50 mg a 300 mg), tem uma afinidade preferencial pela ciclo-oxigenase 1, o que lhe confere uma ação antiagregante plaquetar. Para doses superiores (>1000 mg) prevalece a ação anti-inflamatória por inibição preferencial da ciclo-oxigenase 215. Para além da ação antiagregante plaquetar, o AAS favorece a implantação do blastocisto, reduz a apoptose das células do trofoblasto, aumenta os níveis de ON e diminui o stress oxidativo3,8,16. É um fármaco seguro na gravidez, mas deve ser evitado a partir das 37 semanas de IG1,15,17.
Vários estudos já mostraram a eficácia do AAS na prevenção da PE, contudo a sua ação profilática na RCF é, na maioria das vezes, um desfecho secundário3,5,15.
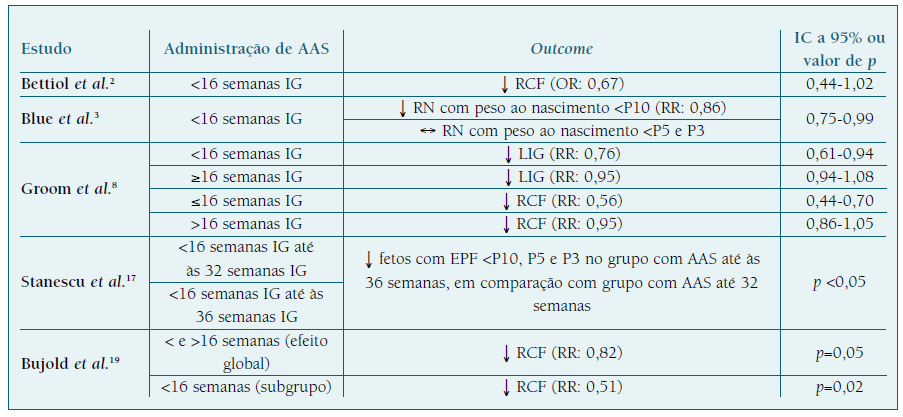
A eficácia e a significância do AAS estão dependentes de dois fatores: a IG de início da toma e a dose administrada10,18.
No que diz respeito à IG de início da prescrição do AAS, diversos estudos mostram que o seu início antes das 16 semanas de IG apresenta uma ação preventiva estatisticamente significativa, por oposição ao seu início após essa IG que, apesar de ter ação profilática na RCF, deixa de o fazer com significância estatística3,8,18. No Quadro I encontram-se os resultados de diversos estudos que mostram a dependência da ação do AAS relativamente à IG de início2,3,8,17,19. Esta dependência ainda não se encontra completamente esclarecida, mas pensa-se que se relaciona com a fisiologia placentária. Os processos que regulam o fluxo e resistência das artérias espiraladas uterinas ocorrem até às 16/18 semanas de IG e, por isso, a administração de AAS antes da conclusão da placentação terá maior impacto na redução dos distúrbios vasculares placentários18.
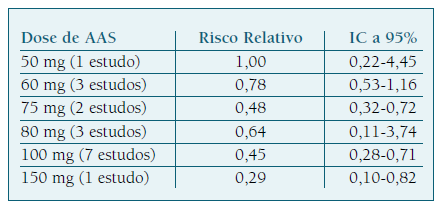
Relativamente à dose ideal a administrar, a literatura mostra-nos que a ação profilática do AAS na RCF é maior e significativa para doses entre 100 e 150 mg, comparativamente a doses inferiores (Quadro II). 18
Heparina de Baixo Peso Molecular
As HBPM são um conjunto de fármacos pertencentes à classe dos anticoagulantes. A sua ação anticoagulante é devida à ligação à antitrombina III, tornando-a num rápido inativador de fatores de coagulação, principalmente a trombina e o fator X20,21. Têm, ainda, ação anti-inflamatória e imunomoduladora, que promove o aumento da produção endotelial de ON, a diferenciação do trofoblasto, o aumento da produção de PlGF e diminuição do processo de aterosclerose3,8,20-22. São fármacos seguros na gravidez, com baixo risco hemorrágico, de trombocitopenia e de osteoporose induzidos pela HBPM8,20,23.
Na prática clínica, a HBPM é utilizada para o tratamento e prevenção do tromboembolismo venoso durante a gravidez e no período pós-parto, bem como no tratamento da síndrome anti-fosfolipídico e de trombofilias hereditárias3,8,20. Uma vez que as complicações placentárias, nas quais se inclui a RCF, poderão estar associada a um perfil pró-trombótico e à diminuição do fluxo da circulação uteroplacentária, a HBPM parece ter potencial na prevenção da RCF, devido à sua ação anticoagulante, mas também ao seu perfil pró-angiogénico8,20,22.
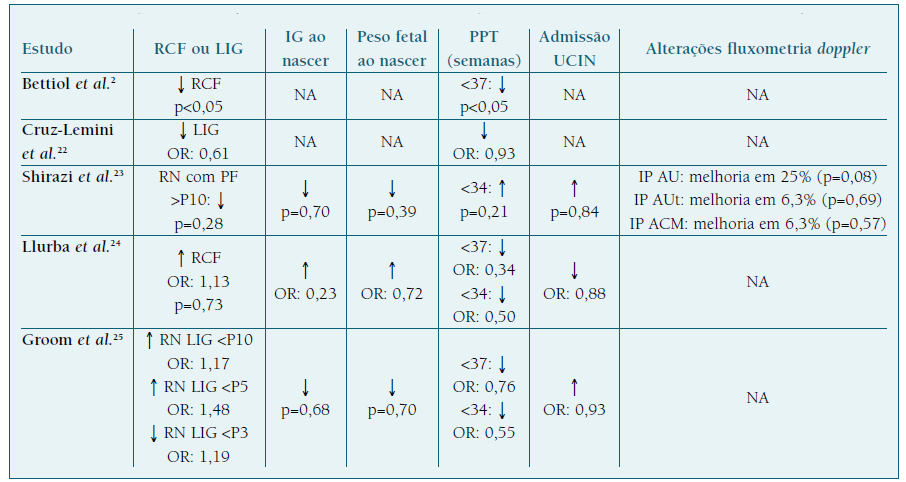
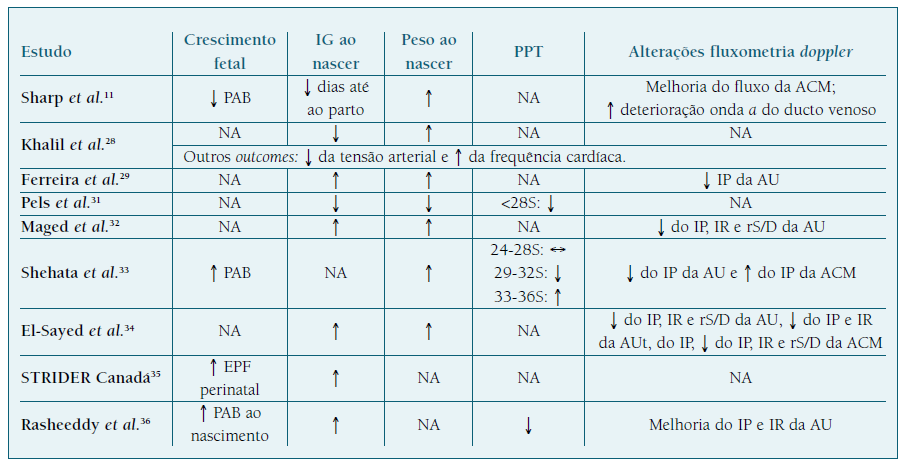
Tal como é possível verificar pela análise do Quadro III 2,22-25, alguns estudos realizados em mulheres grávidas a tomar HBPM apresentam resultados positivos e benéficos na profilaxia da RCF. Contudo, nem todos os estudos demonstram uma ação preventiva, o que reflete a disparidade entre resultados8,20. Relativamente a outros desfechos obstétricos, os estudos mostram um potencial efeito benéfico, através do aumento do peso e da IG ao nascimento, da diminuição do PPT e ainda pela melhoria do perfil fluxométrico das AU, AUt e ACM. Esta ação na fluxometria Doppler pode ser devida ao perfil pró-angiogénico da HBPM, que já mostrou aumentar os níveis de PlGF e diminuir o ratio sFlt1/PlGF em mulheres a tomar HBPM durante a gravidez5,8. À semelhança do AAS, também a ação da HBPM parece ter mais impacto quando administrada antes das 16 semanas de IG2,22-25.
Em relação à comparação da eficácia da ação da enoxaparina com a dalteparina, Cruz-Lemini et al., numa revisão sistemática com meta-análise, mostrou que, apesar de a enoxaparina diminuir a ocorrência de RN LIG (OR de 0,75), não teve um efeito preventivo significativo (p=0,15), enquanto que a dalteparina apresentou uma profilaxia estatisticamente significativa (OR de 0,48; p<0,01) 22. Mastrolia et al. obteve resultados concordantes, apresentando uma diminuição significativa da RCF (p<0,01) com a utilização de dalteparina, comparativamente ao efeito não significativo obtido com a enoxaparina (p=0,3) 20.
Pravastatina
A pravastatina é um fármaco da classe das estatinas cuja principal ação é a inibição da síntese de colesterol. Apresenta, simultaneamente, ações anti-inflamatória, antioxidante e pró-angiogénica. Estudos em animais mostram que a pravastatina aumenta os níveis de VEGF, de PlGF e diminui os níveis de sFlt-1, o stress oxidativo e os radicais livres, o que faz com que o seu perfil pró-angiogénico seja encarado como favorável na prevenção da RCF5,8,26. Apesar de aparentemente seguro na gravidez, encontra-se classificado na categoria X da Food and Drug Classification, o que justifica o baixo número de ensaios clínicos com pravastatina na profilaxia da RCF27.
Num estudo prospetivo, Mendoza et al. avaliou a ação da pravastatina em mulheres grávidas já diagnosticadas com RCF. O estudo mostrou uma diminuição estatisticamente significativa (p<0,001) do ratio sFlt-1/PlGF no grupo sob pravastatina, comparativamente ao grupo controlo, o que salienta o potencial pró-angiogénico da pravastatina. No que respeita ao desenvolvimento da gravidez, o grupo experimental apresentou uma média de peso fetal ao nascimento superior em 260 g e um aumento de 16,5 dias na média de duração da gravidez. Contudo, estes não foram estatisticamente significativos27.
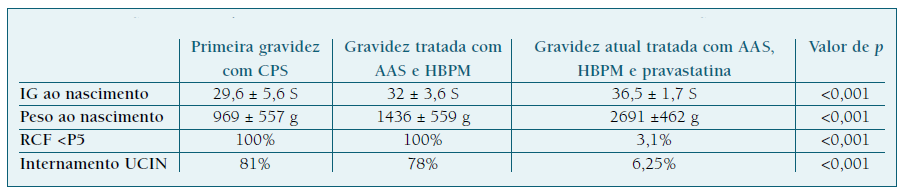
Kupferminc et al., num estudo retrospetivo de coorte, concluiu que a inclusão de pravastatina à terapêutica com AAS e HBPM numa fase precoce da gravidez (12 semanas de IG) demonstrou resultados favoráveis e significativos em mulheres com antecedentes de complicações placentárias, comparativamente à terapêutica dupla com AAS e HBPM. Neste estudo foram selecionadas mulheres com uma primeira gravidez com complicações placentárias, à qual se seguiu uma segunda gravidez tratada com AAS e HBPM. Apenas as mulheres com complicações de etiologia placentária na segunda gestação foram incluídas no estudo, tendo sido acompanhadas numa terceira gravidez e tratadas com AAS, HBPM e pravastatina previamente ao desenvolvimento de complicações. No Quadro IV encontram-se os resultados deste estudo. Para além da melhoria estatisticamente significativa da IG e peso ao nascimento, a inclusão de pravastatina demonstrou diminuição significativa da ocorrência de RCF, comparativamente à terapêutica dupla com HBPM e AAS26.
Sildenafil
O sildenafil é um fármaco da classe dos inibidores da enzima fosfodiesterase tipo 5 (FDE-5), que potenciam a ação vasodilatadora do ON3,8,11,28. A nível cardiovascular, verifica-se a estimulação da vasodilatação, a diminuição da resistência vascular periférica, da pressão arterial e a potencial melhoria da circulação e função uteroplacentárias8,28. É um fármaco seguro na gravidez8,29. Contudo, os fetos expostos ao sildenafil parecem ter maior risco de desenvolver hipertensão pulmonar neonatal. Esta reação adversa foi responsável pela interrupção precoce de alguns estudos3.
Durante uma gravidez normal, o ON desempenha um papel fundamental no suporte nutricional e de oxigénio ao feto, através da vasodilatação30. Na RCF ocorre o aumento da atividade da FDE-5, a diminuição da libertação de ON e a vasoconstrição das artérias espiraladas uterinas, dificultando o suporte supramencionado. O sildenafil é, por isso, uma terapêutica promissora na potenciação da perfusão placentária e no tratamento da RCF5,8,28.
No Quadro V são apresentados os resultados da sildenafil em mulheres grávidas já diagnosticadas com RCF. Os estudos mostram resultados controversos relativos a desfechos obstétricos secundários, como a IG ao nascimento, peso ao nascimento e PPT. A ação do sildenafil na fluxometria Doppler demonstra resultados promissores relativos a estes desfechos, contudo os estudos constatam que essa ação apenas se encontra presente numa fase precoce após a administração do sildenafil e que a sua janela temporal de duração é curta, perdendo o efeito passado algumas horas11,28,29,31-36.
Conclusão
A RCF é uma complicação obstétrica na qual existe um mecanismo fisiopatológico que impede o feto de atingir o seu potencial genético de crescimento. É uma importante causa de complicações pré e pós-natais e apresenta uma recorrência de 25%. Por este motivo, a prevenção farmacológica da RCF, numa IG precoce o suficiente que potencie a ação dos fármacos, adquire extrema importância na área da obstetrícia.
A maioria dos estudos mostra que a administração de uma baixa dose de AAS (100 a 150 mg) antes das 16 semanas de IG apresenta resultados significativos na prevenção da RCF.
A administração de HBPM, também antes das 16 semanas de IG, apresenta resultados contraditórios relativamente à profilaxia da RCF, mas efeitos promissores nos desfechos fluxométricos da circulação maternofetal e em desfechos secundários como PPT, IG e peso fetal ao nascimento.
A pravastatina apresenta uma promissora ação pró-angiogénica, por exemplo através da diminuição significativa do ratio sFlt-1/PlGF. Os estudos mostram, também, um efeito potencialmente importante na prevenção da RCF e de desfechos obstétricos, principalmente quando associada ao AAS e à HBPM.
Os resultados relativos à administração do sildenafil após o diagnóstico de RCF apresentam alguma discrepância entre si, contudo, muitos mostram uma melhoria de desfechos obstétricos secundários, como IG e peso ao nascimento e dos desfechos fluxométricos da circulação maternofetal. Esta ação parece, contudo, limitada a uma janela temporal restrita.
Em conclusão, o AAS e a HBPM são fármacos já utilizados de forma segura na obstetrícia em algumas patologias, como doenças hipertensivas e em trombofilias. Por outro lado, a pravastatina e o sildenafil são apenas usados em contexto experimental. Os quatro fármacos apresentam um perfil promissor na prevenção da RCF e na melhoria da circulação maternofetal, pelo que poderão ser possíveis terapêuticas a utilizar na profilaxia desta frequente complicação obstétrica, em gravidezes identificadas como sendo de alto risco.