Introdução
O cancro da mama constitui uma preocupação global1 dada a sua elevada incidência, 2,3 milhões de novos casos no mundo em 2020, e a mortalidade associada, 6,9% do total de mortes por cancro em 20202.
A maior incidência em países desenvolvidos reflete uma maior prevalência de exposição a fatores de risco hormonais e reprodutivos, bem como fatores de risco associados ao estilo de vida. Ademais, junta-se a crescente deteção de cancro da mama em estadios precoces da doença devido aos programas de rastreio3.
A história reprodutiva confere um risco aumentado de cancro da mama quando se verifica uma menarca precoce (<12 anos) e uma menopausa tardia (>55 anos) 4, pelo maior período de exposição a estrogénios endógenos. A idade avançada aquando da primeira gravidez (> 35 anos) 5 e a nuliparidade - cada vez mais presente no mundo atual, associado à crescente presença das mulheres no mundo profissional -, tal como a não amamentação e obesidade, contribuem igualmente para um maior risco de desenvolver a doença6.
Os estrogénios, quer endógenos quer exógenos, aumentam o risco de cancro da mama6. O papel do componente progestativo na carcinogénese mamária continua a ser alvo de estudo, no entanto a exposição a progestativos combinados com estrogénios está associada a um aumento do risco de cancro da mama7. As principais fontes de estrogénios exógenos são a contraceção e terapia hormonais.
O contracetivo oral combinado (COC) é amplamente usado desde a década de 19605,8, com uma utilização média de cerca de 5 anos9. Esta parece constituir um fator de risco para cancro da mama, o que motivou a reformulação da sua composição quer na dose de estrogénio, quer nas moléculas de progestativo disponíveis8.
Alguns estudos realizados indicam que a utilização de contracetivos orais parece estar associada a um pequeno ou nenhum aumento no risco de cancro da mama10,11,12. Esta associação parece aumentar com a duração do uso e desaparecer após a interrupção da contraceção. No entanto, estas revisões carecem da discriminação do tipo de contracetivo oral, pelo que o presente trabalho se propõe avaliar a relação entre a duração da exposição a COC e o impacto na incidência de cancro da mama. Assim, realizou-se uma revisão sistemática para avaliar se existe maior incidência de cancro da mama em mulheres em idade fértil com exposição a COC superior a 5 anos, em comparação com mulheres com exposição a COC inferior a 5 anos.
Metodologia
Esta revisão sistemática, cuja formulação da questão de investigação obedece à estrutura PICO13 (Quadro I), tem como objetivo estudar a associação entre a exposição a COC em mulheres em idade fértil num período inferior ou superior a 5 anos e respetiva incidência de cancro da mama. O outcome definido, incidência de neoplasia da mama, será avaliado através das seguintes medidas de efeito: Odds Ratio, Hazard Ratio, Relative Risk e Incidence Rate Ratio.
A pesquisa bibliográfica foi efetuada através das bases de dados PubMed, Web of Science e Trip Database. As palavras-chave utilizadas na pesquisa foram: “woman” or “female” and “contracept*” or “contraceptive use” or “contraceptives oral combined” or “contraceptives oral hormonal” and “breast neoplasms”. Foram utilizados os operadores booleanos AND e OR para maximizar a pesquisa.
Selecionámos artigos publicados entre 2002 e 2022, incluindo ensaios clínicos, casos- controlo, estudos observacionais transversais e revisões, em língua inglesa e portuguesa, que consideraram o tempo de exposição a COC em mulheres em idade fértil. Foram excluídos os artigos sem versão em inglês ou português; em que a população incluía mulheres com mutação BRCA; e que não permitem avaliar a diferença entre a exposição de COC durante menos e mais de 5 anos.
A seleção de evidência bibliográfica foi realizada por 2 revisores de forma independente. Após este processo de seleção, a análise e recolha de dados foi efetuada pelo investigador principal, sendo revista pelos co-investigadores. Foi utilizada uma ferramenta de avaliação de risco de viés da Agency for Healthcare Research and Quality14, para avaliar o risco de viés, nomeadamente viés de seleção e viés de reporte de dados, e também a Strenght of Recommendation Taxonomy - SORT15 para estratificar o nível de evidência dos artigos selecionados.
Após a elegibilidade dos artigos que foram incluídos nesta revisão sistemática, os mesmos foram comparados entre si em termos de tamanho da população e resultados obtidos, cuja informação se encontra reportada, em forma de tabela, nos resultados.
Resultados
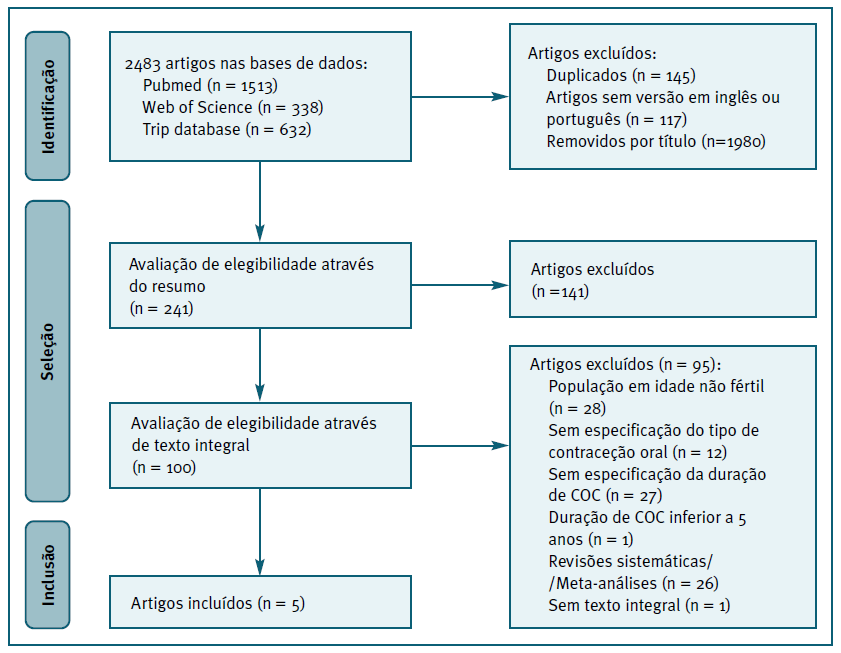
Com o auxílio do “Rayyan”, uma ferramenta inteligente de software de revisão sistemática, a seleção de artigos foi realizada em duas fases, de acordo com a estrutura da PRISMA-P checklist16 (Figura 1), de modo a delinear o processo de pesquisa sistemática adotado, evidenciando as bases de dados analisadas e os motivos que justificaram a exclusão dos artigos.
Na primeira fase de pesquisa, de acordo com as palavras-chave definidas, foram obtidos 2483 resultados. Na segunda fase de seleção, obteve-se 241 artigos que foram analisados com base no resumo (abstract), dos quais 100 foram identificados como potencialmente elegíveis. Após a leitura integral dos 100 artigos, 5 artigos foram incluídos para extração de dados.
Foram incluídos artigos cuja população abrange mulheres com uma idade igual ou inferior a 40 anos. Na medida em que a menopausa, habitualmente, ocorre entre os 45 e 55 anos17, considerou-se o cut-off de 40 anos em conformidade com o objetivo desta revisão, estudar mulheres em idade fértil, e assim minimizar o enviesamento dos resultados obtidos, acautelando a possibilidade de haver estudos com informação omissa relativamente à fase reprodutiva da mulher. Para integrar a informação disponível, foram analisados os dados referentes às mulheres a realizar apenas COC.
Estudos que parecem satisfazer os critérios de inclusão18-20, mas não especificam o tipo de contracetivo oral utilizado, não foram incluídos nesta revisão para não enviesar os dados obtidos. Estudos cujo cut-off na separação de dados pela idade da mulher ultrapassa os 40 anos21-23 foram igualmente excluídos. O estudo de Yuan et al., 201924 analisa o uso de COC em mulheres pré-menopausa, porém considera um intervalo de tempo inferior a 5 anos (39 meses) e foi excluído por não permitir avaliar a diferença entre a exposição de COC durante menos e mais de 5 anos.
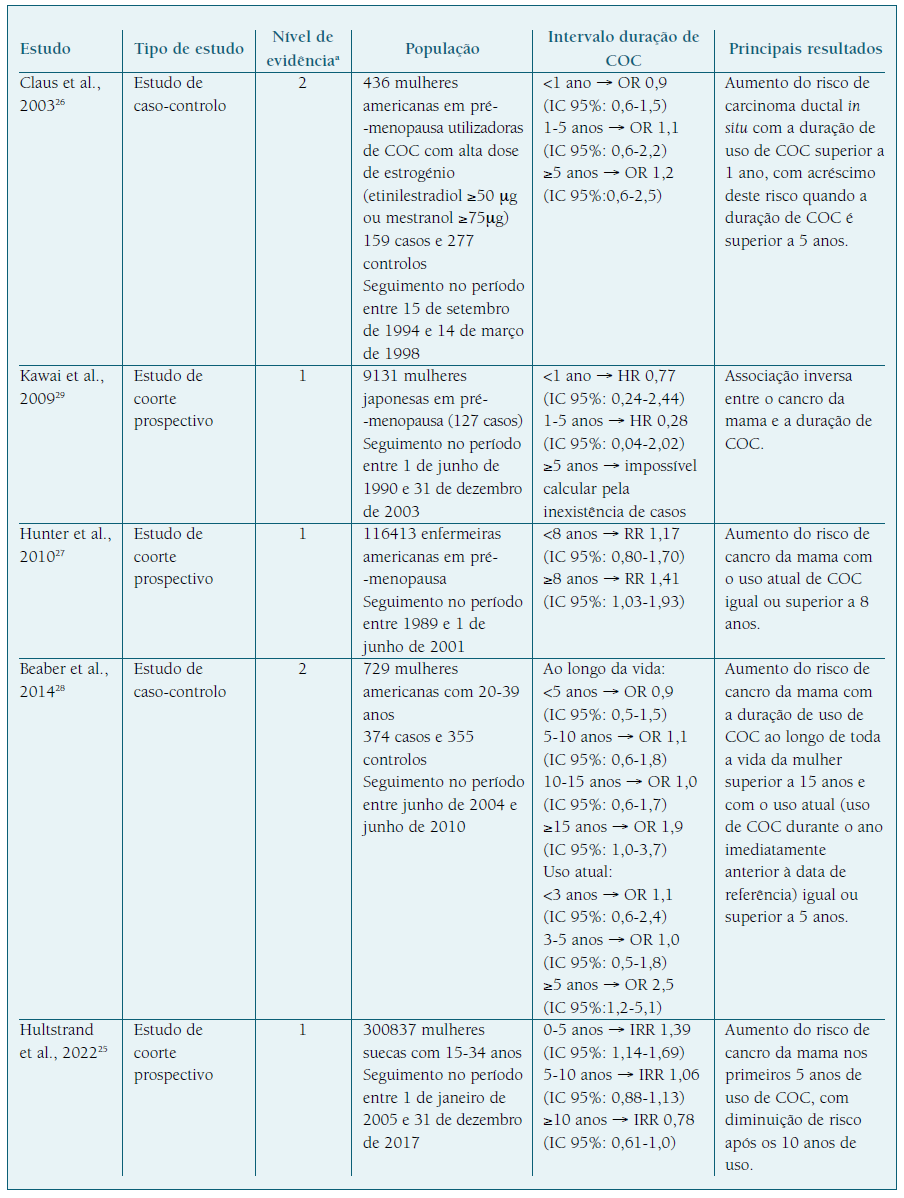
O Quadro II sumariza os artigos incluídos, descrevendo-os e fornecendo os seus principais resultados. Dos 5 estudos incluídos nesta revisão, encontram-se 2 estudos de caso-controlo e 3 estudos de coorte prospectivo. Verifica-se um predomínio americano nos artigos, sendo 3 dos Estados Unidos da América, 1 da Suécia e 1 do Japão.
Após aplicação da ferramenta de risco de viés da Agency for Healthcare Research and Quality14, verificou-se um viés de reporte no estudo de Hultstrand et al. 25, 2022, uma vez que os dados fornecidos se referem à população em pessoa-anos (no total foram incluídas 1 652 364 mulheres com um tempo médio de acompanhamento de 8,7 anos, resultando em 14 330 806 pessoa-anos). Para facilitar a leitura do Quadro I, procurou-se uniformizar os dados obtidos de modo a ter uma perceção geral da população estudada, pelo que estes dados foram convertidos para número de mulheres (através de uma regra de três simples), o que permitiu calcular a população estimada de mulheres a realizar somente COC (aproximadamente 300 837).
Discussão
Três dos estudos incluídos26-28 nesta revisão demonstram uma associação positiva entre a duração do uso de COC superior a 5 anos e a incidência de cancro da mama. Contudo, atendendo ao período de seguimento de dois destes estudos (Claus et al. 26 e Hunter et al. 27), as doses de etinilestradiol utilizadas não seriam compatíveis com as doses utilizadas atualmente. No estudo de Beaber et al. 28, verifica-se um aumento do risco com a duração de uso de COC ao longo de toda a vida da mulher superior a 15 anos e com o uso atual (uso de COC durante o ano imediatamente anterior à data de referência) igual ou superior a 5 anos.
No entanto, os restantes estudos25,29 analisados apresentam resultados contraditórios. No estudo de Hultstrand et al., 202225, demonstraram um aumento do risco de cancro da mama nos primeiros 5 anos de utilização de COC. Contudo, após os 5 anos de uso de COC, o risco de cancro da mama torna-se semelhante ao da restante população, inclusive torna-se inferior após os 10 anos de uso. Este resultado pode ser justificado pelo facto de nos primeiros 5 anos de utilização de COC as mulheres apresentarem idades mais precoces para o diagnóstico de cancro da mama e a exposição a estrogénio nesta fase poderá potenciar algum outro fator de risco existente para cancro da mama.
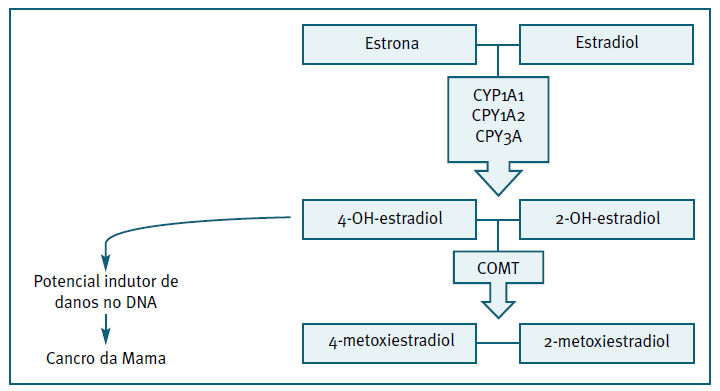
No estudo de Kawai et al., 200929, verifica-se uma diminuição do risco de cancro da mama que se acentua com o aumento da duração de uso de COC. Este estudo foi realizado no Japão e os resultados obtidos podem ser explicados, entre outros fatores, pelas características da população, uma vez que é conhecida a influência do perfil genético, como polimorfismos enzimáticos, associados ao metabolismo dos estrogénios. Assim, variações genéticas da catecol-O-metiltransferase (COMT), tais como a substituição do aminoácido valina por metionina no codão 158, conduzem à formação de um polimorfismo genético - COMT-L - na qual se verifica uma diminuição da atividade desta enzima, comparativamente com a wild type, comprometendo o metabolismo dos estrogénios. Estudos demonstram que a frequência da variante COMT-L é maior nas mulheres caucasianas comparativamente às mulheres asiáticas30,31. Assim, na população asiática verifica-se um predomínio da COMT wild type que, ao converter o 4- hidroxiestradiol em metoxiestrogénio, diminui a disponibilidade deste estrogénio catecol (4- hidroxiestradiol) com ação lesiva no DNA e efeito carcinogénico (Figura 2) 32,33.
Embora os restantes três estudos pareçam estar de acordo com a premissa de que a exposição continuada a estrogénio superior a 5 anos está associada a um maior risco de cancro da mama em determinados tipos de população, as diferenças encontradas entre estudos podem ser potencialmente explicadas por diversas razões. As doses relativas dos componentes estrogénico e progestativo de COC variam entre os estudos, para além de existir uma variação temporal dado que ocorreram alterações, ao longo do tempo, nas pílulas comercializadas e que se encontram disponíveis na prática clínica atual - o tipo de estrogénio administrado tem sido alterado e a dose do mesmo tem diminuído8,35. Por outro lado, tem que ser considerada a modalidade da utilização de COC não só em relação ao tempo de exposição global, mas também ao padrão da exposição, quer seja de forma contínua ou intercalada, havendo diferentes padrões de utilização que poderão condicionar o risco de cancro da mama36. A avaliação da duração de uso de COC nos estudos é variável, sendo considerado o tempo de uso ao longo de toda a vida da mulher, mas também o tempo de uso somente no período de seguimento de cada estudo. Durante o follow-up dos estudos, mulheres consideradas como pré-menopausa podem ter evoluído para pós-menopausa e, desta forma, enviesar os resultados.
Como limitações desta revisão sistemática é importante referir a heterogeneidade de cada estudo analisado, cada um num intervalo de tempo específico, com uma duração de seguimento dos participantes variável e com formulação e padrão de utilização de COC diferentes. Outra das limitações deriva do facto de os estudos incluídos não apresentarem informação relativamente à idade e ao momento, durante ou após a toma de COC, em que foi feito o diagnóstico de cancro da mama; além disso, o uso de COC durante o período pré-menopausa pode estar associado a um aumento do risco de cancro da mama que só terá expressão após a menopausa, dado a incidência de neoplasia da mama aumentar com o avançar da idade37. Outra possível fonte de viés presente nesta revisão é a falta de uma definição uniforme de “duração de uso” de COC. Este termo contém um período diferente de exposição a COC, quer este seja realizado durante 5 anos de forma ininterrupta ou por 5 anos de forma intermitente; outra variável relevante é o momento da vida da mulher em que a mesma realiza a toma de COC. Deste modo, impõe-se a questão relativamente a estes dados serem comparáveis entre si, nomeadamente no que respeita à forma como os resultados são expressos (Quadro I). O número reduzido de artigos que cumpriram os critérios de inclusão constitui uma importante limitação desta revisão, à qual se acrescenta a necessidade de definir um cut-off de 40 anos de idade e o facto de os estudos analisados não indicarem a dose de cada componente de COC.
No que respeita aos pontos fortes da revisão, a questão de investigação a ser respondida tem relevância na prática clínica na medida em que os COC são amplamente utilizados pelas mulheres em idade fértil38 e o conhecimento do seu papel na carcinogénese do cancro da mama é essencial não só no momento da sua prescrição, mas também para se poder investir em medidas eficazes de prevenção primária.
Relativamente a perspetivas futuras, o impacto cumulativo das numerosas mudanças nos COC no risco de cancro da mama não é claro e, por esse motivo, a avaliação contínua do risco-benefício das formulações de COC usadas atualmente continua a ser de grande importância. Não obstante de difícil execução, trabalhos futuros que englobem subgrupos de populações seriam de grande interesse à nossa questão de investigação, visto que os fenómenos epigenéticos associados ao metabolismo dos estrogénios podem modificar a formação de derivados carcinogénicos. Propõe-se a realização de um estudo de coorte na população portuguesa que avalie o impacto da duração, toma contínua ou intermitente, e diferentes formulações de COC no risco de desenvolver cancro da mama.
Conclusão
A evidência científica disponível até ao momento apresenta resultados contraditórios, encontrando-se várias hipóteses que podem, potencialmente, explicar os resultados obtidos. Deste modo, é necessária a realização de estudos adicionais nesta área, nomeadamente estudos de coorte prospetivos na população portuguesa, com especificação das doses hormonais utilizadas, do tempo e padrão de exposição a COC, os quais devem constituir uma prioridade clínica e de saúde pública.
Em conclusão, a associação entre COC e incidência de cancro da mama permanece ambígua, havendo aspetos contraditórios que merecem investigação adicional. No entanto, e uma vez que a análise dos estudos incluídos nesta revisão sistemática não permite concluir a existência de um maior risco de cancro da mama com uma duração de exposição a COC superior a 5 anos, a recomendação de utilização de COC num período quer superior quer inferior a 5 anos deverá ser acautelada, exigindo mais robustez científica em termos de segurança para a mulher.
Embora o cancro da mama seja menos frequente entre mulheres jovens, se a associação entre a duração de COC superior a 5 anos e o cancro da mama se confirmar em estudos futuros mais robustos, poderá contribuir para redefinir o perfil de risco-benefício de COC e, por conseguinte, normas de orientação clínica, permitindo um aconselhamento contracetivo consciente e informado.
Contribuição dos autores
Beatriz Leite Caetano - Pesquisa e seleção bibliográfica, redação do artigo. Maria Margarida Gil Conde - Supervisão e revisão crítica do artigo. Alda Pereira da Silva Oliveira - Supervisão e revisão crítica do artigo.
Conflitos de interesse
Os autores declaram a inexistência de conflitos de interesse. Os autores declaram a inexistência de apoio financeiro. Não foi concretizado um registo de protocolo desta revisão sistemática dado tratar-se de um estudo integrado no trabalho final do Mestrado Integrado em Medicina.