Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc v.7 n.3 Lisboa set. 2011
Rotura de aneurismas da aorta torácica: evidência para a endo-solução
Frederico Bastos Gonçalves,*,** Leonor Vasconcelos,* Ana Catarina Garcia,* Gonçalo Ramalho Alves,* Hugo Rodrigues,* Hugo Dias Valentim,* Maria Emília Ferreira,* João Albuquerque Castro,* Hence J. M. Verhagen,** Luís Mota Capitão.*
* Serviço de Angiologia e Cirurgia Vascular, Hospital de Santa Marta, Centro Hospitalar de Lisboa Central, Lisboa
** Departmento de Cirurgia Vascular, Erasmus University Medical Center, Roterdão, Holanda.
|RESUMO|
A rotura de aneurismas da aorta torácica descendente é uma situação rara mas frequentemente fatal, apesar do tratamento adequado. Esta revisão pretende resumir a evidência actual para o tratamento endovascular desta patologia.
Na última década, a introdução de técnicas endovasculares para tratar aneurismas torácicos em rotura levou a significativas mudanças no paradigma terapêutico, associadas a uma importante redução na mortalidade peri-operatória. Estudos comparativos revelam uma redução para metade na mortalidade aos 30 dias, assim como uma redução nas complicações precoces, nomeadamente pulmonares e renais.
Apesar do benefício precoce, o tratamento endovascular associa-se a uma maior taxa de complicações relacionadas com o procedimento, nomeadamente endoleaks. O seguimento imagiológico rigoroso permite a detecção precoce destas complicações permitindo a sua resolução electiva.
Assim, conclui-se que o tratamento preferencial da rotura da aorta torácica descendente é a implantação de uma endoprótese aórtica, desde que anatomicamente exequível.
Palavras-chave: rotura, endovascular, aneurisma torácico
Rupture of thoracic aortic aneurism: evidence for endovascular approac
|ABSTRACT|
Ruptured descending thoracic aneurysms are rare but frequently fatal conditions, despite adequate treatment. This revision aims to summarize the current evidence for endovascular repair of this pathology.
In the last decade, introduction of endovascular techniques to treat ruptured thoracic aneurysms resulted in significant changes in the treatment paradigm, associated with important reductions in peri-operative mortality. Comparative studies have shown a two-fold reduction in 30-day mortality, and also a reduction in early morbidity, especially pulmonary and renal complications.
Despite the early benefit, endovascular repair is associated with a higher device-related complication rate, particularly endoleaks. Rigorous follow-up allows for early detection and elective treatment of these complications.
In conclusion, the preferential treatment for ruptured descending thoracic aneurysms is the implantation of an endograft, provided anatomical suitability.
Key words: rupture, endovascular, thoracic aneurym
INTRODUÇÃO
A rotura de aneurisma da aorta torácica descendente é uma situação extraordinariamente grave e habitualmente fatal, com uma incidência aproximada de1-2:100.000. [1-3]Estima-se que mais de 80% dos doentes com esta patologia morra antes de chegar ao contexto hospitalar. Aqueles que sobrevivem até que lhes seja possível oferecer cuidados médicos são, por via de um processo de selecção natural, considerados de melhor prognóstico. Nesse contexto, a intervenção cirúrgica surge como única solução para o seu tratamento.[4]
Apesar da escassez em evidência científica, nomeadamente no que toca aos resultados a médio e longo prazo, e da elevada taxa de complicações e re-intervenções relatada nos estudos e registos até agora publicados, a generalização do tratamento endovascular da aorta torácica (TEVAR) para a reparação electiva dos aneurismas da aorta descendente aconteceu de forma rápida e provavelmente irreversível. O apelo da solução endovascular é particularmente grande nos casos urgentes, em que todas as desvantagens da cirurgia aberta são potenciadas e o risco de morte, acidente vascular cerebral (AVC) ou paraplegia permanente são muito elevados, rondando os 50-70% mesmo em centros de excelência.[5]
Nesta revisão, os autores procuram sintetizar a evidência actual suportando a utilização preferencial do tratamento endovascular de aneurismas da aorta torácica em rotura, explorando também as suas limitações.
EPIDEMIOLOGIA DAS OPÇÕES TERAPÊUTICAS PARA ANEURISMAS DA AORTA TORÁCICA EM ROTURA
Desde a sua introdução em 1994,[6] o tratamento endovascular de aneurismas da aorta torácica tornou-se rapidamente no método terapêutico de escolha na grande maioria dos hospitais do mundo ocidental. Isto prende-se essencialmente com as desvantagens a curto prazo da cirurgia aberta, tais como: necessidade de uma toracotomia alargada, clampagem aórtica com resultante lesão de isquémia-reperfusão e risco de paraplegia, frequente necessidade de bypass extra-corporal (e eventual hipotermia com paragem circulatória) ou risco de AVC intra-operatório.[4,7,8]
A aplicação desta técnica no contexto de rotura é especialmente sedutora, conforme demonstrado inicialmente por Semba, et al. em 1997.[9] Na maioria dos casos anatomicamente favoráveis o procedimento pode ser realizado apenas com anestesia local, acesso femoral percutâneo em uma das artérias femorais e com uma rapidez na exclusão da rotura e no tempo total do procedimento muito inferiores à cirurgia aberta. Além disso, a logística envolvida no tratamento convencional desta patologia é francamente reduzida tanto intraoperatoriamente como após a operação, em consumo de recursos de cuidados intensivos. Estes factores são teoricamente benéficos para doentes e instituições, o que pode explicar a utilização preferencial dos procedimentos endovasculares um pouco por todo o mundo.
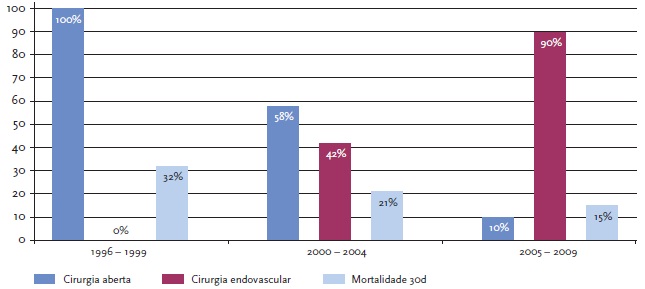
Numa série de 161 doentes tratados em hospitais com experiência em ambas as técnicas (aberta e endovascular), verificou-se uma inversão na tendência da estratégica cirúrgica: de 2000 a 2004 cerca de 40% dos procedimentos foram endovasculares, aumentando para 90% de 2005 a 2009.[8] Nos resultados deste estudo verificou-se também que esta alteração no paradigma do tratamento acompanhou-se de uma redução para metade na mortalidade aos 30 dias. Semelhantes resultados já haviam sido publicados anteriormente, numa menor série de 69 doentes.[7]
VANTAGEM A CURTO PRAZO E TAXA DE RE-INTERVENÇÃO
A raridade relativa da rotura de aneurismas da aorta descendente é limitativa para a realização de estudos prospectivos, já que seria necessário um longo período de recrutamento. A randomização destes doentes agudos é ainda mais complicada do ponto de vista logístico. Embora estes desenhos científicos produzam resultados teoricamente mais credíveis do que os estudos retrospectivos ou os registos, muitos argumentarão ainda que existe já evidência suficiente para apoiar o uso preferencial da cirurgia endovascular, e que um estudo randomizado nesta área seria, inclusive, inaceitável do ponto de vista ético.
Infelizmente, também a evidência retrospectiva é escassa. Para atingir significado estatístico, muitos estudos compilam doentes com várias expressões do síndrome aórtico agudo (dissecção, hematoma intramural, úlcera penetrante da aorta e rotura de aneurisma). Isto resulta numa impossível distinção entre patologias, limitando as conclusões.
Numa meta-analise recente foram analisadas todas as séries publicadas desde a introdução do TEVAR no tratamento desta patologia.[10] A mortalidade aos 30 dias cifrou-se nos 18,9% para o TEVAR e nos 33,3% para a cirurgia aberta. Isto significa um risco relativo de morte de 2,15 (intervalo de confiança 95%: 1,15-4,01) para a cirurgia aberta, quando comparada com o método endovascular. Os autores reconheceram, no entanto, a possível existência de viés, tanto na selecção de doentes como pela publicação preferencial dos bons resultados.
Patel, et al., publicaram um estudo retrospectivo com 69 doentes comparando os resultados da cirurgia aberta vs endovascular para aneurismas torácicos em rotura. Eles verificaram que, apesar do grupo endovascular ser mais idoso e com mais co-morbilidades, a mortalidade aos 30 dias foi reduzida para menos de metade, assim como a duração do internamento. Durante o seguimento os autores não encontraram diferenças significativas entre os dois grupos, concluindo que o tratamento endovascular deve ser adoptado preferencialmente.
Num estudo multicentrico trans-atlântico, envolvendo 7 hospitais terciários com experiência tanto em cirurgia aberta como endovascular da aorta torácica, foram comparados retrospectivamente 92 doentes tratados por TEVAR e 61 doentes tratados por cirurgia aberta.[8] O endpoint primário escolhido foi a combinação de morte, AVC ou paraplegia permanente aos 30 dias. Os resultados foram 21,9% vs. 36.2% (p=0,044) favorecendo o TEVAR. Também as complicações major pós-operatórias foram mais frequentes no grupo da cirurgia aberta, embora se tenha apenas encontrado significado estatístico em complicações pulmonares e renais (observação provavelmente resultante do tamanho da amostra). Durante o seguimento de dois anos, manteve-se uma vantagem clara do TEVAR no que respeita à mortalidade relacionada com o aneurisma, mas a taxa de re-intervenções aórticas foi claramente superior: 11/91 (12%) vs. 3/61 (5%). De referir, no entanto, que a maioria das re-intervenções foram realizadas por via endovascular e associadas a baixa morbilidade. A realçar que as 4 mortes que ocorreram após os 30 dias no grupo endovascular deveram-se a infecção da endoprótese (n=3) ou a fistulização para o esófago (n=1). A prática clínica sugere um risco acrescido de infecção e fistulização esofágica nestes casos agudos tratados por via endovascular, um assunto a merecer um estudo aprofundado.
Nesse mesmo trabalho foram identificados alguns factores que influenciam o prognóstico precoce dos doentes tratados por TEVAR. A idade avançada (>75 anos), a presença de hemotorax ou o choque hipovolémico foram considerados factores de risco independentes para morte aos 30 dias. Numa outra publicação, analisando os factores de risco para AVC peri-operatório, foram identificados a idade e o ano de TEVAR (sinal implícito da curva de aprendizagem e dos avanços tecnológicos das endopróteses).[11]
| FIGURA 1 | Tendências e mortalidade no tratamento de aneurismas da aorta torácica em rotura.
ENDOLEAK TIPO-I E COLAPSO DE ENDOPROTESE: DOIS CALCANHARES DE AQUILES
A percentagem de doentes com complicações após um TEVAR tecnicamente bem sucedido não é negligenciável. Até 20% apresentam alguma forma de preenchimento com contraste do saco aneurismatico durante os primeiros 30 dias, na maioria endoleaks tipo-I, traduzindo falência do tratamento e necessidade de re-intervenção. [8,12] O colapso das endopróteses, embora muito mais raro, é uma situação grave e potencialmente devastadora, levando à trombose aguda da aorta torácica | FIGURAS 2A E 2B |.[10,13,14]
| FIGURA 2 | Colapso de endoprótese torácica.
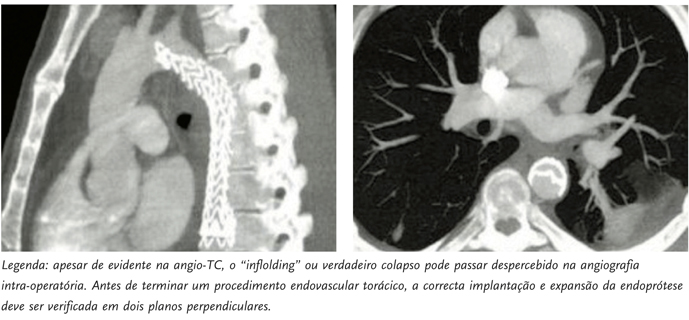
A ocorrência desta complicação é também mais frequente nos primeiros 30 dias e pode inicialmente ser assintomática (em cerca de metade dos casos), oferecendo uma janela de oportunidade terapêutica sem piores consequências.
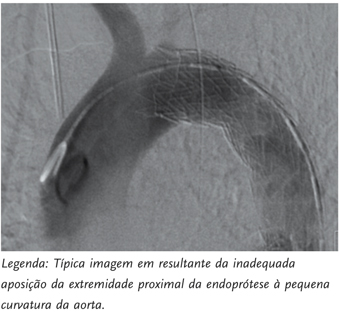
Uma explicação frequente para a ocorrência destas complicações prende-se com a conformabilidade das endopróteses actualmente utilizadas, em especial face a angulações presentes em crossas da aorta do tipo gótico.[15] Particularmente inquietante é a conformação em bico de pássaro (ou bird´s beak), que se associa a endoleaks e também ao colapso das endopróteses | FIGURA 3 |.[16] A necessidade de melhorar a conformabilidade dos implantes para a aorta torácica tem gerado modificações por parte das companhias que os comercializam. O desenvolvimento de mecanismos precisos de libertação com captura da ponta, a conformação proximal com ou sem stent descoberto, melhoramentos no desenho dos stents aumentando a sua força radial ou próteses conformáveis, sem memória, que ajustam o seu formato à curvatura da aorta, são exemplos disso.
| FIGURA 3 | Configuração em bico de pássaro (birds-beak).
Um segundo aspecto relaciona-se com as características hemodinâmicas da aorta torácica, que sujeitam o material a forças intensas com consequente risco de migração, desconexão ou fadiga (e falência) dos materiais.[17,18] Quando mais do que um componente é necessário para o tratamento, está hoje recomendada uma sobreposição entre componentes muito superior aquela proposta para os aneurismas da aorta abdominal, no mínimo 5cm e idealmente acima dos 10cm.
Também o planeamento dos procedimentos endovasculares em situações agudas é frequentemente problemático. Por um lado, a emergência do tratamento pode não permitir um planeamento ideal, com auxílio de reconstruções tridimensionais e centro-luminais. Além disso, existe uma variabilidade no diâmetro da aorta em sístole e em diástole.[19] Excepto em casos de angiografia por tomografia computorizada (angio-TC) cardio-sincronizada (habitualmente não realizada em urgência) existe à partida uma margem de erro no dimensionamento. Além disso, está demonstrada a redução do calibre da aorta em doentes hipovolémicos, como aqueles em choque hemorrágico.[20,21] Esta redução pode chegar aos 12,8% na porção proximal da aorta descendente. A relativa dificuldade em prever o verdadeiro diâmetro da aorta leva frequentemente ao subdimensionamento (e consequente endoleak tipo I) ou sobredimensionamento (e consequente endoleak tipo I ou colapso). Poderá existir neste contexto um papel para a ecografia endovascular (IVUS) intra-operatória, para confirmar o diâmetro aórtico após expansão do volume intra-vascular.
SEGUIMENTO APÓS TEVAR
As mais devastadoras complicações após o TEVAR por rotura de aneurisma torácico tendem a ocorrer durante os primeiros 30 dias. Assim, é aconselhada uma vigilância redobrada durante este período. Por outro lado, taxa de complicações tardias pode ultrapassar os 40% aos 48 meses, muitas das quais exigindo algum tipo de intervenção para garantir a durabilidade do procedimento. Isto reforça a necessidade de um follow-up imagiológico continuado.[18,22,23]
A angio-TC oferece uma excelente resolução e colimação, permitindo através de software simples uma avaliação morfológica muito precisa dos vasos e do material implantado. Em doentes mais jovens a ressonância magnética pode ser uma alternativa aceitável, especialmente quando o material dos stents implantados é nitinol. Estes doentes são, no entanto, raros. A utilização preferencial da ressonância magnética pode residir em doentes com crescimento do aneurisma apesar de não existir endoleak visualizável. A utilização dos agentes blood-pool permitem a detecção de contraste no saco aneurismático na grande maioria dos doentes, onde a angio-TC não tem capacidade diagnóstica.[24,25]
O MUNDO REAL
A evolução dos cuidados de saúde ultra-diferenciados permite actualmente resultados com a cirurgia convencional dos aneurismas da aorta torácica incomparavelmente melhores comparativamente com aqueles alcançados há duas ou três décadas atrás. Existem peritos que consideram inaceitáveis as taxas de complicações e re-intervenções após o TEVAR, apesar do seu benefício a curto prazo, e defendem a utilização muito mais criteriosa destas novas técnicas. Ainda assim, os bons resultados que são conseguidos em alguns centros de excelência não são reprodutíveis na esmagadora maioria dos hospitais, conforme demonstram os estudos baseados em registos hospitalares.[4,26]
Em situações electivas, uma escolha individualizada entre a cirurgia aberta e o TEVAR deve ser considerada, levando em conta a saúde geral do doente, as suas características anatómicas e também a sua vontade. Dada a raridade da patologia, o tratamento electivo deve provavelmente ser oferecido em centros com elevado volume e experiência, por via de atempada referenciação dos doentes. O mesmo não é aplicável às situações de rotura em que o TEVAR tem uma vantagem clínica clara, mesmo nos centros mais experientes em cirurgia aberta. Nesse aspecto, a solução endovascular é mais realista, sendo possível tratar uma grande maioria dos doentes com um stock reduzido de endopróteses, tendo uma curva de aprendizagem relativamente curta e uma logística muito mais favorável quando comparada com a cirurgia aberta emergente. A optimização da rede pré-hospitalar para levar o doente ao hospital com capacidade endovascular, assim como a formação dos cirurgiões vasculares para o tratamento endoluminal de aneurismas em rotura podem resultar numa melhoria global dos resultados neste grupo de doentes.
CONCLUSÃO
A rotura de aneurismas da aorta descendente é uma situação rara mas de enorme gravidade. Existe hoje evidência suficiente para apoiar a utilização preferencial do TEVAR em casos anatomicamente favoráveis, com base no benefício a curto prazo. A grande desvantagem desta alternativa continua a ser a elevada taxa de complicações, frequentemente exigindo re-intervenção, de forma a minimizar o risco de morte relacionada com o aneurisma. A compreensão dos mecanismos responsáveis pela falência do TEVAR, a par com as permanentes melhorias introduzidas pelos fabricantes, são elementos fundamentais num esforço permanente para melhorar os resultados no futuro. Um acompanhamento imagiológico rigoroso permite a identificação atempada de complicações, oferecendo a oportunidade para a sua correcção electiva.
BIBLIOGRAFIA
[1] Johansson G, Markstrom U, Swedenborg J. Ruptured thoracic aortic aneurysms: a study of incidence and mortality rates. J Vasc Surg 1995; 21(6):985-8. [ Links ]
[2] Bickerstaff LK, Pairolero PC, Hollier LH, et al. Thoracic aortic aneurysms: a population-based study. Surgery 1982; 92(6):1103-8. [ Links ]
[3] Elefteriades JA. Natural history of thoracic aortic aneurysms: indications for surgery, and surgical versus nonsurgical risks. Ann Thorac Surg 2002; 74(5):S1877-80; discussion S1892-8. [ Links ]
[4] Schermerhorn ML, Giles KA, Hamdan AD, et al. Population-based outcomes of open descending thoracic aortic aneurysm repair. J Vasc Surg 2008; 48(4):821-7. [ Links ]
[5] Barbato JE, Kim JY, Zenati M, et al. Contemporary results of open repair of ruptured descending thoracic and thoracoabdominal aortic aneurysms. J Vasc Surg 2007; 45(4):667-76. [ Links ]
[6] Dake MD, Miller DC, Semba CP, et al. Transluminal placement of endovascular stent-grafts for the treatment of descending thoracic aortic aneurysms. N Engl J Med 1994; 331(26):1729-34. [ Links ]
[7] Patel HJ, Williams DM, Upchurch GR, Jr., et al. A comparative analysis of open and endovascular repair for the ruptured descending thoracic aorta. J Vasc Surg 2009; 50(6):1265-70. [ Links ]
[8] Jonker FH, Verhagen HJ, Lin PH, et al. Open surgery versus endovascular repair of ruptured thoracic aortic aneurysms. J Vasc Surg 2011; 53(5):1210-6. [ Links ]
[9] Semba CP, Mitchell RS, Miller DC, et al. Thoracic aortic aneurysm repair with endovascular stent-grafts. Vasc Med 1997; 2(2):98-103. [ Links ]
[10] Jonker FH, Trimarchi S, Verhagen HJ, et al. Meta-analysis of open versus endovascular repair for ruptured descending thoracic aortic aneurysm. J Vasc Surg 2010; 51(4):1026-32, 1032 e1-1032 e2. [ Links ]
[11] Jonker FH, Verhagen HJ, Heijmen RH, et al. Endovascular repair of ruptured thoracic aortic aneurysms: predictors of procedure-related stroke. Ann Vasc Surg 2011; 25(1):3-8. [ Links ]
[12] Svensson LG, Kouchoukos NT, Miller DC, et al. Expert consensus document on the treatment of descending thoracic aortic disease using endovascular stent-grafts. Ann Thorac Surg 2008; 85(1 Suppl):S1-41. [ Links ]
[13] Goncalves FB, van Herwaarden JA, Verhagen HJ. Insights on the prevention of endograft collapse after thoracic endovascular aortic repair. J Endovasc Ther 2010; 17(6):735-7.
[14] Jonker FH, Schlosser FJ, Geirsson A, et al. Endograft collapse after thoracic endovascular aortic repair. J Endovasc Ther 2010; 17(6):725-34. [ Links ]
[15] Nakatamari H, Ueda T, Ishioka F, et al. Discriminant analysis of native thoracic aortic curvature: risk prediction for endoleak formation after thoracic endovascular aortic repair. J Vasc Interv Radiol 2011; 22(7):974-979 e2. [ Links ]
[16] Ueda T, Fleischmann D, Dake MD, et al. Incomplete endograft apposition to the aortic arch: bird-beak configuration increases risk of endoleak formation after thoracic endovascular aortic repair. Radiology 2010; 255(2):645-52. [ Links ]
[17] Liffman K, Sutalo ID, Lawrence-Brown MM, et al. Movement and dislocation of modular stent-grafts due to pulsatile flow and the pressure difference between the stent-graft and the aneurysm sac. J Endovasc Ther 2006; 13(1):51-61. [ Links ]
[18] Parmer SS, Carpenter JP, Stavropoulos SW, et al. Endoleaks after endovascular repair of thoracic aortic aneurysms. J Vasc Surg 2006; 44(3):447-52. [ Links ]
[19] van Prehn J, Vincken KL, Sprinkhuizen SM, et al. Aortic pulsatile distention in young healthy volunteers is asymmetric: analysis with ECG-gated MRI. Eur J Vasc Endovasc Surg 2009; 37(2):168-74. [ Links ]
[20] Jonker FH, Verhagen HJ, Mojibian H, et al. Aortic endograft sizing in trauma patients with hemodynamic instability. J Vasc Surg 2010; 52(1):39-44. [ Links ]
[21] Jonker FH, Mojibian H, Schlosser FJ, et al. The impact of hypovolaemic shock on the aortic diameter in a porcine model. Eur J Vasc Endovasc Surg 2010; 40(5):564-71. [ Links ]
[22] Adams JD, Tracci MC, Sabri S, et al. Real-world experience with type I endoleaks after endovascular repair of the thoracic aorta. Am Surg 2010; 76(6):599-605. [ Links ]
[23] Jonker FH, Giacovelli JK, Muhs BE, et al. Trends and outcomes of endovascular and open treatment for traumatic thoracic aortic injury. J Vasc Surg 2010; 51(3):565-71. [ Links ]
[24] Wieners G, Meyer F, Halloul Z, et al. Detection of type II endoleak after endovascular aortic repair: comparison between magnetic resonance angiography and blood-pool contrast agent and dual-phase computed tomography angiography. Cardiovasc Intervent Radiol 2010; 33(6):1135-42. [ Links ]
[25] Cornelissen SA, Verhagen HJ, Prokop M, et al. Visualizing type IV endoleak using magnetic resonance imaging with a blood pool contrast agent. J Vasc Surg 2008; 47(4):861-4. [ Links ]
[26] Orandi BJ, Dimick JB, Deeb GM, et al. A population-based analysis of endovascular versus open thoracic aortic aneurysm repair. J Vasc Surg 2009; 49(5):1112-6. [ Links ]














