Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Angiologia e Cirurgia Vascular
Print version ISSN 1646-706X
Angiol Cir Vasc vol.8 no.2 Lisboa June 2012
Angiogénese e Arteriogénese na Doença Arterial Periférica
Daniel Brandão*, **; Carla Costa**, ***, ****; Armando Mansilha*****
* Serviço de Angiologia e Cirurgia Vascular, Centro Hospitalar de Vila Nova de Gaia/Espinho.
** Departamento de Bioquímica da Faculdade de Medicina da Universidade do Porto.
*** Instituto de Biologia Celular e Molecular da Universidade do Porto (IBMC).
**** Association for the Advanced Study of Human Sexuality (iSEX), Lisboa, Portugal.
***** Serviço de Angiologia e Cirurgia Vascular, Hospital de São João (Porto) e Faculdade de Medicina da Universidade do Porto.
|RESUMO|
Em adaptação à obstrução da árvore arterial e consequente isquemia, os organismos induzem os processos arteriogénico e angiogénico no sentido de melhorar o aporte sanguíneo aos tecidos. Contudo, 25% dos doentes com doença arterial periférica (DAP) vão sofrer agravamento da sua condição isquémica aos cinco anos, sugerindo insuficiência dos processos adaptativos. Estes mecanismos são extremamente complexos e resultam da interacção adequadamente coordenada de múltiplas moléculas com células específicas. O estudo da variabilidade interindividual nas moléculas envolvidas nos mecanismos vasculares de adaptação à isquemia poderá provavelmente possibilitar a identificação de biomarcadores com capacidade prognóstica não só em relação à evolução da doença, mas também à resposta às terapêuticas instituídas.
Palavras-chave: doença arterial periférica, arteriogénese, angiogénese
Angiogenesis and Arteriogenesis in Peripheral Arterial Disease
|ABSTRACT|
In adaptation to arterial obstruction and consequent ischemia, organisms induce the arteriogenic and angiogenic mechanisms in order to improve blood supply to tissues. However, 25% of the patients with peripheral arterial disease will have a deterioration of their condition, suggesting failure of the adaptative processes. These mechanisms are extremely complex, resulting from the interaction of multiple molecules suitably coordinated with specific cells. The study of interindividual variability in the molecules involved in the vascular adaptive mechanisms to ischemia could probably enable the identification of prognostic biomarkers not only for the disease evolution, but also for the response to therapeutic approaches.
Key words: Peripheral arterial disease, arteriogenesis, angiogenesis, biomarkers
I. DOENÇA ARTERIAL PERIFÉRICA
À semelhança das doenças coronária e cerebrovascular, a doença arterial periférica (DAP) é consequência da aterosclerose. Deste modo, a obstrução da árvore arterial dos membros inferiores resulta numa diminuição do aporte sanguíneo necessário aos tecidos durante o exercício ou mesmo em repouso. A gravidade dos sintomas encontra-se dependente da extensão do processo obstrutivo, mas também da circulação colateral existente.
Juntamente com as restantes patologias consequentes da aterosclerose, a DAP tem demonstrado um padrão epidémico alarmante nas populações ocidentais. É de facto uma condição grandemente prevalente (3 a 10% na população em geral e 15 a 20% nos indivíduos com idade superior a 70 anos)[1]. Partilha com as restantes doenças ateroscleróticas os mesmos factores de risco vascular, assumindo-se a diabetes mellitus, o tabaco e a idade como os factores com maior relevância[1].
A evolução natural da DAP encontra-se actualmente claramente definida. Deste modo, após cinco anos de seguimento, 25% dos doentes com claudicação intermitente vão ter agravamento da sua condição isquémica com 5 a 10% a evoluírem para isquemia crítica (1). Neste contexto, a maioria dos casos com evolução desfavorável ocorre no primeiro ano após o diagnóstico[2]. Por outro lado, a mortalidade aos cinco anos é nestes doentes de 10 a 15% (75% casos de origem cardiovascular), sendo que 20% adicionais irão desenvolver um evento cardiovascular não-fatal[2]. Neste âmbito, a DAP tem sido consistentemente associada a um aumento significativo do risco de eventos e de morte cardiovasculares, estando este aumento estimado em seis vezes aos dez anos[3,4]. O prognóstico dos doentes em isquemia crítica é francamente mais sombrio: um ano após o diagnóstico e apesar das medidas terapêuticas instituídas, 30% terá sido submetido a uma amputação major, 25% terá falecido e apenas 25% se encontrará sem isquemia crítica.
Tem havido uma evidência crescente de que o exercício realizado sob supervisão poderá permitir a melhoria sintomática destes doentes, quando comparado com o aconselhamento usual de caminhar com regularidade efectuado em regime de consulta[5]. Este benefício parece decorrer de diversas adaptações à condição isquémica estimuladas pelo exercício, nomeadamente ao nível da microcirculação e da macrocirculação[6]. No entanto, existe uma importante heterogeneidade entre os diversos estudos efectuados no que respeita ao tipo de exercício a realizar, mas também à duração e frequência do mesmo[7,8]. Neste contexto, Nicolai e colaboradores recentemente apontaram para uma possível maior eficácia de um esquema de exercício superior a 30 minutos por sessão, duas vezes por semana[9].
II. NEOVASCULARIZAÇÃO
O organismo possui diversos mecanismos de adaptação que permitem melhorar o aporte sanguíneo aos tecidos em situações de isquemia. Os mecanismos accionados nessas circunstâncias são classicamente divididos em três: angiogénese, vasculogénese e arteriogénese | figuras 1 e 2 |[10]. Na realidade, estes processos possuem uma significativa interacção, partilhando numerosos acontecimentos celulares e moleculares.
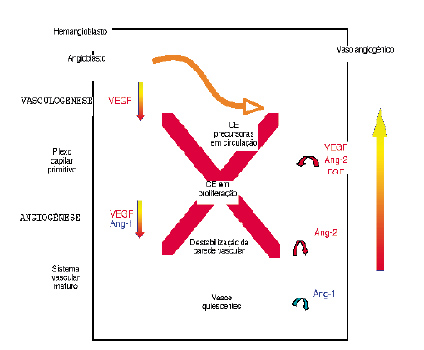
| FIGURA 1 |Vasculogénese e angiogénese. CE, Células Endoteliais; Ang-1, Angiopoietina-1; Ang-2, Angiopoietina-2 (adaptado de Brandão D et al)[10]
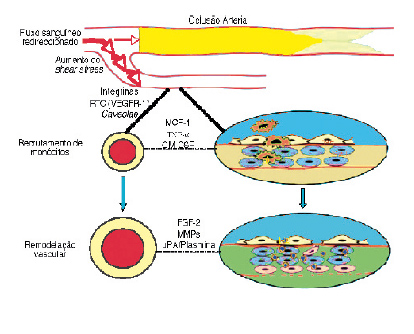
| FIGURA 2 | Arteriogénese. RTC, Receptor Tirosina-Cinase (adaptado de Brandão D et al)[10]
A. Vasculogénese
A vasculogénese consiste na formação de novos vasos a partir de células precursoras das células endoteliais (EPCs) derivadas da medula óssea ou angioblastos. Embora inicialmente se pensasse que a vasculogénese ocorreria apenas durante o período embrionário, sabe-se hoje que as EPCs colonizam os locais angiogénicos, integrando-se funcionalmente nos vasos em formação[11].
B. Angiogénese
A angiogénese consiste na formação de novos vasos a partir de vasos pré-existentes. Após um estímulo inicial, as células endoteliais separam-se das células vizinhas bem como das células de suporte perivascular, começando a proliferar e a migrar. Organizam-se posteriormente em cordões que subsequentemente adquirem lúmen, dando assim origem a novos vasos.
1. VEGF
No processo angiogénico intervêm inúmeros factores, de entre os quais importa salientar o VEGF e respectivos receptores. A célula endotelial constitui o alvo primário da acção do VEGF. Está claramente demonstrado, in vitro e in vivo, que o VEGF induz a proliferação e migração das células endoteliais e inibe a apoptose das mesmas[12].
A acção do VEGF decorre da sua ligação a dois receptores tirosina-cinase: o VEGFR-1, também designado por Flt-1 (fms-like tyrosine kinase receptor 1) e o VEGFR-2, igualmente descrito como Flk-1 (fetal liver kinase 1) no ratinho, ou KDR (Kinase insert Domain Receptor) no ser humano[13]. O VEGFR-2 constitui o mediador mais importante dos efeitos mitogénicos e angiogénicos do VEGF[12]. Em oposição ao VEGFR-2, o papel do VEGFR-1 na angiogénese não se encontra tão claramente definido. De facto, foram já descritas acções contraditórias, o que poderá resultar de uma sinalização intracelular diversa consoante a fase de desenvolvimento ou o tipo celular em questão. Deste modo, embora o VEGFR-1 assuma um papel positivo importante na vasculogénese e angiogénese esse receptor tirosina-cinase surge como um potencial regulador negativo da acção do VEGF a nível das células endoteliais no adulto[14].
2. Exercício e angiogénese
O provimento de nutrientes às fibras musculares está dependente da difusão a partir dos capilares circundantes. Está demonstrado que a um maior número de capilares existentes à periferia das fibras musculares se associa uma maior capacidade de difusão[15]. Embora exista alguma discordância entre os estudos publicados em torno dos processos de adaptação nos músculos dos indivíduos com claudicação intermitente, poderá haver um aumento da densidade capilar a nível muscular nessa circunstância[16-19]. Por outro lado, constatou-se que o exercício leva a um incremento da densidade capilar e da capacidade de difusão a nível muscular, em consequência da activação do processo angiogénico, mesmo em circunstâncias em que se verifica obstrução do fluxo sanguíneo a montante[17, 20, 21]. Este mecanismo adaptativo poderá em parte explicar o benefício verificado nos indivíduos claudicantes submetidos a exercício sob supervisão.
C. Arteriogénese
Em situações de estenose ou oclusão de uma artéria, os vasos colaterais pré-existentes aumentam de diâmetro de modo a tornarem-se efectivos no fornecimento de sangue a jusante. Este fenómeno é conhecido como arteriogénese. Quando uma estenose arterial se torna hemodinamicamente significativa, a corrente sanguínea é dirigida para os leitos arteriolares vizinhos pré-existentes. Em consequência ocorre um aumento significativo do shear stress a nível das paredes desses vasos levando à activação das células endoteliais. Essa activação é mediada à superfície celular por numerosas vias, salientando-se diversos receptores tirosina-cinase (nomeadamente o VEGFR-1), moléculas de adesão celular (PECAM-1, integrinas), canais iónicos, proteínas G, caveolae, dupla camada lipídica da membrana celular ou ainda proteoglicanos[22]. As células endoteliais activadas vão promover a transcrição de múltiplos genes. Em resultado decorre a síntese de numerosas citocinas (embora o MCP-1 assuma maior relevo, são igualmente importantes moléculas como o GM-CSF – granulocyte-macrophage colony-stimulating factor, G-CSF – granulocyte-macrophage colony-stimulating factor – ou ainda o TNF-α), moléculas de adesão intercellular (ICAM-1 – intercellular adhesion molecule-1, ICAM-2 e VCAM-1 – vascular adhesion molecule-1) e ainda da eNOS [23-25]. Atraídos pelo aumento circunscrito da concentração de MCP-1 e auxiliados pelas moléculas de adesão celular, os monócitos circulantes vão localmente aderir ao endotélio e invadir a parede vascular, transformando-se em macrófagos [23]. Os macrófagos, cuja função é favorecida pelo GM-CSF circundante, vão sintetizar, entre outros, proteases como as MMPs (matrix metalloproteinases) e o uPA (urinary plasminogen activator) e numerosos factores de crescimento vascular, com relevo para o FGF-2 (fibroblastic growth factor-2) [26]. Por um lado, a destruturação promovida pelas proteases da matriz, das lâminas elásticas interna e externa e da adventícia, permite originar espaço para a multiplicação e migração das células que compõem a parede arterial; por outro lado, os fragmentos resultantes da degradação dos componentes da matriz, como por exemplo da elastina, vão, em conjunto com o FGF-2, induzir a activação das células musculares lisas (CML)[23,26,27]. As CML activadas vão proliferar e sofrer uma desdiferenciação de um fenótipo contráctil para um fenótipo de síntese[28]. Entretanto, as células endoteliais inicialmente activadas pelas alterações hemodinâmicas e posteriormente estimuladas pelos factores de crescimento libertados pelos macrófagos em resultado da disrupção da barreira constituída pela lâmina elástica interna, vão igualmente proliferar[29]. Posteriormente assiste-se à maturação da parede arterial com a disposição ordenada das CML em camadas circulares, com o estabelecimento de ligações intercelulares e ainda com a síntese de colagénio e de elastina, possibilitando assim a estrutura necessária para um vaso de calibre superior[28].
1. VEGF e receptores na arteriogénese
O papel preponderante do VEGF verificado na angiogénese não é tão evidente na arteriogénese. De facto, a expressão do VEGF é no essencial mediada pelo factor de transcrição HIF-1α (hypoxia-inducible factor-1α), que apenas é expresso em situações de hipóxia, condição que não se verifica nos locais onde decorre o processo arteriogénico. Contudo, a expressão do VEGF e do VEGFR-2 pelas células endoteliais encontra-se aumentada ao longo do processo arteriogénico[30]. Por outro lado, a arteriogénese induzida pelo exercício é inibida por um antagonista do VEGF[31]. Foi ainda demonstrado em modelo animal que CML transduzidas com VEGF associadas a células endoteliais transduzidas com Angiopoietina-1 (factor de grande relevância na maturação e estabilização dos vasos recém-formados por promover a interacção entre o endotélio e as células de suporte perivascular) reproduzem o fenómeno arteriogénico[32].
O mecanismo sugerido através do qual o VEGF parece ser capaz de induzir a arteriogénese poderá ser o seguinte: o aumento de expressão de eNOS despoletada pelo incremento do shear stress promove a libertação de VEGF; na sequência, o VEGF induz as CML a sintetizarem MCP-1, levando à atracção dos monócitos, dando assim início ao processo arteriogénico[28]. Adicionalmente, foi demonstrado que o VEGF é capaz de promover directamente a atracção e migração dos monócitos, sendo esta acção de atracção do VEGF mediada pelo VEGFR-1[33-35]. Por outro lado, verificou-se que o PlGF (placental growth factor), membro da família VEGF e ligando do VEGFR-1, promove a arteriogénese em modelos de isquemia miocárdica e dos membros inferiores[36].
O VEGFR-1 poderá ainda ter um papel adicional em todo o processo arteriogénico. Assim, o VEGFR-1 pode, por splicing alternativo, ser expresso sob uma forma solúvel que, ao ligar-se ao VEGF, impossibilita este de exercer a sua acção junto das células-alvo, podendo limitar desta forma os processos angiogénico e arteriogénico[37].
2. Exercício e arteriogénese
Mesmo na ausência de suplementação com factores pró-angiogénicos e pró-arteriogénicos, a participação num programa de exercício regular associa-se a um aumento do fluxo sanguíneo dependente da colateralização [38]. Nesse âmbito, foi recentemente demonstrado em modelo animal que, após a laqueação da artéria femoral, o fluxo sanguíneo pelas colaterais para os músculos da perna é inicialmente de 2 a 3 vezes o fluxo necessário para manter a massa muscular viável em repouso, progredindo com o tempo para 5 a 6 vezes nos ratos sedentários e para 10 vezes nos ratos sob exercício[39]. Esta adaptação progressiva, mais expressiva nos animais sob treino, resulta em grande medida do aumento do diâmetro das colaterais pré-existentes, isto é, do estímulo arteriogénico resultante do incremento do shear stress [6]. Dos agentes intervenientes nesse processo de adaptação, a eNOS tem sido apontada como uma molécula crítica. O aumento da expressão da eNOS é típico dos vasos responsáveis pelo fornecimento de sangue aos grupos musculares que suportam um determinado exercício, em resultado do seu importante papel no controlo vascular local[6]. Contudo, na circunstância do remodeling vascular associado à arteriogénese o seu papel é ainda de maior relevância na medida em que a expressão de eNOS é crucial para o aumento do diâmetro arterial[40,41]. De facto, a inibição da produção de NO suprime o aumento de fluxo ao nível das colaterais induzido peloexercício[42].
3. Arteriogénese e doença coronária
Nesse âmbito, importa relevar que foram recentemente publicados dois estudos que relacionam uma menor capacidade de colateralização a nível coronário com um maior risco de eventos cardíacos agudos[43,44].
II. CONCLUSÕES
Embora, como mencionado anteriormente, a evolução dos doentes com DAP se encontre claramente definida, os factores preditivos do agravamento clínico dos doentes são ainda escassos e pouco precisos (1, 45). Neste contexto, o estudo da variabilidade interindividual das diferentes moléculas envolvidas nos mecanismos vasculares de adaptação à isquemia poderá possibilitar a identificação de biomarcadores com capacidade prognóstica, quer em relação à evolução da doença, quer à resposta às terapêuticas instituídas, nomeadamente ao exercício sob supervisão.
BIBLIOGRAFIA
[1] NORGREN L, HIATT WR, DORMANDY JA, NEHLER MR, HARRIS KA, FOWKES FG, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg. 2007;33 Suppl 1:S1-75. Epub 2006/12/05. [ Links ]
[2] NASCHITZ JE, AMBROSIO DA, CHANG JB. Intermittent claudication: predictors and outcome. Angiology. 1988;39(1 Pt 1):16-22. Epub 1988/01/01. [ Links ]
[3] FOWKES FG, MURRAY GD, BUTCHER I, HEALD CL, LEE RJ, CHAMBLESS LE, et al. Ankle brachial index combined with Framingham Risk Score to predict cardiovascular events and mortality: a meta-analysis. JAMA. 2008;300(2):197-208. Epub 2008/07/10. [ Links ]
[4] CRIQUI MH, LANGER RD, FRONEK A, FEIGELSON HS, KLAUBER MR, MCCANN TJ, et al. Mortality over a period of 10 years in patients with peripheral arterial disease. N Engl J Med. 1992;326(6):381-6. Epub 1992/02/06. [ Links ]
[5] WATSON L, ELLIS B, LENG GC. Exercise for intermittent claudication. Cochrane Database Syst Rev. 2008(4):CD000990. Epub 2008/10/10. [ Links ]
[6] YANG HT, PRIOR BM, LLOYD PG, TAYLOR JC, LI Z, LAUGHLIN MH, et al. Training-induced vascular adaptations to ischemic muscle. J Physiol Pharmacol. 2008;59 Suppl 7:57-70. Epub 2009/03/11. [ Links ]
[7] CHEETHAM DR, BURGESS L, ELLIS M, WILLIAMS A, GREENHALGH RM, DAVIES AH. Does supervised exercise offer adjuvant benefit over exercise advice alone for the treatment of intermittent claudication? A randomised trial. Eur J Vasc Endovasc Surg. 2004;27(1):17-23. Epub 2003/12/04. [ Links ]
[8] PATTERSON RB, PINTO B, MARCUS B, COLUCCI A, BRAUN T, ROBERTS M. Value of a supervised exercise program for the therapy of arterial claudication. J Vasc Surg. 1997;25(2):312-8; discussion 8-9. Epub 1997/02/01. [ Links ]
[9] NICOLAI SP, HENDRIKS EJ, PRINS MH, TEIJINK JA. Optimizing supervised exercise therapy for patients with intermittent claudication. J Vasc Surg. 2010;52(5):1226-33. Epub 2010/08/10. [ Links ]
[10] BRANDÃO D PD, COSTA C, CANEDO A, GUEDES VAZ A. Artigo de revisão: Angiogénese Terapêutica: o início de uma nova era? Angiologia e Cirurgia Vascular. 2008;4:127-39. [ Links ]
[11] CARMELIET P. Mechanisms of Angiogenesis and Arteriogenesis. Nat Med. 2000;6(4):389-95. Epub 2000/03/31. [ Links ]
[12] FERRARA N. Vascular endothelial growth factor: basic science and clinical progress. Endocr Rev. 2004;25(4):581-611. Epub 2004/08/06. [ Links ]
[13] TERMAN BI, CARRION ME, KOVACS E, RASMUSSEN BA, EDDY RL, SHOWS TB. Identification of a new endothelial cell growth factor receptor tyrosine kinase. Oncogene. 1991;6(9):1677-83. Epub 1991/09/01. [ Links ]
[14] FONG GH, ROSSANT J, GERTSENSTEIN M, BREITMAN ML. Role of the Flt-1 receptor tyrosine kinase in regulating the assembly of vascular endothelium. Nature. 1995;376(6535):66-70. Epub 1995/07/06. [ Links ]
[15] RICHARDSON RS, GRASSI B, GAVIN TP, HASELER LJ, TAGORE K, ROCA J, et al. Evidence of O2 supply-dependent VO2 max in the exercise-trained human quadriceps. J Appl Physiol. 1999;86(3):1048-53. Epub 1999/03/06. [ Links ]
[16] HAMMARSTEN J, BYLUND-FELLENIUS AC, HOLM J, SCHERSTEN T, KROTKIEWSKI M. Capillary supply and muscle fibre types in patients with intermittent claudication: relationships between morphology and metabolism. Eur J Clin Invest. 1980;10(4):301-5. Epub 1980/08/01. [ Links ]
[17] MCGUIGAN MR, BRONKS R, NEWTON RU, SHARMAN MJ, GRAHAM JC, CODY DV, et al. Muscle fiber characteristics in patients with peripheral arterial disease. Med Sci Sports Exerc. 2001;33(12):2016-21. Epub 2001/12/12. [ Links ]
[18] ASKEW CD, GREEN S, WALKER PJ, KERR GK, GREEN AA, WILLIAMS AD, et al. Skeletal muscle phenotype is associated with exercise tolerance in patients with peripheral arterial disease. J Vasc Surg. 2005;41(5):802-7. Epub 2005/05/12. [ Links ]
[19] DUSCHA BD, ROBBINS JL, JONES WS, KRAUS WE, LYE RJ, SANDERS JM, et al. Angiogenesis in skeletal muscle precede improvements in peak oxygen uptake in peripheral artery disease patients. Arterioscler Thromb Vasc Biol. 2011;31(11):2742-8. Epub 2011/08/27. [ Links ]
[20] WOOD RE, SANDERSON BE, ASKEW CD, WALKER PJ, GREEN S, STEWART IB. Effect of training on the response of plasma vascular endothelial growth factor to exercise in patients with peripheral arterial disease. Clin Sci (Lond). 2006;111(6):401-9. Epub 2006/08/25. [ Links ]
[21] ESBJORNSSON M, JANSSON E, SUNDBERG CJ, SYLVEN C, EIKEN O, NYGREN A, et al. Muscle fibre types and enzyme activities after training with local leg ischaemia in man. Acta Physiol Scand. 1993;148(3):233-41. Epub 1993/07/01. [ Links ]
[22] CHATZIZISIS YS, COSKUN AU, JONAS M, EDELMAN ER, FELDMAN CL, STONE PH. Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling: molecular, cellular, and vascular behavior. J Am Coll Cardiol. 2007;49(25):2379-93. Epub 2007/06/30. [ Links ]
[23] WAHLBERG E. Angiogenesis and arteriogenesis in limb ischemia. J Vasc Surg. 2003;38(1):198-203. Epub 2003/07/05. [ Links ]
[24] SCHIRMER SH, VAN NOOIJEN FC, PIEK JJ, VAN ROYEN N. Stimulation of collateral artery growth: travelling further down the road to clinical application. Heart. 2009;95(3):191-7. Epub 2009/01/16. [ Links ]
[25] SCHOLZ D, ITO W, FLEMING I, DEINDL E, SAUER A, WIESNET M, et al. Ultrastructure and molecular histology of rabbit hind-limb collateral artery growth (arteriogenesis). Virchows Arch. 2000;436(3):257-70. Epub 2000/04/27. [ Links ]
[26] HEIL M, EITENMULLER I, SCHMITZ-RIXEN T, SCHAPER W. Arteriogenesis versus angiogenesis: similarities and differences. J Cell Mol Med. 2006;10(1):45-55. Epub 2006/03/28. [ Links ]
[27] ARRAS M, ITO WD, SCHOLZ D, WINKLER B, SCHAPER J, SCHAPER W. Monocyte activation in angiogenesis and collateral growth in the rabbit hindlimb. J Clin Invest. 1998;101(1):40-50. Epub 1998/02/14. [ Links ]
[28] SCHAPER W. Collateral circulation: past and present. Basic Res Cardiol. 2009;104(1):5-21. Epub 2008/12/23. [ Links ]
[29] HEIL M, SCHAPER W. Influence of mechanical, cellular, and molecular factors on collateral artery growth (arteriogenesis). Circ Res. 2004;95(5):449-58. Epub 2004/09/04. [ Links ]
[30] WU S, WU X, ZHU W, CAI W-J, SCHAPER J, SCHAPER W. Immunohistochemical study of the growth factors, aFGF, bFGF, PDGF-AB, VEGF-A and its receptor (Flk-1) during arteriogenesis. Molecular and Cellular Biochemistry. 2010;343(1):223-9.
[31] LLOYD PG, PRIOR BM, LI H, YANG HT, TERJUNG RL. VEGF receptor antagonism blocks arteriogenesis, but only partially inhibits angiogenesis, in skeletal muscle of exercise-trained rats. Am J Physiol Heart Circ Physiol. 2005;288(2):H759-68. Epub 2004/10/09. [ Links ]
[32] GLUZMAN Z, KOREN B, PREIS M, COHEN T, TSABA A, COSSET FL, et al. Endothelial cells are activated by angiopoeitin-1 gene transfer and produce coordinated sprouting in vitro and arteriogenesis in vivo. Biochem Biophys Res Commun. 2007;359(2):263-8. Epub 2007/06/05. [ Links ]
[33] HEIL M, CLAUSS M, SUZUKI K, BUSCHMANN IR, WILLUWEIT A, FISCHER S, et al. Vascular endothelial growth factor (VEGF) stimulates monocyte migration through endothelial monolayers via increased integrin expression. European Journal of Cell Biology. 2000;79(11):850-7. [ Links ]
[34] TCHAIKOVSKI V, FELLBRICH G, WALTENBERGER J. The Molecular Basis of VEGFR-1 Signal Transduction Pathways in Primary Human Monocytes. Arterioscler Thromb Vasc Biol. 2008;28(2):322-8. [ Links ]
[35] BARLEON B, SOZZANI S, ZHOU D, WEICH HA, MANTOVANI A, MARME D. Migration of human monocytes in response to vascular endothelial growth factor (VEGF) is mediated via the VEGF receptor flt-1. Blood. 1996;87(8):3336-43. Epub 1996/04/15. [ Links ]
[36] PIPP F, HEIL M, ISSBRUCKER K, ZIEGELHOEFFER T, MARTIN S, VAN DEN HEUVEL J, et al. VEGFR-1-selective VEGF homologue PlGF is arteriogenic: evidence for a monocyte-mediated mechanism. Circ Res. 2003;92(4):378-85. Epub 2003/02/26. [ Links ]
[37] KENDALL RL, THOMAS KA. Inhibition of vascular endothelial cell growth factor activity by an endogenously encoded soluble receptor. Proc Natl Acad Sci U S A. 1993;90(22):10705-9. Epub 1993/11/15. [ Links ]
[38] PRIOR BM, LLOYD PG, REN J, LI H, YANG HT, LAUGHLIN MH, et al. Time course of changes in collateral blood flow and isolated vessel size and gene expression after femoral artery occlusion in rats. Am J Physiol Heart Circ Physiol. 2004;287(6):H2434-47. Epub 2004/07/24. [ Links ]
[39] TAYLOR JC, YANG HT, LAUGHLIN MH, TERJUNG RL. Alpha-adrenergic and neuropeptide Y Y1 receptor control of collateral circuit conductance: influence of exercise training. J Physiol. 2008;586(Pt 24):5983-98. Epub 2008/11/05. [ Links ]
[40] TRONC F, WASSEF M, ESPOSITO B, HENRION D, GLAGOV S, TEDGUI A. Role of NO in flow-induced remodeling of the rabbit common carotid artery. Arterioscler Thromb Vasc Biol. 1996;16(10):1256-62. Epub 1996/10/01. [ Links ]
[41] YANG HT, YAN Z, ABRAHAM JA, TERJUNG RL. VEGF(121)- and bFGF-induced increase in collateral blood flow requires normal nitric oxide production. Am J Physiol Heart Circ Physiol. 2001;280(3):H1097-104. Epub 2001/02/17. [ Links ]
[42] LLOYD PG, YANG HT, TERJUNG RL. Arteriogenesis and angiogenesis in rat ischemic hindlimb: role of nitric oxide. Am J Physiol Heart Circ Physiol. 2001;281(6):H2528-38. Epub 2001/11/16. [ Links ]
[43] CHITTENDEN TW, SHERMAN JA, XIONG F, HALL AE, LANAHAN AA, TAYLOR JM, et al. Transcriptional profiling in coronary artery disease: indications for novel markers of coronary collateralization. Circulation. 2006;114(17):1811-20. Epub 2006/10/18. [ Links ]
[44] MEIER P, ANTONOV J, ZBINDEN R, KUHN A, ZBINDEN S, GLOEKLER S, et al. Non-invasive gene-expression-based detection of well-developed collateral function in individuals with and without coronary artery disease. Heart. 2009;95(11):900-8. Epub 2008/08/30. [ Links ]
[45] KNOWLES JW, ASSIMES TL, LI J, QUERTERMOUS T, COOKE JP. Genetic susceptibility to peripheral arterial disease: a dark corner in vascular biology. Arterioscler Thromb Vasc Biol. 2007;27(10):2068-78. Epub 2007/07/28. [ Links ]
Autor Correspondente:
Daniel Brandão
Serviço de Angiologia e Cirurgia Vascular
Centro Hospitalar de Vila Nova de Gaia/Espinho
Rua Conceição Fernandes
4434-502 Vila Nova de Gaia
+351 91 322 12 20