Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc vol.14 no.1 Lisboa mar. 2018
ARTIGO DE REVISÃO
Protocolo para uso da drenagem de líquido cefalorraquidiano em cirurgia de aneurisma toraco-abdominal
Protocol for the use of cerebrospinal fluid drainage in thoracoabdominal aneurysm surgery
Miguel Ferreira1
1Serviço de Anestesiologia, Hospital de Santa Maria, Centro Hospitalar Lisboa Norte
Autor para correspondência
RESUMO
A paraplegia é uma complicação devastadora e reconhecida da cirurgia de reparação do aneurisma da aorta toracoabdominal, tendo os sistemas de drenagem de líquido cefalorraquidiano emergido como uma medida importante para melhorar o outcome neurológico. O protocolo elaborado na nossa instituição é constituído por documentos que orientam a colocação do sistema de drenagem, a sua manutenção, o manuseio e os objetivos hemodinâmicos para o intra-operatório e pós-operatório, as intervenções a serem tomadas no caso de ocorrência de algum défice neurológico e as normas para a retirada do catéter de drenagem em segurança. É imperativo a familiarização dos diferentes membros da equipa médica e de enfermagem com as normas de utilização deste sistema. O objetivo principal é a otimização da abordagem destes doentes de modo a melhorar o outcome neurológico e minimizar o risco de complicações.
Palavras-chave: Aneurisma toraco-abdominal, drenagem líquido cefalorraquidiano, proteção medular.
ABSTRACT
Paraplegia is a devastating and well recognized complication of thoracoabdominal aortic aneurysm repair surgery, with cerebrospinal fluid drainage systems emerging as an important measure to improve neurological outcome. The protocol elaborated by the authors consists of several documents that guide the placement of the drainage system, its maintenance, the handling and the hemodynamic goals for the intraoperative and postoperative period, the interventions to be taken in case of neurological deficit and the withdrawal of the drainage catheter with safety. It is imperative to familiarize the different members of the medical and nursing teams with the usage rules of this system. The main objective is to optimize the approach of these patients in order to improve their neurological outcome and to minimize the risk of complications.
Keywords: Thoracoabdominal aortic aneurysm, cerebrospinal fluid drainage, spinal cord protection
A paraplegia é uma complicação devastadora e reconhecida da cirurgia de reparação do aneurisma da aorta toraco-abdominal (AATA). A etiologia da isquemia da medula espinhal é provavelmente multifatorial e para ela contribuirá a isquemia, e consequente lesão de reperfusão, originada por diminuição da pressão de perfusão aórtica distal, a qual terá como principais causas:
1) a hipotensão perioperatória;
2) a oclusão/trombose de múltiplos vasos intercostais por endopróteses vasculares;
3) a oclusão da artéria subclávia esquerda e de circulação colateral por ramos lombares e pélvicos.1,2,3
Os fatores de risco para paraplegia após cirurgia de AATA incluem: apresentação emergente (dissecção ou rutura), tempo de clampagem aórtica prolongada, aneurismas extensos (Crawford tipos I e II), hipotensão pósoperatória, idade avançada, reparação de aneurisma da aorta abdominal prévia, doença aterosclerótica grave, diabetes mellitus e oclusão de vasos medulares colaterais.24
O tratamento endovascular de aneurisma da aorta toraco-abdominal (TEAATA) tem emergido como uma alternativa à abordagem cirúrgica tradicional (aberta). Apesar das taxas de morbilidade e mortalidade serem mais baixas com o TEAATA, o risco da ocorrência de isquemia medular permanece uma complicação importante, sendo que a literatura reporta incidência de até 8%, ao invés dos cerca de 20% apontados nos estudos mais recentes para reparação aberta de AATA.1
Os sistemas de drenagem de líquido cefalorraquidiano (SDLCR) emergiram como uma medida importante para melhorar o outcome neurológico dos doentes submetidos a cirurgia de AATA. A pressão de perfusão da medula espinhal (PPME) resulta da diferença entre a pressão arterial média (PAM) e a pressão do líquido cefalorraquidiano (PLCR) [(PPME = PAM – PCLR)].5 A hipoperfusão parece ser a etiologia primária da isquemia medular e o racional do uso do SDLCR tem como base a diminuição da PLCR, mantendo a PAM, para aumentar a PPME, com consequente diminuição do risco de isquemia e paraplegia.2,6 Apesar de no passado terem surgido alguns estudos que colocaram em causa o benefício do SDLCR, a evidência atual suporta a sua utilização nos doentes propostos para este tipo de cirurgia, como componente de uma estratégia multimodal de prevenção de lesão neurológica em AATA tipos I e II da classificação Crawford.5,7 No entanto, a cateterização do espaço subaracnoideu pode apresentar complicações, nomeadamente meningite, fistulização, hematoma epidural, hemorragia subaracnoídea, hipotensão intracraniana hemorragia cerebelar, cefaleia pós-punção da dura máter e lesão medular.8,9
Este trabalho foi realizado com o intuito de fornecer orientações aos profissionais de saúde que abordam os doentes submetidos a cirurgia de AATA com SDLCR. O móbil para realização deste protocolo passa sobretudo pelo número crescente do uso deste tipo de sistemas, pelo que é imperativo a familiarização dos diferentes membros da equipa médica e de enfermagem com as suas normas de utilização. Além disso, Mark et al.8 reportaram que na sua instituição uma grande parte dos casos de paraplegia surgiram entre os 1º e 3º dias de pós-operatório, daí a necessidade de extensão das instruções sobre estes sistemas a esse período. O objetivo principal é a otimização da abordagem destes doentes de modo a melhorar o outcome neurológico e minimizar o risco de complicações.
A estrutura deste trabalho foi baseada no protocolo The safe use of spinal drains in thoracic aortic surgery, publicado na Interactive CardioVascular and Thoracic Surgery pela European Association for Cardio-Thoracic Surgery.8 Esse protocolo foi elaborado por anestesiologistas, cirurgiões e enfermeiros envolvidos no tratamento de doentes submetidos a cirurgia de AATA com SDLCR, tendo sido sujeito, segundo os autores, a um rigoroso processo de avaliação por comissões hospitalares de segurança em Unidade de Cuidados Intensivos (UCI) antes da sua ratificação e generalização. O presente documento não tem a pretensão de fazer uma abordagem extensa de toda a conduta perioperatória para prevenir a lesão neurológica associada a este tipo de procedimento cirúrgico. Não obstante, os autores consideram pertinente fazer menção a outras estratégias de neuroprotecção que tem vindo a ganhar evidência crescente na literatura.
Segundo a evidência atual, os métodos de neuroprotecção tem com objetivos principais: I) minimização do tempo de isquemia medular, II) aumento da tolerância à isquemia, III) aumento da pressão de perfusão medular e IV) deteção precoce da isquemia medular.10,12
O primeiro ponto relaciona-se sobretudo com a técnica cirúrgica e com a possibilidade, se a anatomia da lesão assim o permitir, de realizar uma reconstrução multisegmentar da aorta e clampagens sequenciais.10
No que concerne o aumento da tolerância à isquemia, desde de há várias décadas se defende o papel neuroprotetor da hipotermia pela consequente redução da taxa metabólica medular e necessidades de oxigénio, tendo ainda revelado diminuir o edema celular após isquemia transitória em modelos animais. (11)12. No panorama atual, a hipotermia é a única intervenção que mostrou resultados mais consistentes na proteção medular na ausência de fluxo sanguíneo, contudo os estudos existentes variam grandemente no grau de hipotermia utilizado, incluindo desde a hipotermia moderada (34ºC) até à hipotermia profunda com utilização de circulação extra-corporal, sendo necessários estudos randomizados prospetivos para consolidar esta indicação.10 Na nossa instituição é prática comum a utilização de hipotermia profunda com bypass cardiopulmonar para a reparação de aneurismas e dissecções da aorta torácica por via aberta, preconizando-se normalmente a hipotermia ligeira a moderada nos restantes casos.
Outra técnica que vem sendo advogada é a hipotermia regional da medula com o objetivo de atingir os 25 - 27ºC.10 Porém, pelos risco aumentado de infeção e lesão de reperfusão com consequente edema não adotamos este método na nossa prática.
A utilização de farmacoterapias para aumentar a tolerância à isquemia ainda é alvo de muita discussão e não existe até ao momento indicação para a sua utilização neste tipo de procedimentos. Neste grupo incluem-se, entre outros, os corticoides, os expoliadores de radicais livres e a naloxona, com o intuito de reverter o efeito neurotóxico de opioides endógenos libertados após lesão medular. 10, 13
O papel dos corticoides na redução do edema neurotecidular sempre foi controverso e não é isento de efeitos adversos relevantes. Atualmente o painel de especialistas da Associação Europeia de Cirurgia Cardiotorácica considera a sua utilização apenas com potencial adjuvante em doentes com isquemia medular já instalada (nível de recomendação IIbC) .10
Relativamente aos restantes fármacos, nenhum deles reúne evidência consensual, apesar de ser nossa prática a utilização de manitol tendo em vista a expoliação de radicais livres produzidos por períodos de isquemia-reperfusão e o seu potencial papel renoprotector na nefropatia induzida por contraste no âmbito das reparações endovasculares.
O aumento da pressão de perfusão medular é atingido através da utilização do SDLCR e por preservação/hipertensão ao nível das artérias proximais e distais á lesão, recorrendo em casos selecionados à perfusão aórtica distal e, como foi dito anteriormente, à circulação extracorporal.2, 7
Um dos pontos fulcrais no cenário da isquemia medular é a sua deteção precoce.10 Para tal o método mais sensível continua a ser o exame neurológico precoce e minucioso com o conceito de cirurgia fasttrack.10(11) Se exequível está indicada a monitorização neurológica intra-operatória com potenciais evocados (e respetiva adaptação da técnica anestésica), cuja diminuição da amplitude mostrou correlação com a isquemia medular, mas a sensibilidade e especificidade desta técnica ainda não está determinada.10
RESPONSABILIDADES
Estas orientações devem estar disponíveis e ser seguidas por toda a equipa envolvida no tratamento de doentes intervencionados a cirurgia de AATA com SDLCR. Os documentos finais deste protocolo devem ser impressos e anexados ao processo físico do doente. O seu adequado registo é essencial, assim como a comunicação dos mesmos entre serviços e equipas.
A QUEM SE APLICA?
A doentes submetidos a correção cirúrgica de AATA tipo I, II ou III da classificação Crawford. Na nossa instituição este procedimento é utilizado geralmente em doentes propostos para reparações aneurismáticas por via endovascular e aberta, sendo, na maioria dos casos, o SDLCR colocado preventivamente no período préoperatório.
Em casos selecionados também se utilizam os SDLCR em doentes com aneurismas ou dissecções da aorta torácica intervencionados por via aberta e com circulação extracorporal.
ORIENTAÇÕES
1. Colocação do SDLCR
Deverá ser assinado um consentimento informado e documentado o exame neurológico prévio à técnica. As contraindicações absolutas para a realização desta técnica são a recusa do doente, coagulopatia (congénita ou adquirida); o tempo de suspensão de antiagregantes e anticoagulantes (que deve respeitar os consensos da Sociedade Portuguesa de Anestesiologia13), existência de hipertensão intracraniana e/ou infeção do local de punção. Aneurisma roto, cirurgia prévia à coluna espinhal, défices neurológicos ativos e infeção sistémica também podem apresentar-se como contraindicações. Ponderado o risco-benefício de colocação do SDLCR e discutido o caso de forma multidisciplinar, a técnica é realizada por um anestesiologista, preferencialmente, o responsável pelo doente no intraoperatório.
A colocação do SDLCR (técnica asséptica) deve ser, preferencialmente, realizada com o doente acordado, mas é lícito fazê-lo com o doente anestesiado.5 A sua colocação com o doente acordado permite monitorizar o aparecimento de parestesias ou dor, o que servirá para minimizar o risco de lesão neurológica. O doente pode ser posicionado em decúbito lateral ou em posição de sentado, de acordo com a preferência do anestesiologista e/ou conforto do doente. O local de punção deve ser L4-L5 ou L3-L4 e o catéter deve ser introduzido 8 a 10 cm para além da ponta da agulha de punção.5 Se surgirem parestesias durante a inserção do catéter, este deve ser ligeiramente retirado e fixo à distância em que a parestesia desapareceu, preservando, no mínimo 4 cm de catéter no espaço subaracnóideu.
Após a colocação, o catéter deve ser ligado, preferencialmente, a um transducer e a um saco de colheita de líquido cefalorraquidiano (LCR). O preenchimento do catéter pode ser feito de forma retrógrada com LCR do doente ou com solução salina estéril antes da introdução do catéter. Dado o risco de injeções inadvertidas através do SDLCR, este deve ser devidamente identificado e não pode ser conectado a um sistema de flush.
Estes cuidados mantêm-se em todo o perioperatório.
2. Período intraoperatório
Após inserção do SDLCR, a placa do transducer é colocada ao nível do eixo flebostático, sendo o LCR drenado pela ação da gravidade de modo a manter a PLCR <10 mmHg ou para manter uma PPME de 70 mmHg.5,9 Preferencialmente a PLCR deve ser monitorizada continuamente uma vez que a manipulação dos seus componentes representa decisões terapêuticas importantes, minimiza o risco de hipotensão intracraniana e permitir identificar a oclusão da drenagem (com perda de curva de pressão).5 O volume drenado deve ser no máximo de 10-15 mL/h.5 Por questões de segurança, e de modo a prevenir hipotensão intracraniana e, em casos extremos, desenvolvimento de hemorragia intracraniana em consequência de drenagens excessivas, o anestesiologista responsável deve definir como limite inferior da coluna de pressão do sistema coletor os 10cmH2O, que equivale a, aproximadamente, uma PLCR de 7mmHg.
Não devem ser usados opioides no espaço subaracnóideu, já que podem exacerbar o risco de isquemia.5
3. Período pós-operatório
A vigilância durante este período fica a cargo das equipas da UCI. As recomendações incluem: 1) PAM > 80-100 mmHg (se necessário recorrer a vasopressores), 2) PLCR <15 mmHg e 3) no caso de controlos mais difíceis da PLCR, manter a PPME > 70 mmHg elevando a PAM (PPME = PAM - PLCR).5,8
Deve manter-se uma PAM adequada (80-100 mmHg), visando uma PPME de, pelo menos, 70 mm Hg, recorrendo, se necessário, a vasopressores.5,8,10
A escolha do vasopressor deve ter por base a compreensão do(s) mecanismo(s) que está(ão) na origem da hipotensão Admitindo uma hipotensão por disfunção autonómica secundária à lesão medular isquémica, sendo o mecanismo primordial a vasodilatação periférica devem privilegiar-se vasoconstritores periféricos, sendo a noradrenalina a primeira escolha. Não obstante devem ser investigados e tratados outros mecanismos de hipotensão, tal como a depleção de volume intravascular.14
Pelas mesmas questões de segurança supramencionadas, o limite inferior da coluna de pressão do sistema coletor deve ser os 10 cmH2O.
Assim que possível deve ser realizado um exame neurológico.
DOCUMENTOS DO PROTOCOLO
O protocolo para redução do risco de paraplegia e minimização de complicações é composto por 5 documentos.
1. Documento 1
Este documento tem como objetivo descrever a técnica de colocação do SDLCR. Deve ser devidamente preenchido pelo anestesiologista após a técnica.

2. Documento 2
Este documento serve para registo da PLCR, PPME, do volume de LCR drenado por hora e do volume de LCR drenado no total. O registo deve ser iniciado no bloco operatório e continuar na UCI, com um intervalo horário, de modo a permitir uma vigilância destas variáveis. Em cada dia de registo deve ser impressa uma nova folha, anexada ao processo do doente.

3. Documento 3
O documento 3 serve como checklist e auxiliar de memória quando o doente chega à UCI. Deverá ser considerado o seguinte:
1.A cabeceira do doente elevada a 30º;
2. O transducer está posicionado a nível do eixo flebostático;
3. O SDLCR está devidamente identificado;
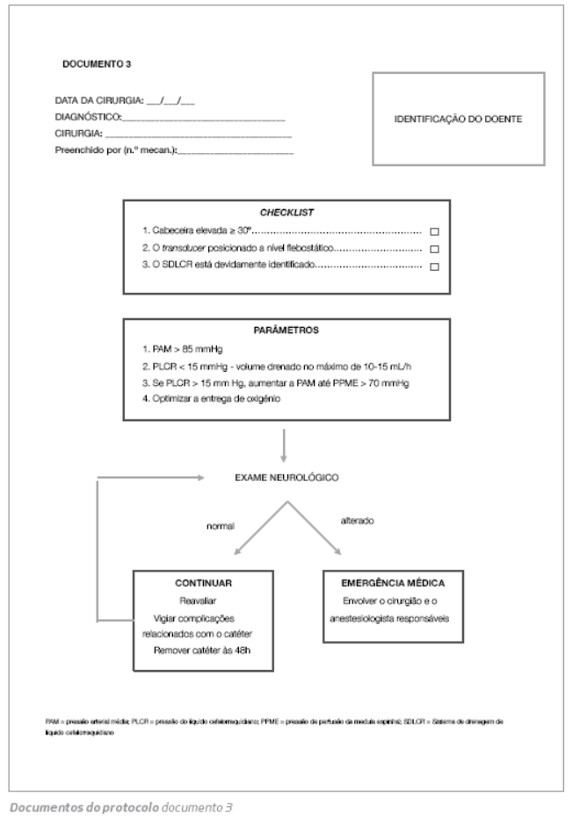
Este documento destaca ainda as orientações descritas no Período pós-operatório (página 2): PAM >80-100 mmHg e PLCR <15 mmHg, monitorizada preferencialmente de forma contínua. Para atingir esta pressão, o volume drenado deve ser no máximo de cerca de 10-15 mL/h.8 No caso de controlos mais difíceis da PLCR manter a PPME >70 mmHg elevando a PAM.8 Se algum défice neurológico for verificado, isto representa uma emergência médica e o cirurgião e o anestesiologista devem ser envolvidos. O registo do exame neurológico deve ser em diário clínico.
4. Documento 4
Este documento providencia a escala de avaliação motora e a Escala de Coma de Glasgow.

5. Documento 5
Qualquer alteração neurológica de novo detetada no período pós-operatório é considerada uma emergência médica. Este documento providencia uma abordagem perante essa deteção. Como referido anteriormente, os médicos assistentes devem ser envolvidos.
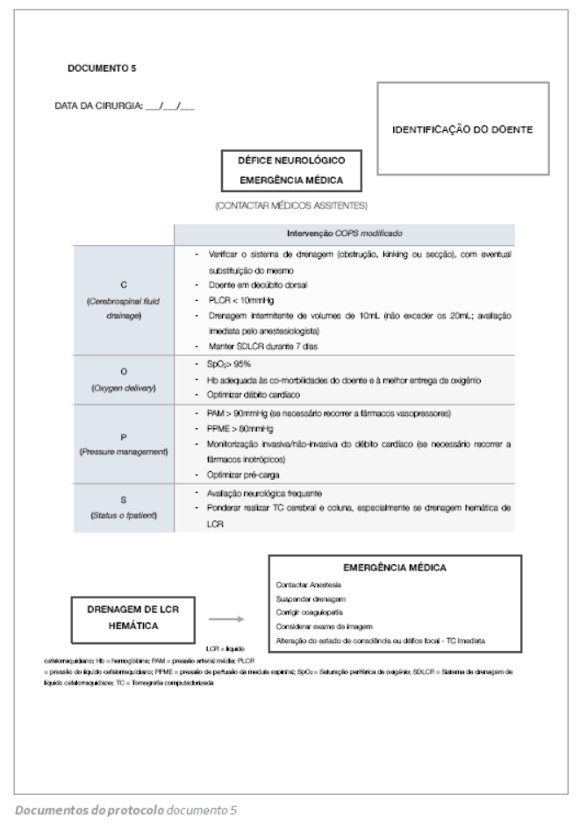
Esta abordagem é baseada no manuscrito de Estrera et al.( 15) O descrito protocolo COPS modificado é iniciado de forma a reverter o compromisso neurológico.
1. C (Cerebrospinal fluid drainage): verificar se o sistema de drenagem está a funcionar corretamente e se não está obstruído, dobrado ou seccionado. Posicionar o doente em decúbito dorsal e drenar LCR até PLCR <10mmHg (drenagem intermitente de volumes de 10mL, sem exceder os 20mL). O SDLCR deve ser mantido durante 7 dias em vez dos 3 dias habituais. No caso de paraplegia de início tardio após a remoção do dreno, este deve ser recolocado de imediato.
2. O (Oxygen delivery): tentativa de otimização da entrega de oxigénio (O2). A saturação periférica de O2 deve ser superior 95%, se necessário com O2 suplementar. O valor de hemoglobina deve ser adequado às co-morbilidades do doente e à melhor entrega de O2, com monitorização frequente dos parâmetros de metabolismo anaeróbio. Adicionalmente, qualquer suspeita de baixo débito cardíaco deve ser investigada e intervencionada, recorrendo a ionotrópicos se necessário.
3. P (Pressure management): em resposta ao compromisso neurológico, é imprescindível a manipulação dos componentes da PPME (PPME = PAM - PLCR). Otimização do valor de PAM recorrendo se necessário a vasopressores. Se a descida da PLCR < 10 mmHg for fruste, admitir subir mais a PAM para manter a PPME.
4. S (Status of patient): uma avaliação neurológica mais pormenorizada poderá estar indicada neste cenário. Ponderar realizar tomografia computorizada (TC) cerebral e da coluna dorsal, especialmente quando há visualização de LCR hemático.
PROBLEMAS RELACIONADOS COM O SDLCR
1. Deslocação do penso
A área exposta deve ser limpa e desinfetada com clorexidina, permitindo que seque antes da aplicação de novo penso (intervenção com caráter urgente).
2. SDLCR não funcionante
Se tal ocorrer imediatamente após a colocação do catéter, o mais provável é que este esteja kinkado ou obstruído. Perante isto, o penso deve ser refeito, e no caso de obstrução do catéter, este deve ser substituído.
3. Drenagem de LCR com vestígio hemático no pós-operatório:
À semelhança do aparecimento de alterações neurológicas de novo, também a drenagem de LCR com vestígios hemáticos no período pós-operatório é considerada uma emergência médica, com necessidade de avaliação pelo anestesiologista e/ou cirurgião assistentes (Documento 5). Nesta situação, as seguintes intervenções devem ser iniciadas:
a) suspender drenagem de LCR;
b) corrigir eventual coagulopatia;
c) considerar a realização de exames de imagem (TC), de modo a excluir a existência de hemorragia intracaniana ou hematoma medular;
d) em caso de alteração do estado de consciência ou défice focal, realizar TC
4. Complicações associadas aos SDLCR
Os principais riscos associados a esta técnica são a hemorragia do neuroeixo e intracraniana, cefaleias e infeção, sendo reportadas na literatura complicações em até 2% dos doentes.( 16)
EVITAR ADMINISTRAÇÕES ACIDENTAIS
De modo a evitar a administração acidental de fármacos endovenosos através do catéter do SDCLR, todas as torneiras de acesso ao sistema devem ser protegidas por uma compressa estéril, tornando-se assim mais facilmente distinguíveis dos acessos endovenosos.
REMOÇÃO DO CATÉTER DRENAGEM DE LCR
O catéter deve manter-se menos de 48 horas, de modo a minimizar o risco de infeção.5
O SDLCR per se não justifica a administração de antibiótico, devendo o doente manter a profilaxia da infeção do local cirúrgico indicada para o procedimento realizado.
Devem ser mantidos os cuidados de assepsia em todas as eventuais manipulações do catéter que sejam realizadas. Deve haver vigilância regular do penso de fixação do SDLCR, estando alerta para aparecimento de sinais de infeção no local de punção e para a elevação de parâmetros laboratoriais de inflamação que não sejam justificados pelo período pós-operatório.
Deve realizar-se avaliação do estado de coagulação do doente, corrigindo se necessário para normalização do mesmo. Na retirada do catéter deve ser respeitado o tempo de suspensão e reinício dos antiagregantes e anticoagulantes descritos nos Consensus da Sociedade Portuguesa de Anestesiologia.13
Durante o tempo de suspensão dos anticoagulantes, habitualmente 12 horas (tempo de segurança para a dose profilática da enoxaparina) faz-se clampagem do catéter e monitoriza-se o desenvolvimento de sinais/sintomas de isquemia medular. (17)
O penso protetor do local de punção e inserção do catéter deve ser transparente.
Em caso de leaking através do local de inserção do catéter após a sua remoção, o anestesiologista deve ser informado. Para diferenciar entre LCR e líquido intersticial, deve ser colhida uma amostra do mesmo para realização de análise bioquímica (glicose, células, pH e eletrólitos). O tratamento inicial desta situação envolve medidas conservadoras, que incluem repouso com cabeceira a menos de 30º e hidratação. Se 24 horas após instituição destas medidas o leaking permanecer, devem ser avaliadas outras intervenções.
Como descrito anteriormente, caso se verifiquem alterações neurológicas tardias após a remoção do catéter, este deve ser recolocado de imediato e mantido durante 7 dias, com otimização máxima da PAM.
CONCLUSÃO
Os SDLCR devem ser utilizados numa perspetiva multimodal com o intuito de reduzir a incidência de paraplegia após a correção cirúrgica de AATA. A cateterização do espaço subaracnóideu não é inócua e pode estar associado a complicações. Este trabalho descreve uma abordagem aos doentes com proposta cirúrgica para ATAA com SDLCR de modo a melhorar o outcome neurológico, minimizar o risco de complicações e aumentar a segurança.
BIBLIOGRAFIA
1. Buth J, Harris PL, Hobo R, van Eps R, Cuypers P, Duijm L, Tielbeek X. Neurologic complications associated with endovascular repair of thoracic aortic pathology: incidence and risk factors. A study from the European Collaborators on Stent/Graft Techniques for Aortic Aneurysm Repair (EURO-STAR) registry. J Vasc Surg 2007;46:1103–11 [ Links ]
2. Wong CS, Healy D, Canning C, Coffey JC, Boyle JR, Walsh SR. A systematic review of spinal cord injury and cerebrospinal fluid drainage after thoracic aortic endografting. J VascSurg. 2012 Nov;56 (5):1438-47 [ Links ]
3. Augoustides JG, Stone ME, Drenger B. Novel approaches to spinal cord protection during thoracoabdominal aortic interventions. Curr Opin Anaesthesiol. 2014 Feb;27(1):98-105 [ Links ]
4. Becker DA1, McGarvey ML, Rojvirat C, Bavaria JE, Messé SR. Predictors of outcome in patients with spinal cord ischemia after open aortic repair. Neurocrit Care. 2013 Feb;18(1):70-4. doi: 10.1007/ s12028-012-9807-9. [ Links ]
5. Khan SN, Stansby G. Cerebrospinal fluid drainage for thoracic and thoracoabdominal aortic aneurysm surgery. Cochrane Database Syst Rev. 2012 Oct 17;10:CD003635 [ Links ]
6. Fedorow CA, Moon MC, Mutch WA, Grocott HP. Lumbar Cerebrospinal Fluid Drainage for Thoracoabdominal Aortic Surgery: Rationale and Practical Considerations for Management. Anesth Analg. 2010 Jul;111 (1):46-58 [ Links ]
7. Cinà CS, Abouzahr L, Arena GO, Laganà A, Devereaux PJ, Farrokhyar F. Cerebrospinal fluid drainage to prevent paraplegia during thoracic and thoracoabdominal aortic aneurysm surgery: a systematic review and meta-analysis. J Vasc Surg. 2004 Jul;40(1):36-44. [ Links ]
8. Field M, Doolan J, Safar M, Kuduvalli M, Oo A, Mills K, Kendall J, Desmond M. The safe use of spinal drains in thoracic aortic surgery. Interact Cardiovasc Thorac Surg 2011;13(6):557-65 [ Links ]
9. Cole SP. Intensive Care Management of Thoracic Aortic Surgical Patients, Including Thoracic and Infradiaphragmatic Endovascular Repair (EVAR/TEVAR). Semin Cardiothorac Vasc Anesth, 2015, Vol. 19 (4) 331–341 [ Links ]
10. Etz CD, Weigang E, Hartert M, Lonn L, Mestres CA, Di Bartolomeo R et al. Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular aortic repair: a position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothorac Surg 2015;47:943–57. [ Links ]
11. Acher C, Acher CW, Marks E, Wynn M. Intraoperative neuroprotective interventions prevent spinal cord ischemia and injury in thoracic endovascular aortic repair. J. Vasc Surg. 2016 Jun; 63 (6): 1458-65 [ Links ]
12. Bobadilla JL, Wynn M, Tefera G, Acher CW. Low incidence of paraplegia after thoracic endovascular aneurysm repair with proactive spinal cord protective protocols. J Vasc Surg. 2013 Jun;57(6):1537-42. doi: 10.1016/j.jvs.2012.12.032. Epub 2013 Mar 13. [ Links ]
13. Fonseca C, Alves J, Araújo F. Manuseio Peri-operatório dos doentes medicados com anticoagulantes e antiagregantes plaquetarios: resultado da 3ª reunião de consenso da Sociedade Portuguesa de Anestesiologia. Ver Soc Port Anestesiol 2014, Vol. 23 - nº3,76-93 [ Links ]
14. McGarvey ML, Mullen MT, Woo EY, Bavaria JE, Augoustides YG, Messé SR, Cheung AT. The treatment of spinal cord ischemia following thoracic endovascular aortic repair. Neurocrit Care. 2007;6(1):35-9. [ Links ]
15. Estrera A, Sheinbaum Roy, Miller C, Aizzadeh A, Walkes JC, Lee TY, Kaiser L, Safi H. Cerebrospinal Fluid Drainage During Thoracic Aortic Repair: Safety and Current Management. Ann Thorac Surg 2009;88:9-15. [ Links ]
16. Youngblood SC, Tolpin DA, LeMaire SA, Coselli JS, Lee VV, Cooper JR. Complications of cerebrospinal fluid drainage after thoracic aortic surgery: a review of 504 patients over 5 years. J Thorac Cardiovasc Surg 2013;146:166-71. [ Links ]
17. Riambau V, Capoccia L, Mestres G, Matute P. Spinal cord protection and related complications in endovascular management of B dissection: LSA revascularization and CSF drainage. Ann Cardiothorac Surg. 2014 May;(3):336-8
Correio eletrónico: lmsferreira86@gmail.com (M.Ferreira).
Recebido a 27 de março de 2017
Aceite a 11 de abril de 2018














