Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc vol.14 no.1 Lisboa mar. 2018
ARTIGO DE REVISÃO
Tratamento endovascular de lesões femoro-poplíteas calcificadas
Endovascular treatment of calcified femoropopliteal lesions
Marina Dias-Neto1,2, José Fernando Ramos1, José Fernando Teixeira1
1 Serviço de Angiologia e Cirurgia Vascular, Centro Hospitalar de São João Porto, Porto
2Centro de Investigação Cardiovascular, Faculdade de Medicina da Universidade do Porto, Porto
Autor para correspondência
RESUMO
A calcificação vascular é um achado frequente na doença arterial periférica e traz desafios adicionais ao tratamento endovascular, quer na recanalização, quer na durabilidade das intervenções.
A falta de estandardização na classificação da calcificação das artérias periféricas tem levado a uma caracterização insuficiente do desempenho dos dispositivos endovasculares no subgrupo de lesões calcificadas do setor femoro-poplíteo.
O objetivo desta revisão é fazer um levantamento da evidência disponível quanto às atuais opções no tratamento endovascular de lesões muito calcificadas do sector femoro-poplíteo.
Palavras-chave: Doença arterial periférica, tratamento endovascular, calcificação.
ABSTRACT
Vascular calcification is a frequent finding in peripheral arterial disease and remains an additional challenge to endovascular treatment in both recanalization and durability of interventions.
The lack of standardization in the classification of peripheral artery calcification has led to a defective characterization of the performance of endovascular devices in the subgroup of calcified lesions of the femoropopliteal sector.
The objective of this review is to make a survey of the available evidence regarding the current options in the endovascular treatment of highly calcified lesions of the femoropopliteal sector.
Keywords: Peripheral arterial disease, endovascular treatment, calcification.
TRATAMENTO
INTRODUÇÃO
A calcificação vascular é um achado frequente na doença arterial periférica e representa um desafio para o tratamento endovascular.(1) A extensão da calcificação contribui para uma elevada taxa de falência técnica durante a recanalização percutânea de oclusões femoro-poplíteas crónicas. (2)(3) A exuberância da calcificação pode comprometer a penetração intraluminal dos fios-guia e de cateteres tornando a cateterização subintimal a única opção. Por outro lado, a calcificação da camada média pode tornar quase impossível a reentrada no lúmen do vaso, requerendo um ponto de reentrada mais distal e menos calcificado. Finalmente, a calcificação constitui ainda um preditor de falência dos próprios dispositivos de reentrada.(1)
Para além da recanalização, os resultados do tratamento endovascular são também frequentemente afetados pelo grau de calcificação. Em doentes com calcificação bilateral, em comparação com calcificação unilateral ou ausência de calcificação, as taxas de permeabilidade primária são significativamente mais baixas, quer após angioplastia, quer após colocação de stent, seja ele bare metal stent (BMS) ou drug-eluting stent (DES).(4) Finalmente, um maior volume total de placa calcificada foi encontrado em doentes que desenvolveram reestenose (> 50%) após angioplastia e/ou stenting, em comparação com aqueles que não tiveram reestenose.(5)
O bypass cirúrgico continua a ser uma alternativa muito aceitável, mesmo que a calcificação medial extensa também possa exigir um local de anastomose distal, menos calcificado. No entanto, vários problemas podem limitar o seu uso, como a falta de adequado conduto autólogo ou a gravidade das comorbilidades, sempre que conferirem um risco operatório significativo.
O objetivo desta revisão é fazer um levantamento das atuais opções no tratamento endovascular de lesões muito calcificadas do sector femoro-poplíteo.
MÉTODOS
A pesquisa de artigos a incluir neste trabalho foi realizada com recurso à base de dados MEDLINE acessível através da Pubmed (https://www.ncbi.nlm.nih.gov/pubmed/). Foram utilizados os seguintes termos de pesquisa: calcification, TASC D, superficial femoral artery, peripheral artery disease, critical limb ischemia, revascularization, endovascular, angioplasty, plain balloon, drug-elutiong balloon, bare metal stent, nitinol stent, drug-eluting stent, Viabahn, Supera e aterectomy. Para cada um dos tópicos da discussão foi realizada uma pesquisa com os termos mais adequados ao subtema tratar. Foram incluídas as referências mais recentes e as que se referiam a estudos com o maior número de participantes, procurando reconhecer e salientar as principais questões e dificuldades da prática clínica diária relacionadas com a calcificação vascular periférica.
DISCUSSÃO
Classificação da calcificação nas artérias periféricas
Uma limitação ao estudo das estratégias endovasculares em doentes com lesões muito calcificadas é o fato de não haver um score de calcificação uniforme e universalmente aceite para as artérias periféricas. A TASC II parece reconhecer a importância da calcificação na classificação das lesões femoro-poplíteas. Uma oclusão ≤5cm é classificada como TASC A, no entanto, se apresentar calcificação exuberante a sua classificação passa para TASC B(6). Contrariamente às artérias coronárias, onde a presença de calcificação exuberante segundo critérios angiográficos foi significativamente associado ao desfecho clínico após intervenção coronária percutânea(7), um score equivalente ainda não foi criado para a doença vascular periférica. Os critérios de inclusão e/ou exclusão dos estudos clínicos de dispositivos endovasculares têm classificado o grau de calcificação com base na incidência angiográfica ântero-posterior ou em duas incidências ortogonais ou com base na proporção de calcificação circunferencial da parede. Rocha-Singh JR propôs o PACSS (Proposed Peripheral Arterial Calcium Scoring System)(8) que se baseia na imagem de fluoroscopia e na respetiva subtração (DAS, digital angiografic subtraction) na incidência ântero-posterior (Figura 1). Fanelli F(9) utilizou imagens de angiotomografia computorizada, no plano axial, para quantificar a distribuição circunferencial do cálcio na parede vascular. As imagens do plano axial bidimensional permitem a visualização dos diferentes componentes da parede arterial, tais como cálcio, trombo e fluxo sanguíneo. Os graus foram medidos pela avaliação da presença de cálcio em um ou mais dos quatro setores de 90°: grau 1 (0-90°), grau 2 (0-180°), grau 3 (0-270°) ou grau 4 (0-360º). Cada um destes graus pode ser ainda complementado com dados relativos à extensão da calcificação: a) <3cm ou b) >3cm.
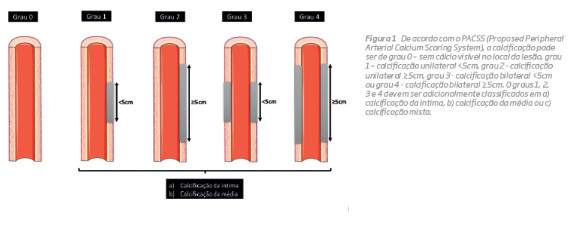
Finalmente, as classificações propostas carecem de discriminação quando se trata de doentes com lesões extensas e severamente calcificadas. Em muitos estudos randomizados para aprovação de dispositivos ou estratégias endovasculares, a presença de calcificação circunferencial densa com mais do que 5cm contínuos de comprimento antes da injeção do contraste constitui um critério de exclusão. A exclusão destes doentes visa evitar complicações como disseções, perfurações e embolização distal(8), mas cria simultaneamente uma ausência de evidência sobre o resultado das técnicas endovasculares neste grupo de doentes.
A angioplastia simples ou com drug-coated balloons (DCB) é uma boa opção em lesões calcificadas?
A angioplastia de lesões severamente calcificadas é limitada pelo recolhimento elástico e por resultados limitados a curto e a longo prazo.(10)
Especificamente na angioplastia com DCB, o estudo DEBELLUM revelou que as taxas de permeabilidade ao 1º ano caíram rapidamente de 90% para 50% quando a lesão tratada apresentava uma placa com calcificação em muitos quadrantes.(11)(12) Vários estudos sugerem que a tecnologia de DCB não é capaz de endereçar a calcificação, resultando num menor efeito em doentes com elevado grau de calcificação.(9)(13)
Por conseguinte, existem três cenários potenciais que podem afetar negativamente o efeito do fármaco biológico em lesões gravemente calcificadas: (1) as placas calcificadas na íntima podem impedir que as partículas do fármaco formem reservatórios de fármaco com concentração suficiente ou podem promover uma maior lavagem do fármaco, (2) a calcificação circunferencial da parede do vaso pode afetar negativamente a penetração de drogas na adventícia e (3) a calcificação circunferencial com esclerose medial de Mönckeberg pode interferir e/ou evitar a remodelagem arterial.(9)
Qual o stent mais adequado para lesões calcificadas?
As limitações dos stents de nitinol atualmente disponíveis são bem conhecidas, no entanto poucos estudos especificam a sua performance em função dos graus de calcificação das lesões tratadas. Uma meta-análise recente mostrou que o comprimento da lesão e o índice tornozelo-braço eram preditores independentes de permeabilidade primária e de necessidade de revascularização da lesão-alvo 12 meses após a implantação do stent de nitinol.(14) A par do comprimento da lesão, o número de stents utilizados também parece afetar a ocorrência de fraturas, o que, por sua vez, pode afetar as taxas de reestenose e de trombose. (15) Numa série de casos tratados por oclusão femoro-poplítea onde foi necessária a utilização de sistema de reentrada com implantação adicional de BMS, a taxa de estenose residual ≥ 30% ocorreu numa percentagem elevada de casos (43%). As altas forças de compressão aplicadas contra os stents de nitinol por lesões femoro-poplíteas rígidas resultaram numa expansão incompleta e/ou excêntrica do stent num elevado número de casos; os doentes que ficaram com estenose residual >30% apresentaram uma permeabilidade significativamente inferior aos 12 meses, em comparação com os doentes que ficaram com estenose residual <30%1. Por fim, em análise multivariada, o grau de calcificação foi negativamente associado com a permeabilidade primária após o tratamento endovascular da artéria femoral superficial, incluindo angioplastia e/ou stenting, no entanto a análise dos subgrupos de tratamento não foi realizada neste trabalho. (4)(5)
O stent Supera® (Abbott Vascular®) apresenta um exclusivo design de fios de nitinol entrelaçados, proporcionando uma força de resistência à compressão quatro vezes maior e potencial para uma expansão superior do stent em lesões severamente calcificadas, sendo a estenose residual praticamente não observada.(16-18) Num registo observacional, este stent resultou numa maior preservação do lúmen do vaso, particularmente em lesões severamente calcificadas, em comparação com os tradicionais de stent nitinol.(19)
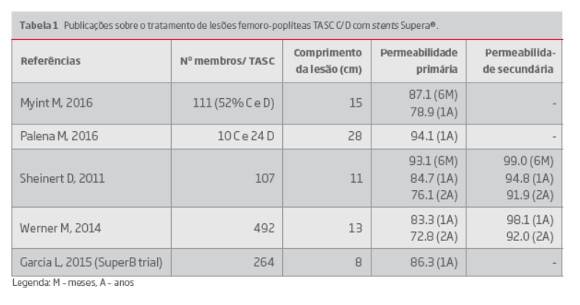
No entanto, especialmente em lesões gravemente calcificadas, a implantação de um stent Supera® pode ser difícil devido ao recolhimento elástico da placa ou à abertura incompleta do balão de pré-dilatação. Nestes casos, o stent corre o risco de alongar, resultando numa força de resistência à compressão insuficiente e consequente menor permeabilidade.(17) Estão publicados estudos observacionais uni e multicêntricos sobre o uso de stent Supera® “no mundo real” (Tabela 1). A taxa de permeabilidade primária após implantação do stent Supera® foi de 87.1-93.1 aos 6 meses, 78.9-94.1% aos 12 meses e 72.8-76.1 aos 2 years. (17-21) Nos mesmos estudos, a taxa e permeabilidade secundária foi de 99% aos 6 meses, 86.2-98.1% aos 12 meses, 91.9-92.0% aos 2 anos, 78.8-79.5 aos 3 anos e 77.5% aos 5 anos.
O efeito dos DES especificamente em lesões calcificadas permanece incompletamente esclarecido. A maior parte dos estudos disponíveis não apresenta resultados quanto à permeabilidade primária ou de revascularização de lesão-alvo em função do grau de calcificação das lesões femoro-poplíteas. (22-24) No estudo MAGESTIC25, a permeabilidade primária aos 2 anos após DES foi de 83,5% (intervalo de confiança a 95%: 73,6-93,3%) para a coorte total de 57 doentes e de 85,5% (intervalo de confiança a 95%: 73,8-97,3%) para doentes como calcificação severa (n = 37). Salienta-se, contudo, que 90% dos doentes eram TACS A e B e que a calcificação foi considerada severa mediante a presença de radio-opacidades estendendo apenas mais de 1cm em ambos os lados da parede arterial antes da injeção de contraste.
Haverá vantagem no bypass endovascular?
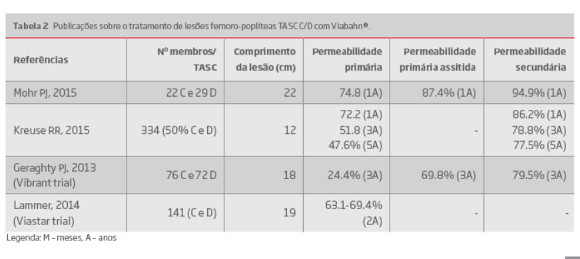
As lesões femoro-poplíteas do tipo TASC D incluem oclusão total da artéria femoral comum ou da artéria femoral superficial (20 cm ou oclusão total da artéria poplítea e vasos de trifurcação proximal). A principal desvantagem do tratamento endovascular de lesões femoro-poplíteas complexas é a falência a longo prazo devido a reestenose. (6) Os stents cobertos têm sido sugeridos como capazes de impedir ou limitar o crescimento de mioíntima ao longo do segmento tratado.(26) Apesar da escassez de trabalhos com análise de subgrupos mediante diferentes graus de calcificação, vários estudos reportaram os resultados desta estratégia nas lesões TASC C e D do sector femoro-poplíteo.(27-30) A permeabilidade primaria após implantação de Viabahn® (GORE) variou de 72.2-74.8% aos 12 meses, 63.1%-69.4% aos 2 anos, 24.4%-51.8% aos 3 anos e 47.6% aos 5 anos. Nos mesmos estudos, a permeabilidade secundária foi de 86.2%-94.9% aos 12 meses, 78.8-79.5% aos 3 anos e 77.5 aos 5 anos (Tabela 2).
A principal vantagem da utilização de stents cobertos em lesões calcificada poderá residir na possibilidade de se proceder a uma pós-dilatação mais agressiva através da utilização de balões de maior diâmetro ou de balões de alta pressão sem risco de perfuração ou de embolização distal, resultando numa otimização do diâmetro final da artéria tratada. Esta estratégia de “pave and crack” seguida de colocação de stent Supera® tem sido cumulativamente apresentada como uma estratégia de recurso em casos altamente selecionados de calcificação exuberante. Por fim, é possível que o sucesso desta estratégia possa ser limitado por potenciais desvantagens do bypass endovascular como a oclusão de colaterais e o eventual maior risco de trombose aguda dependente do run-off.
A aterectomia direcional (DA) é o futuro?
O objetivo do estudo de Cioppa A(31) foi demonstrar segurança e eficácia de uma abordagem endovascular combinada utilizando DA e DCB para o tratamento de lesões severamente calcificadas no setor femoro-poplíteo. Nesta coorte foram incluídos 30 doentes que apresentavam claudicação limitante das atividades de vida diária (n=18) ou isquemia crítica (n=12). A implantação de stent foi permitida apenas no caso de dissecções limitantes de fluxo ou resultado subóptimo (estenose residual> 50%) por estimativa visual e foi necessário em apenas dois casos (6,5%). Aos 12 meses de seguimento, o ecodoppler de controlo demonstrou reestenose significativa a requer reintervenção em 3 casos (TLR = 10%); a taxa de permeabilidade secundária aos 12 meses foi de 100%. O propósito do estudo DEFINITIVE Ca++32 subsequente foi avaliar a segurança e eficácia da DA com proteção embólica distal no tratamento de lesões femoro-poplíteas com calcificação moderada a severa. Foi incluído um total de 133 indivíduos com 168 lesões moderada a gravemente calcificadas. Aproximadamente um terço (31,6%) da população apresentava claudicação moderada, 52,6% apresentava claudicação severa e 15,8% apresentava dor isquémica em repouso. O comprimento médio da lesão foi de 39.06±27,0 mm, 17,9% das lesões eram oclusões e 81,0% eram severamente calcificadas. O sucesso técnico primário foi alcançado em 88,6% (117/132) de doentes. Os 15 casos de falência foram devidos a: não obtenção de estenose residual ≤50%, efeitos adversos major (morte, enfarte, disseção tipo C, perfuração, pseudoaneurisma, trombose, embolização distal clinicamente significativa) em 9 casos, mau funcionamento do dispositivo que condicionou que o procedimento fosse abortado num caso e incapacidade de inicializar o filtro utilizado com sucesso em 4 casos.
Notavelmente, a duração do procedimento (72 minutos) para tratar comprimentos de lesões relativamente curtas e o aumento dos custos de dispositivos associados ao uso obrigatório de um dispositivo de proteção distal, realçam os desafios do tratamento de artérias periféricas severamente calcificadas.
O estudo DEFINITIVE AR33, prospetivo e randomizado parece ter reproduzido esses resultados com taxas de permeabilidade de 1 ano em lesões mais longas (> 10 cm) de 96,8% por ecodoppler e 90,9% por angiografia para DA seguida de DCB (DAART). As taxas de permeabilidade em lesões gravemente calcificadas também parecem ter melhorado com DAART versus DCB. No entanto foi notória a diminuição franca da permeabilidade aos 12 meses no subgrupo de doentes com calcificação severa que foi de 70.4% por ecodoppler e de 58.3% por angiografia (vs 62.5% por ecodoppler e 42.9% por angiografia no grupo DCB) (dados ainda não publicados sobre a forma de artigo).
Num recente estudo randomizado que incluiu 155 doentes 34 submetidos a tratamento de lesões de novo da artéria femoral superficial, a angioplastia com DCB e stent foi superior à angioplastia com balão simples e stent e à DA com proteção distal e stent de resgate, quer quanto à reestenose aos 6 meses, quer quanto à necessidade de revascularização da lesão alvo aos 24 meses. As lesões tratadas, comparáveis em todos os grupos, tinham um comprimento médio de 65,9 ± 46,8 mm, 56% eram oclusões e 17-33% por grupo apresentavam calcificação classificada como severa. Na angiografia aos 6 meses, a percentagem de estenose foi significativamente menor em doentes tratados com DCB e stent (34 ± 31%) em comparação com angioplastia simples e stent (56 ± 29%, p=0,009) ou DA (55 ± 29%, p=0,007). Da mesma forma, a reestenose binária foi significativamente menor após o tratamento com DCB e stent em comparação com angioplastia simples e stent ou DA. O seguimento clínico aos 24 meses revelou menor risco de revascularização da lesão alvo após angioplastia de DCB e stent em comparação com angioplastia simples e stent ou DA. Não foram encontradas diferença em termos de trombose da lesão-alvo nem de mortalidade entre os grupos e nenhum doente foi submetido a amputação. Não foi realizada análise de subgrupos em função da calcificação das lesões.
De uma forma geral a DA ou DAART parece merecer uma utilização judiciosa em lesões curtas, estenóticas, mas será menos aconselhável em lesões com calcificação severa, se há uma disseção ou em caso de recanalização subintimal ou após utilização de um dispositivo de reentrada.
CONCLUSÃO
A falta de estandardização na classificação da calcificação das artérias periféricas tem levado a uma caracterização insuficiente do desempenho dos dispositivos endovasculares no subgrupo de lesões calcificadas do setor femoro-poplíteo. Os DCB parecem ter uma atuação inferior em lesões calcificadas em comparação com lesões não-calcificadas, embora permaneça por esclarecer qual o mecanismo que contribui para este facto. Por outro lado, na ausência de estudos comparativos, o stent ideal para uma lesão calcificada provavelmente vai depender da localização da lesão. As lesões calcificadas na artéria poplítea poderão ter beneficio adicional do stent Supera® em comparação com outros stents face ao seu design especificamente concebido para resistir às forças compressivas que são características desta região de flexão. A principal vantagem dos stents cobertos prende-se com um eventual maior ganho luminal durante a preparação da lesão -alvo sem risco acrescido de perfuração ou outras complicações. Apesar de apelativa a estratégia de remoção da placa de aterosclerose, a DA é uma estratégia trabalhosa e demorada e provavelmente mais adequada a lesões curtas, podendo não constituir uma verdadeira alternativa em lesões extensas características dos graus C e D da classificação TASC. Por fim, impõe-se salientar que as atuais opções de tratamento não se esgotam totalmente nos dispositivos apresentados, sendo previsível que num futuro próximo conheçamos a relevância dos diferentes tipos de aterectomia (direcional, rotacional, orbital ou laser) ou do balão de litotrícia no tratamento de lesões calcificadas do sector femoro-poplíteo.
BIBLIOGRAFIA
1. Bausback Y, Botsios S, Flux J, Werner M, Schuster J, Aithal J, et al. Outback catheter for femoropopliteal occlusions: immediate and long-term results. J Endovasc Ther. 2011;18:13-21. [ Links ]
2. Scheinert D, Laird JR, Jr., Schroder M, Steinkamp H, Balzer JO, Biamino G. Excimer laser-assisted recanalization of long, chronic superficial femoral artery occlusions. J Endovasc Ther. 2001;8:156-66. [ Links ]
3. Scheinert D, Braunlich S, Scheinert S, Ulrich M, Biamino G, Schmidt A. Initial clinical experience with an IVUS-guided transmembrane puncture device to facilitate recanalization of total femoral artery occlusions. EuroIntervention. 2005;1:115-9. [ Links ]
4. Okuno S, Iida O, Shiraki T, Fujita M, Masuda M, Okamoto S, et al. Impact of Calcification on Clinical Outcomes After Endovascular Therapy for Superficial Femoral Artery Disease: Assessment Using the Peripheral Artery Calcification Scoring System. J Endovasc Ther. 2016;23:731-7. [ Links ]
5. Patel SD, Zymvragoudakis V, Sheehan L, Lea T, Modarai B, Katsanos K, et al. Atherosclerotic Plaque Analysis: A Pilot Study to Assess a Novel Tool to Predict Outcome Following Lower Limb Endovascular Intervention. Eur J Vasc Endovasc Surg. 2015;50:487-93. [ Links ]
6. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J Vasc Surg. 2007;45 Suppl S:S5-67. [ Links ]
7. Sianos G, Morel MA, Kappetein AP, Morice MC, Colombo A, Dawkins K, et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. EuroIntervention. 2005;1:219-27. [ Links ]
8. Rocha-Singh KJ, Zeller T, Jaff MR. Peripheral arterial calcification: prevalence, mechanism, detection, and clinical implications. Catheter Cardiovasc Interv. 2014;83:E212-20. [ Links ]
9. Fanelli F, Cannavale A, Gazzetti M, Lucatelli P, Wlderk A, Cirelli C, et al. Calcium burden assessment and impact on drug-eluting balloons in peripheral arterial disease. Cardiovasc Intervent Radiol. 2014;37:898-907. [ Links ]
10. Capek P, McLean GK, Berkowitz HD. Femoropopliteal angioplasty. Factors influencing long-term success. Circulation. 1991;83:I70-80 [ Links ]
11. Fanelli F, Cannavale A, Corona M, Lucatelli P, Wlderk A, Salvatori FM. The "DEBELLUM"--lower limb multilevel treatment with drug eluting balloon--randomized trial: 1-year results. J Cardiovasc Surg (Torino). 2014;55:207-16. [ Links ]
12. Fanelli F, Cannavale A, Boatta E, Corona M, Lucatelli P, Wlderk A, et al. Lower limb multilevel treatment with drug-eluting balloons: 6-month results from the DEBELLUM randomized trial. J Endovasc Ther. 2012;19:571-80. [ Links ]
13. Tepe G, Beschorner U, Ruether C, Fischer I, Pfaffinger P, Noory E, et al. Drug-Eluting Balloon Therapy for Femoropopliteal Occlu¬sive Disease: Predictors of Outcome With a Special Emphasis on Calcium. J Endovasc Ther. 2015;22:727-33. [ Links ]
14. Rocha-Singh KJ, Beckman JA, Ansel G, Lyden SP, Schneider P, Mehta M, et al. Patient-level meta-analysis of 999 claudicants undergoing primary femoropopliteal nitinol stent implantation. Catheter Cardiovasc Interv. 2017; [ Links ]
15. Acin F, de Haro J, Bleda S, Varela C, Esparza L. Primary nitinol stenting in femoropopliteal occlusive disease: a meta-analysis of randomized controlled trials. J Endovasc Ther. 2012;19:585-95. [ Links ]
16. Chan YC, Cheng SW, Cheung GC. Predictors of restenosis in the use of helical interwoven nitinol stents to treat femoropopliteal occlusive disease. J Vasc Surg. 2015;62:1201-9. [ Links ]
17. Garcia L, Jaff MR, Metzger C, Sedillo G, Pershad A, Zidar F, et al. Wire-Interwoven Nitinol Stent Outcome in the Superficial Femo¬ral and Proximal Popliteal Arteries: Twelve-Month Results of the SUPERB Trial. Circ Cardiovasc Interv. 2015;8 [ Links ]
18. Myint M, Schouten O, Bourke V, Thomas SD, Lennox AF, Varcoe RL. A Real-World Experience With the Supera Interwoven Nitinol Stent in Femoropopliteal Arteries: Midterm Patency Results and Failure Analysis. J Endovasc Ther. 2016;23:433-41. [ Links ]
19. Scheinert D, Grummt L, Piorkowski M, Sax J, Scheinert S, Ulrich M, et al. A novel self-expanding interwoven nitinol stent for complex femoropopliteal lesions: 24-month results of the SUPERA SFA registry. J Endovasc Ther. 2011;18:745-52. [ Links ]
20. Palena LM, Diaz-Sandoval LJ, Sultato E, Brigato C, Candeo A, Broc¬co E, et al. Feasibility and 1-Year outcomes of subintimal revascu¬larization with supera(R) stenting of long femoropopliteal occlu¬sions in critical limb ischemia: The "Supersub" Study. Catheter Cardiovasc Interv. 2016; [ Links ]
21. Werner M, Paetzold A, Banning-Eichenseer U, Scheinert S, Pior¬kowski M, Ulrich M, et al. Treatment of complex atherosclerotic femoropopliteal artery disease with a self-expanding interwo¬ven nitinol stent: midterm results from the Leipzig SUPERA 500 registry. EuroIntervention. 2014;10:861-8. [ Links ]
22. Duda SH, Bosiers M, Lammer J, Scheinert D, Zeller T, Oliva V, et al. Drug-eluting and bare nitinol stents for the treatment of athe¬rosclerotic lesions in the superficial femoral artery: long-term results from the SIROCCO trial. J Endovasc Ther. 2006;13:701-10. [ Links ]
23. Dake MD, Ansel GM, Jaff MR, Ohki T, Saxon RR, Smouse HB, et al. Paclitaxel-eluting stents show superiority to balloon angioplasty and bare metal stents in femoropopliteal disease: twelve-month Zilver PTX randomized study results. Circ Cardiovasc Interv. 2011;4:495-504. [ Links ]
24. Dake MD, Ansel GM, Jaff MR, Ohki T, Saxon RR, Smouse HB, et al. Durable Clinical Effectiveness With Paclitaxel-Eluting Stents in the Femoropopliteal Artery: 5-Year Results of the Zilver PTX Randomized Trial. Circulation. 2016;133:1472-83; discussion 83. [ Links ]
25. Muller-Hulsbeck S, Keirse K, Zeller T, Schroe H, Diaz-Cartelle J. Long-Term Results from the MAJESTIC Trial of the Eluvia Paclita¬xel-Eluting Stent for Femoropopliteal Treatment: 3-Year Follow¬-up. Cardiovasc Intervent Radiol. 2017;40:1832-8. [ Links ]
26. Hartung O, Otero A, Dubuc M, Boufi M, Barthelemy P, Aissi K, et al. Efficacy of Hemobahn in the treatment of superficial femo¬ral artery lesions in patients with acute or critical ischemia: a comparative study with claudicants. Eur J Vasc Endovasc Surg. 2005;30:300-6. [ Links ]
27. Mohr PJ, Oyama JK, Luu JT, Stinis CT. Clinical outcomes of endo¬vascular treatment of TASC-II C and D femoropopliteal lesions with the Viabahn endoprosthesis. Cardiovasc Revasc Med. 2015;16:465-8. [ Links ]
28. Kruse RR, Poelmann FB, Doomernik D, Burgerhof HG, Fritschy WM, Moll FL, et al. Five-Year Outcome of Self-Expanding Cove¬red Stents for Superficial Femoral Artery Occlusive Disease and an Analysis of Factors Predicting Failure. J Endovasc Ther. 2015;22:855-61. [ Links ]
29. Geraghty PJ, Mewissen MW, Jaff MR, Ansel GM, Investigators V. Three-year results of the VIBRANT trial of VIABAHN endoprosthe¬sis versus bare nitinol stent implantation for complex superficial femoral artery occlusive disease. J Vasc Surg. 2013;58:386-95 e4.
30. Lammer J, Zeller T, Hausegger KA, Schaefer PJ, Gschwendtner M, Mueller-Huelsbeck S, et al. Sustained benefit at 2 years for cove¬red stents versus bare-metal stents in long SFA lesions: the VIAS¬TAR trial. Cardiovasc Intervent Radiol. 2015;38:25-32. [ Links ]
31. Cioppa A, Stabile E, Popusoi G, Salemme L, Cota L, Pucciarelli A, et al. Combined treatment of heavy calcified femoro-popliteal lesions using directional atherectomy and a paclitaxel coated balloon: One-year single centre clinical results. Cardiovasc Revasc Med. 2012;13:219-23. [ Links ]
32. Roberts D, Niazi K, Miller W, Krishnan P, Gammon R, Schreiber T, et al. Effective endovascular treatment of calcified femoropopliteal disease with directional atherectomy and distal embolic protec¬tion: final results of the DEFINITIVE Ca(+)(+) trial. Catheter Cardio¬vasc Interv. 2014;84:236-44. [ Links ]
33. Zeller T, Langhoff R, Rocha-Singh KJ, Jaff MR, Blessing E, Amann¬-Vesti B, et al. Directional Atherectomy Followed by a Paclita¬xel-Coated Balloon to Inhibit Restenosis and Maintain Vessel Patency: Twelve-Month Results of the DEFINITIVE AR Study. Circ Cardiovasc Interv. 2017;10 [ Links ]
34. Ott I, Cassese S, Groha P, Steppich B, Hadamitzky M, Ibrahim T, et al. Randomized Comparison of Paclitaxel-Eluting Balloon and Stenting Versus Plain Balloon Plus Stenting Versus Directional Atherectomy for Femoral Artery Disease (ISAR-STATH). Circula¬tion. 2017;135:2218-26. [ Links ]
Correio eletrónico: marina_f_neto@hotmail.com (M.Neto).
Recebido a 12 de junho de 2017
Aceite a 07 de maio de 2018














