Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc vol.16 no.2 Lisboa jun. 2020
ARTIGO ORIGINAL
Infeção de próteses vasculares - ainda uma entidade a temer?
Prosthetic vascular graft infection - still an entity to fear?
Pedro Lima1, Cândida G. Silva2,3,4, Luís Antunes1, Mário Moreira1, Mafalda Correia1, Joana Silva1,Anabela Gonçalves1, Óscar Gonçalves1
1 Serviço de Angiologia e Cirurgia Vascular, Centro Hospitalar Universitário de Coimbra, Coimbra, Portugal
2 Escola Superior de Saúde, Politécnico de Leiria, Leiria, Portugal
3 Centro de Inovação em Tecnologias e Cuidados de Saúde, Politécnico de Leiria, Leiria, Portugal
4 Centro de Química de Coimbra, Universidade de Coimbra, Coimbra, Portugal
Endereço para correspondência | Dirección para correspondencia | Correspondence
RESUMO
Introdução: A evolução na técnica de assepsia e antibioterapia profilática tem mantido a incidência de infeção de próteses vasculares (IPV) baixa. No entanto, uma proporção de doentes ainda se encontra suscetível a uma patologia que coloca em risco a função do enxerto e do órgão-alvo perfundido, enquanto ameaça com complicações sépticas a vida de cada um dos afetados.
A abordagem das IPV depende da manifestação da infeção e do microrganismo em questão, da topografia da prótese infetada e do estado geral do doente.
Desde explantação total da prótese até antibioterapia prolongada são várias as estratégias terapêuticas, cabendo ao cirurgião avaliar qual contribuirá para uma evolução natural mais favorável para o doente.
Com este trabalho, os autores propõem-se a caracterizar clinicamente a população de doentes com IPV, no seu centro hospitalar.
Métodos: Usando o sistema informático hospitalar, foram colhidas as cartas de alta relativas ao Serviço de Cirurgia Vascular, entre os anos 2000-2018, com as palavras-chave “infeção” e “prótese”. Foram excluídos todas as infeções não relacionadas, infeções de próteses para acessos de diálise e os doentes cujos processos não tinham informação relativamente ao procedimento de implantação do enxerto.
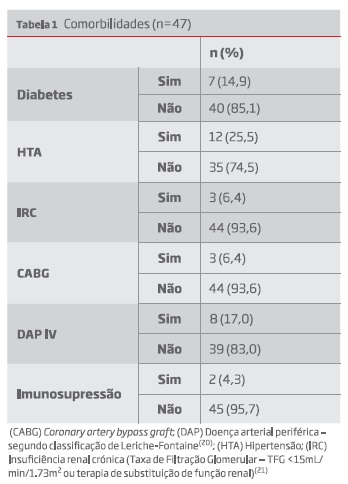
Resultados: Foram incluídos 47 processos de doentes entre os 46 e 84 anos (média 69 anos), 89% do sexo masculino. Apenas 15% eram diabéticos e apenas 2 doentes se encontravam sob imunossupressão.
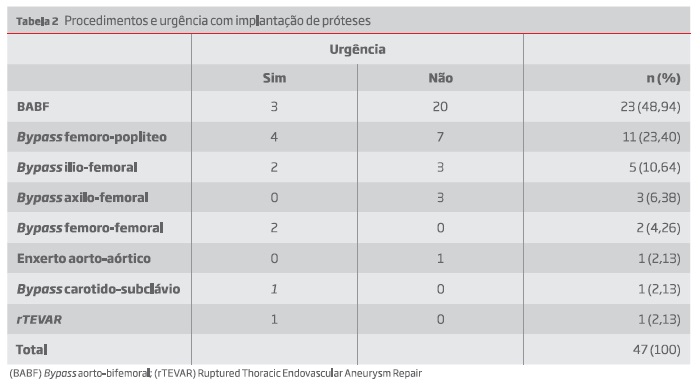
Cerca de 51% das próteses infetadas foram de enxertos aorto-bifemorais e os restantes relativos a procedimentos periféricos. Na casuística verificada, 13 das próteses infetadas foram colocadas em regime de urgência.
As infeções tardias (>4 meses) assumem a maioria dos casos (70%). Os agentes gram-positivos foram os agentes mais frequentemente observados (50% dos quais o MRSA).
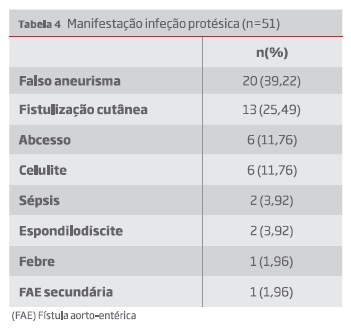
A apresentação mais comum foi o aparecimento de falsos aneurismas anastomóticos e apenas 25% das próteses infetadas se encontravam ocluídas.
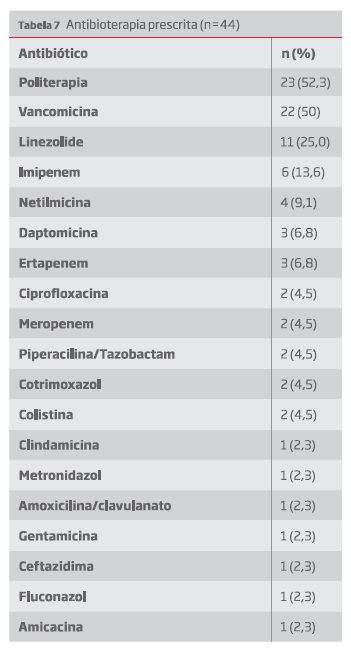
A antibioterapia mais usada foram combinações incluindo Vancomicina, com duração entre as 1 e as 12 semanas.
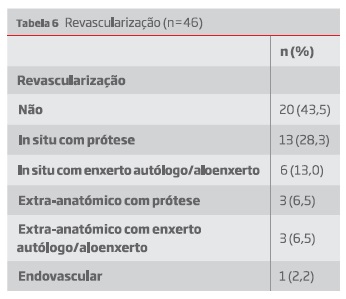
Em 85% dos doentes foi removido o enxerto. Destes, 57% foram revascularizados.
O follow up foi heterogéneo com uma média de 26,5 meses.
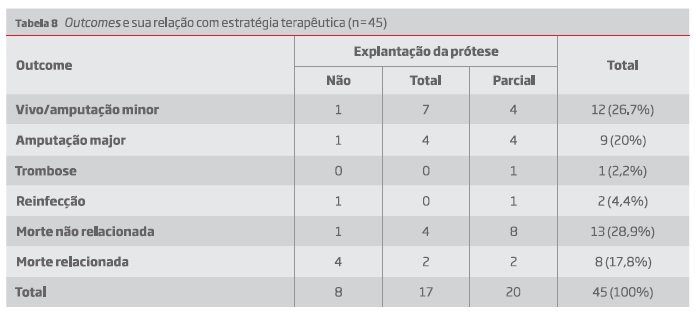
Como outcome, de referir 20% dos doentes submetidos a amputação major, 18% com mortalidade atribuída a IPV e 29% com mortalidade global não relacionada.
Discussão: As IPV continuam a ser uma patologia desafiante, não só pelas consequências sépticas ou da isquemia de órgão-alvo, mas também pelo enquadramento dos doentes que são afetados.
A crescente prevalência de agentes multirresistentes numa população cada vez mais envelhecida gera a necessidade de abordar esta patologia de uma forma multidisciplinar.
A incidência IPV envolvendo a Aorta, e a exigência técnica de uma cirurgia major com impacto hemodinâmico, particularmente em infeções por agentes de reduzida virulência, pode obrigar a adequar as estratégias terapêuticas em doentes que não sejam aptos para cirurgia. No entanto, um tratamento conservador geralmente está associado a recorrência da infeção ou a possíveis complicações de uma infeção latente.
Conclusão: É necessária uma abordagem multidisciplinar, com diagnóstico sensível e precoce, e um equilíbrio entre o local e agressividade da infeção ao contexto clínico de cada doente de forma a otimizar os resultados.
Palavras-chave: Infeção protésica; Infeção vascular
ABSTRACT
Introduction: The evolution on aseptic technique and prophylactic antibiotherapy has been keeping a low incidence of prosthetic vascular graft infections (PVGI). However some patients are still at risk of a disease that compromises the graft function and the viability of the perfused organ, while threatening each individual with septic complications.
The management of PVGI depends on the severity of infection, the culprit microorganism, the location of the infected prosthesis and the patient's overall status.
Several treatment strategies are available, from radical explantation to graft preservation techniques and chronic antibiotherapy. The surgeon should then decide which leads to a better quality of life-adjusted outcome.
The authors intend to present a clinical profile on the population with PVGI of their institution.
Methods: Using the institution own system, all the discharge papers from in-hospital episodes concerning the department of Vascular Surgery, between 2000 and 2018, which mentioned the words “infection” and “graft”, were collected. All documents referring to non-related infections and vascular access graft infections were excluded. Also, documents failing to report essential data were excluded.
Results: A total of 47 patients were included, aged between 46 and 84 years old (median 69 years), 89% male. Only 15% had diabetes and 2 patients were under immunosuppression.
About half of all cases were aortobifemoral infected grafts. 13 cases had had urgent surgeries when the prosthesis were implanted.
Late infections were more common than early ones, and more frequently infected by Gram positive bacteria.
The anastomotic pseudoaneurysms were the most frequently seen presentations. Only 25% of the infected grafts were occluded.
Antibiotic combinations using vancomycin were the most used, for 1 to 12 weeks in duration.
Removal of the graft was performed in 85% of patients, of which 57% were submitted to revascularization procedures.
Follow up was heterogeneously reported with a median duration of 26,5 months.
During follow up, 20% of patients were submitted to major amputation, 18% died from complications related to the infected graft and in 29% a non-related mortality was reported.
Discussion: There remains a challenge to approach PVGI, not only because the frailty of the individuals affected but also because the multisystemic implications of a vascular infection.
The growing prevalence of multidrug resistant bacteria in an older population mandates the need to consider multidisciplinarity.
PVGI affecting the Aorta by low-virulence bacteria and the demanding surgery for graft explantation with hemodynamic impact is a scenario that may force to change the therapeutic strategies in patients who are not fit for surgery. However, graft-preserving strategies are associated to infection recurrence and poorer outcomes.
Conclusion: A multidisciplinary approach, sensitive and early diagnosis, and a sensible balance between the infection aggressiveness and the overall status of each patient, are needed for optimal outcomes.
Keywords: Vascular grafting; Infection
Introdução
A melhoria das técnicas de assepsia, a aplicação de antibioterapia na profilaxia cirúrgica e da evolução das técnicas cirúrgicas, a prevalência de infeções vasculares protésicas (IPV) tem vindo a decrescer. No entanto, o aumento da esperança média de vida e o uso crescente de próteses vasculares deixam ainda uma proporção de doentes em risco de uma patologia que ameaça o órgão-alvo perfundido e a própria vida de cada um dos afetados.
Estão descritas incidências até 5% em âmbito de cirurgia clássica, sendo raras as infeções de endopróteses cuja frequência ronda os 0.4%(1).
São mais frequentes as infeções de próteses anastomosadas à artéria femoral, tunelizadas em trajeto subcutâneo e colocadas em contextos de urgência(2, 3).
O sucesso na abordagem da infeção protésica depende do diagnóstico precoce com identificação do agente, do correto estadiamento da gravidade da infeção e extensão do material afetado, do uso de antibioterapia dirigida, da remoção parcial ou total da prótese e da adequada revascularização do tecido-alvo.
O conhecimento da história natural das infeções protésicas de cada instituição é de extrema importância para aplicação de medidas que levem a otimização de protocolos de abordagem. Desta forma, os autores propõem apresentar uma caracterização clínica dos casos da sua instituição.
Materiais e métodos
Foram analisados os processos clínicos de todos os doentes internados no serviço de Cirurgia Vascular cujas cartas de alta mencionavam as palavras “infeção” e “prótese” entre os anos 2000 e 2018. Foram obtidos 140 processos, dos quais excluídos 31 por descreverem infeções não relacionadas, 59 por infeções de próteses para acessos de diálise e 3 por ausência de dados essenciais.
Foram assim incluídos 47 casos.
A caracterização da amostra foi realizada utilizando várias medidas de estatística descritiva. Em particular, através da determinação dos parâmetros de tendência central e de dispersão, para as variáveis quantitativas (idade, tempo de infeção, tempo de follow-up). Para as restantes variáveis foi realizado o cálculo de frequências simples e relativas.
As relações entre variáveis grupo etário (d 65 anos; >65 anos) e tempo de infeção, explantação da prótese e outcome, e microrganismo e outcome foram analisadas através da construção de tabelas de contingência. A correlação entre as variáveis idade e tempo de infeção foi avaliada recorrendo ao coeficiente de correlação de Pearson (r).
O teste não paramétrico de Mann-Whitney foi utilizado para verificar se existem diferenças significativas no tempo de infeção de próteses entre doentes urgentes e doentes eletivos. O teste de Kruskal-Wallis foi utilizado para averiguar se existem diferenças significativas entre o tempo de infeção de próteses entre grupos de doentes com os vários de tipos de infeção de prótese (Bunt's Modified Classification)(4). Para estas análises foram utilizados testes não paramétricos, uma vez que o teste de Shapiro-Wilk demonstrou não se verificar o pressuposto da normalidade da distribuição dos dados, necessário para aplicação de testes paramétricos. O teste exato de Fisher foi utilizado para verificar independência das variáveis explantação da prótese e outcome, e grupo etário (d 65 anos; >65 anos) e tempo de infeção (precoce: d 4 meses; tardia: > 4 meses).
O valor preditivo da variável idade para o tempo de infeção foi avaliado através da construção de curvas ROC e do cálculo da área abaixo da curva ROC.
A análise estatística foi realizada em IBM SPSS® Statistics version 25 for Windows, utilizando um nível de significância estatística ± = 0,05.
Resultados
Os doentes incluídos apresentavam uma idade média de 69,15 anos (DP 8,23; Mín 48; Máx 84) e 89,4% eram do sexo masculino.
As comorbilidades analisadas são descritas na tabela 1.
Os episódios de implantação de prótese foram eletivos em 71,7% dos casos (33/47) enquanto em apenas 13 foram colocadas de forma urgente. Os procedimentos nos quais foram usadas os diferentes materiais e a sua caracterização como urgentes ou programados estão descritos na tabela 2.
(clique para ampliar ! click to enlarge)
A maioria das próteses usadas foi de Tereftalato de polietileno (Dacron") assumindo uma proporção de 53,2%, sendo os restantes (44,7%) referentes a enxertos de PTFE. Apenas em 1 caso se verificou infecção de uma endoprótese Zenith Alpha".
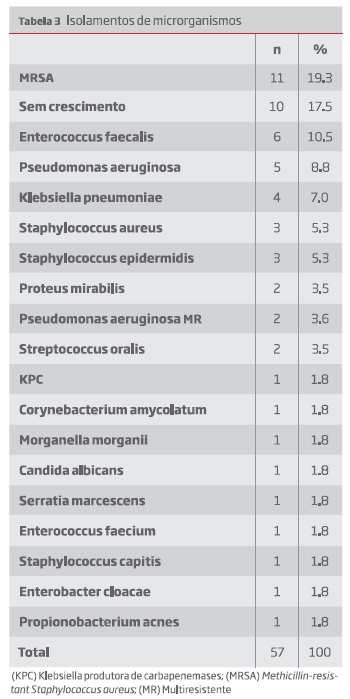
Foi possível obter informação quanto ao timing da infeção em 46 dos 47 doentes. O diagnóstico foi feito em média aos 54,91 meses (desvio-padrão 59,82; mín. 0,48; máx. 192). Os microrganismos encontrados descrevem-se na tabela 3.
As apresentações clínicas foram listadas na tabela 4. Posteriormente foram distribuídas segundo a classificação modificada de Bunt (tabela 5).

(clique para ampliar ! click to enlarge)
Após o diagnóstico de infeção, estavam patentes as próteses de 35 doentes (74,5%).
Foi removido totalmente o enxerto em 18 doentes (39,1%), parcialmente em 21 doentes (45,7%). Neste último grupo, houve a necessidade na preservação de pequenos cotos de prótese em territórios anastomóticos, ou decisão de exérese de uma das patas ilíacas em enxertos aorto-bifemorais preservando os restantes segmentos. Esta decisão surgiu em casos cuja integridade das próteses aparentava estar corrompida apenas no segmento removido.
As estratégias de revascularização foram descritas em 46 dos casos, listadas na tabela 6.
Os 20 doentes que não foram revascularizados incluem aqueles cuja prótese estava permeável e foi optada uma terapia conservadora, e aqueles cuja prótese foi removida mas se optou por não revascularizar. Neste último grupo, contando com 13 doentes, 7 apresentavam já uma prótese previamente ocluída, sendo que apenas 1 doente foi amputado. Dos restantes 5 doentes com próteses funcionais, 2 desenvolveram isquemia crítica com necessidade de amputação major.
Os antibióticos prescritos estão representados na tabela 7. A duração de antibioterapia foi em média 2,77 ± 2,69 semanas (mín.1; máx. 12). Especificamente nos casos descritos como “politerapia”,estes doentes foram submetidos a combinações variáveis dos fármacos descritos na tabela. Geralmente com associação de Vancomicina ou Linezolide e antibióticos com cobertura para agentes Gram negativos.
Obtiveram-se dados de follow-up em 45 doentes, com uma média 26,51 ± 31,96 meses (mín 0; máx. 144). Os outcomes registados e a sua relação com a estratégia terapêutica utilizada encontram-se descritos na tabela 8.
Adicionalmente foi observada uma associação estatisticamente significativa entre a ocorrência de infeções precoces em doentes que foram submetidos a colocação de um enxerto protésico de forma urgente (p=0.008).
Foram mais precoces as infeções em indivíduos que se integravam na classificação P1 da Bunt's Modified Classification (próteses cuja totalidade do trajeto se encontra em posição não cavitária) comparando com os outros grupos da mesma classificação. Esta diferença foi estatisticamente significativa (p=0.001). No entanto, os grupos P1 e P2 (enxertos com abordagens femorais) não apresentaram diferenças comparando com os restantes (p=0.701)
Na população que foi analisada, não se encontrou associação entre a probabilidade de infeção precoce nos doentes com idade mais avançada (>65 anos).
Não foram encontradas associações com relevância estatística entre o outcome e os microrganismos isolados, nem com as diferentes atitudes face a explantação ou conservação das próteses infetadas.
Discussão
Apesar de a metodologia adotada não ter permitido calcular incidências globais de infeção protésica por não ter sido possível obter dados quanto ao total de próteses utilizadas, a presença de apenas 47 doentes num intervalo temporal de 18 anos sugere uma incidência reduzida.
É descrito na literatura que a abordagem femoral agrega um conjunto de fatores de risco para infeção protésica(2, 5, 6). Grupos ganglionares com proximidade ao enxerto, poderão ser fonte de inoculação bacteriana com a manipulação cirúrgica(2). Do mesmo modo, este tipo de abordagem é mais suscetível a complicações locais como seroma, hematoma ou necrose da gordura subcutânea, levando a que um inóculo bacteriano mais reduzido seja suficiente para causar uma infeção da ferida cirúrgica(7).
Na nossa amostra verificaram-se em maior número as infeções do grupo P2 mas foram as próteses não cavitárias que infetaram mais cedo. É sugerido pelos resultados que o menor tempo até à ocorrência de infeção neste último grupo, foi independente da necessidade de abordagens femorais. Uma maior proporção de procedimentos urgentes no grupo P1 poderá ter introduzido um viés nessa conclusão.
Embora apenas 28% dos procedimentos da nossa casuística terem sido realizados de forma urgente, a relevância estatística que foi verificada para a incidência de infeções precoces, parece sugerir que a patologia vascular aguda é um fator de risco para estes eventos.
A maior incidência de infecções em cirurgias urgentes poderá ser o reflexo da quebra de protocolos de assepsia, mas também da escassez de tempo em otimizar patologias que aumentam a possibilidade de infeção da ferida cirúrgica. São exemplos, a desnutrição, doença renal crónica e diabetes mellitus(8-10).
Em concordância com a literatura, as estirpes de Staphylococcus aureus assumem a maioria dos organismos identificados(11) e a proporção de resistência à meticilina é elevada. Reinternamentos ou doentes institucionalizados, diabéticos ou dialisados poderão justificar esta presença de MRSA mas não temos dados que suportem essa observação.
A infecção por MRSA tem sido relacionada a piores resultados dada a alta virulência da bactéria associada a maior incidência em doentes mais frágeis(12). No entanto, na nossa amostra não se verificaram piores outcomes nas infeções por estes agentes.
As culturas sem crescimento bacteriano, que representam cerca de 18% dos casos da nossa amostra, são descritas na literatura como possíveis falsos negativos pela dificuldade inerente em isolar microrganismos embutidos em biofilmes(13). Estas bactérias em particular têm um metabolismo lento, que contribui para mais um fator de resistência a bacteriostáticos(14).
Assim, torna-se necessária a escolha de associações de fármacos agressivos na eliminação de agentes Gram positivos e com capacidade na penetração do biofilme. Estudos in vitro mostram que a utilização de daptomicina parece promissora pela capacidade de esterilização de próteses(14, 15). No entanto, esta hipótese não pode ser corroborada pelo presente trabalho, tendo em conta o escasso número de doentes medicados com esse fármaco.
A exérese de próteses infetadas é a pedra basilar do tratamento desta patologia, particularmente em casos com manifestações de infeção invasiva ou sistémica e provocada por agentes de alta virulência, como os Gram negativos. Por outro lado, em infeções latentes em topografias não cavitárias, sem envolvimento das anastomoses ou em doentes com reduzida reserva fisiológica, parece ser legítimo recorrer a técnicas conservadoras(16-19).
Sendo descritos na literatura piores resultados em doentes cujo enxerto infetado foi preservado, tal não se verificou no nosso trabalho. Uma amostra reduzida poderá ter sido a principal limitação a essa observação.
Conclusão
Apesar de existir uma tendência para observar maiores taxas de sobrevivência em casos de explantação completa de uma prótese vascular infetada, a abordagem desta patologia deve ser feita individualmente.
Devem ser considerados o estado de cada doente e a sua capacidade funcional, o tipo de infeção e de microrganismo, as características anatómicas do segmento infetado e a morbilidade associada a eventuais cirurgias major.
Enquanto não existem guidelines que ajudem na tomada de decisões, prevalece a razoabilidade do cirurgião.
BIBLIOGRAFIA
1. E. Ducasse, C. Annalisa, F. Speziale e e. al, “Aortoiliac Stent Graft Infection: Current Problems and Management,” Annals of Vascular Surgery, pp. 521-526, 2004.
2. J. Goldstone e W. Moore, “Infection in Vascular Prostheses,” American Journal of Surgery, pp. 225-233, 1974.
3. J. Durham, J. Malone e B. V., “The impact of multiple operations on the importance of arterial wall cultures,” Journal of Vascular Surgery, pp. 160-169, 1987.
4. T. Bunt, “Synthetic vascular graft infections,” Surgery, 1988.
5. J. Sousa, L. Antunes, C. Mendes e e. al., “Prosthetic vascular graft infection: a center experience,” Angiologia e Cirurgia Vascular, pp. 52-57, 2014.
6. L. Pounds, M. Montes-Walters, C. Mayhall e e. al., “A changing pattern of infection after major vascular reconstructions,” Vascular and Endovascular Surgery, pp. 511-517, 2005.
7. D. Bandyk, “Vascular Surgical Site Infection: Risk Factors and Preventive Measures,” Seminars in Vascular Surgery, pp. 119-123, 2008.
8. A. Gharamti e Z. Kanafani, “Vascular Graft Infections,” Infectious Disease Clinics of North America, 2018.
9. K. Ban, J. Minei, C. Laronga e e. al., “American College of Surgeons and Surgical Infection Society: Surgical Site Infection Guidelines, 2016 Update,” Journal of American College of Surgeons, pp. 59-74, 2016.
10. L. Neumayer, P. Hosokawa, K. Itani e e. al., “Multivariable Predictors of Postoperative Surgical Site Infection after General and Vascular Surgery: Resulta from the Patient Safety in Surgery Study.,” Journal of American College of Surgeons, pp. 1178-1187, 2007.
11. W. Wilson, T. Bower, M. Creager e e. al, “Vascular Graft Infections, Mycotic Aneurysms, and Endovascular Infections: A Scientific Statement From the American Heart Association.,” Circulation, pp. e412-e460, 2016.
12. A. Nasim, M. Thompson, A. Naylor e e. al., “The Impact of MRSA on Vascular Surgery,” European Journal of Vascular and Endovascular Surgery, vol. 22, pp. 211-214, 2001.
13. T. Bergamini, D. Bandyk, D. Govostis e e. al., “Identification of Staphylococcus epidermidis vascular graft infections: a comparison of culture techniques,” Journal of Vascular Surgery, pp. 665-70, 1989.
14. M. Revest, F. Camou, E. Senneville, J. Caillon, B. Calvet e e. al, “Medical Treatment of prosthetic vascular graft infections: Review of the literature and proposals of a Working Group,” International Journal of Antimicrobial Agents, pp. 254-265, 2015.
15. P. Stewart, D. W. e S. J., “Daptomycin rapidly penetrates a Staphylococcus epidermidis biofilm,” Antimicrobial agents and chemotherapy, pp. 3505-7, 2009.
16. A. N. Sidawy e B. A. Perler, “Graft Infection,” em Rutherford's Vascular Surgery and Endovascular Therapy, Elsevier, 2019, pp. 588-602.
17. K. Calligaro, F. Veith, M. Schwartz e e. al., “Selective preservation of infected prosthetic arterial grafts. Analysis of a 20-year experience with 120 extracavitary-infected grafts,” Annals of Surgery, pp. 461-9, 1994.
18. K. Calligaro, F. Veith, J. Yuan e e. al., “Intra-abdominal aortic graft infection: complete or partial graft preservation in patients at very high risk.,” Journal of Vascular Surgery, pp. 1199-205, 2003.
19. A. Kilic, D. Arnaoutakis, T. Reifsnyder e e. al., “Management of infected vascular grafts,” Vascular Medicine, pp. 53-60, 2016.
20. R. Fontaine, M. Kim e R. Kieny, “Surgical Treatment of Peripheral Circulation Disorders,” Helvetica Chirurgica Acta, pp. 499-533, 1954.
21. “Definition and Classification of CKD,” Kidney International Supplements, pp. 19-62, 2011.
22. M. Shenouda, E. Molena, N. Maftei e T. Ali, “Remnant prosthetic graft in revision or limb-salvage surgery: routine complete excision?,” Annals of Vascular Surgery, pp. e11-5, 2014.
23. W. Moore, J. Malone e K. K., “Prosthetic arterial graft material. Influence on neointimal healing and bacteremic infectibility,” Archives of Surgery, pp. 1379-1383, 1980.
Endereço para correspondência | Dirección para correspondencia | Correspondence
Correio eletrónico: Pedro_lima20@hotmail.com (P. Lima).
Agradecimentos
Deixo um agradecimento à Drª Marisa Caetano, do departamento de Farmacologia Clínica do Centro Hospitalar Universitário de Coimbra pela disponibilidade na revisão dos dados referentes a antibioterapia.
Recebido a 15 de junho de 2019. Aceite a 21 de maio de 2020