INTRODUÇÃO
A dermatoscopia constitui uma ferramenta útil para o diagnóstico e seguimento de diversas lesões cutâneas. Trata-se de uma técnica não-invasiva, rápida e indolor, pelo que é facilmente aceite pelos doentes pediátricos, poupando-os a biópsias e tratamentos desnecessários.1 Neste artigo, destacamos a importância da dermatoscopia para avaliação de dermatoses infeciosas e inflamatórias na idade pediátrica.
1. Dermatoses infeciosas
1.1. Escabiose
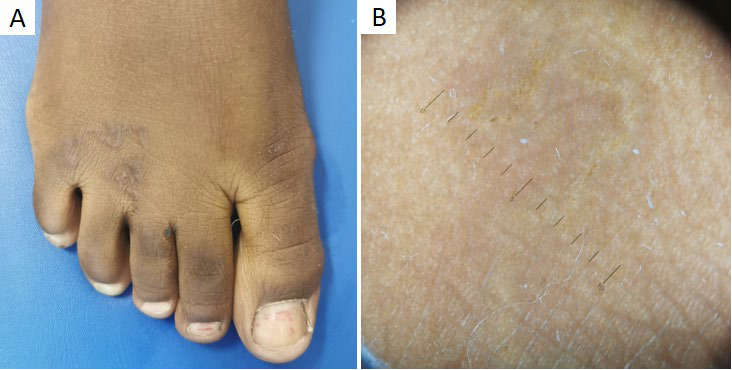
A escabiose é uma infestação cutânea altamente contagiosa, provocada pelo ácaro Sarcoptes scabiei var. hominis, e cuja prevalência mundial está estimada em 300 milhões de casos.2 Geralmente, os doentes têm prurido intenso com agravamento noturno e as lesões primárias consistem em pequenas pápulas eritematosas e sulcos acarinos (Fig.s 1a,b).1
Nas crianças pequenas, a cabeça, palmas e plantas, habitualmente poupadas nos adultos, estão geralmente afetadas. 2 Nesta faixa etária as lesões são mais inflamatórias, observando-se com maior frequência vesico-pústulas.3
O diagnóstico é fundamentalmente clínico, no entanto, a apresentação pode ser atípica e mimetizar outras dermatoses.1 Desta forma, a identificação microscópica dos ácaros, ovos ou fezes, após raspado cutâneo, pode confirmar o diagnóstico.4 Apesar do raspado cutâneo ser um procedimento simples, este pode causar ansiedade e desconforto nos doentes mais novos.2 Por outro lado, a dermatoscopia (Fig. 1c) permite, inclusivamente com baixa ampliação, a identificação do parasita (sinal da “asa-delta”) e das suas galerias (padrão em “rasto de avião”), de forma não invasiva.1 O primeiro surge como uma estrutura triangular acastanhada, correspondendo à superfície anterior do ácaro (gnatossoma
e patas anteriores), no final de um segmento linear esbranquiçado, o sulco acarino.1 Os mesmos aspetos foram descritos na escabiose nodular5,6(Fig.s 1d,e), incluindo casos neonatais. Na sarna crostosa, foi recentemente descrito um
novo sinal dermatoscópico (“noodle sign”), que representa sulcos acarinos agrupados.7
Estudos prospetivos verificaram que a dermatoscopia manual tem uma sensibilidade igual ou superior (83% - 91%) ao exame microscópico convencional (68% - 90%), permitindo também aumentar a acurácia deste último.8 Contudo, tem uma menor especificidade (46% - 86%), em comparação com o raspado cutâneo (que é por definição 100%), sendo, por vezes, difícil distinguir o sinal “rasto de avião” de artefactos, como escoriações.8
A videodermatoscopia, com maior capacidade de ampliação, proporciona ainda uma sensibilidade e especificidade superior, permitindo observar a estrutura dos ácaros com maior detalhe, os ovos, as fezes e, em alguns casos, a migração dos ácaros dentro das galerias.2,8As fezes surgem como pequenos pontos castanhos ou esbranquiçados, enquanto os ovos apresentam-se como estruturas ovais translúcidas, semelhantes a um colar de pérolas.2,9
A dermatoscopia também é útil para avaliar a resposta ao tratamento. Cerca de duas semanas após a terapêutica escabicida, os ácaros começam a decompor-se e a sua aparência torna-se desfocada e indistinta à dermatoscopia.1 Além disso, a incapacidade de deteção do sinal da “asa-delta” em toda a superfície cutânea pode traduzir a eficácia do tratamento.4
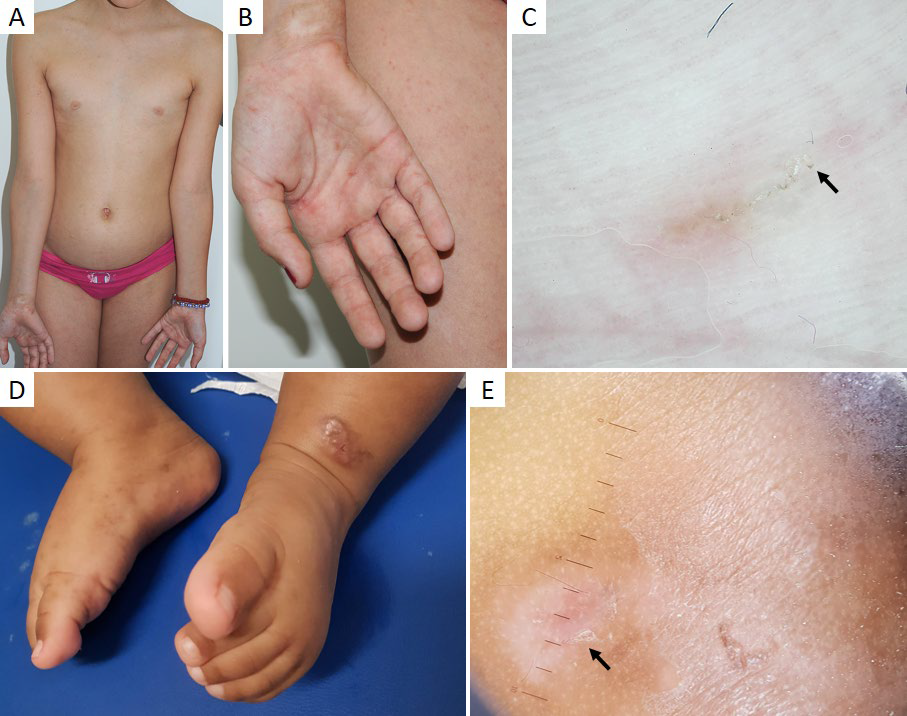
Figura 1 Escabiose. (A) Criança de 9 anos com múltiplas pápulas eritematosas disseminadas pelo tronco e membros. (B) Pormenor das pápulas e sulcos acarinos na palma direita. (C) Dermatoscopia: segmento linear esbranquiçado, bem definido, com estrutura triangular acastanhada na extremidade (seta preta), correspondendo à galeria e ácaro, respetivamente. (D) Escabiose nodular em lactente de 6 meses. (E) Dermatoscopia: sinal “rasto de avião” (seta preta)
1.2. Pediculose do couro cabeludo
A pediculose do couro cabeludo é uma infestação causada pelo ectoparasita Pediculus humanus capitis.10 A prevalência é variável, desde 1% a 20%, surgindo preferencialmente nas crianças entre os 3 e 12 anos.10 Apesar do piolho adulto nem sempre ser identificado, pela sua cor translúcida e movimentos rápidos, o diagnóstico pode ser confirmado pela observação das lêndeas aderentes à haste capilar.1 Contudo, as escamas na dermite seborreica e noutras dermatoses descamativas do couro cabeludo, bem como resquícios de cosméticos, podem ser confundidos com as lêndeas.4 Com a dermatoscopia é possível diferenciá-los e monitorizar a resposta ao tratamento, distinguindo as lêndeas contendo ninfas viáveis das vazias. Na dermatoscopia, as lêndeas com ninfas (Fig. 2a) têm uma cor castanha e formato ovóide, enquanto as vazias (Fig. 2b) são translúcidas e têm uma extremidade livre aplanada, por vezes fissurada.4,10Algumas contêm ninfas mortas, que surgem como uma área castanha focal num fundo translúcido.1 Por outro lado, as pseudo-lêndeas destacam-se facilmente da haste capilar e na dermatoscopia caraterizam-se por estruturas esbranquiçadas e amorfas.4
1.3. Larva migrans
A larva migrans cutânea é uma dermatose parasitária, auto-limitada, que resulta da invasão e migração de larvas de nemátodes (Ancylostoma braziliense, Ancylostoma caninum, Uncinaria stenocephala, entre outros) na pele.11 A infestação adquirida por contacto com solos contaminados com excrementos de animais infetados e é típica de países tropicais ou subtropicais.12 Clinicamente (Fig. 3a) carateriza-se por lesões pruriginosas, eritematosas, com trajeto serpiginoso ou linear, predominantemente localizadas nos pés.4,13As larvas não atravessam a membrana basal, ficando confinadas à epiderme, onde migram a uma velocidade de 2 a 5 cm por dia.14
Apesar das manifestações caraterísticas, os exames auxiliares de diagnóstico podem ser necessários em casos atípicos. Na biópsia cutânea, os achados são inespecíficos e a larva é raramente visualizada.14 A dermatoscopia (Fig. 3b) permite a identificação de áreas homogéneas amarelo-acastanhadas, translúcidas, com distribuição serpiginosa, correspondendo à larva, enquanto que os “túneis epidérmicos” produzidos por estas, apresentam vasos em ponto.4,12,13,15
1.4. Tinha do couro cabeludo
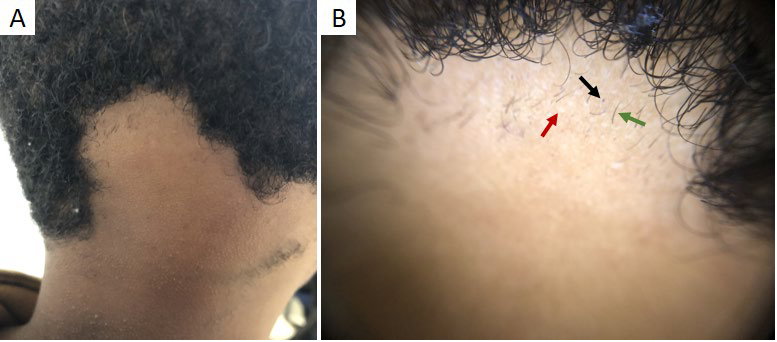
A tinha do couro cabeludo é a infeção fúngica por dermatofitos mais comum em idade pediátrica, afetando fundamentalmente crianças pré-púberes.16 A apresentação clínica é variável, podendo manifestar-se como uma dermatose não-inflamatória, com áreas de alopécia (Fig. 4a,b) e/ou placas descamativas, ou como uma doença inflamatória, com placas ou nódulos dolorosos e supurativos.17
Embora o exame microscópico direto e a cultura micológica sejam os exames de referência para o diagnóstico da tinha do couro cabeludo, a tricoscopia (Fig. 4c,d) possibilita a sua identificação e tratamento imediato.1,13,18Os achados dermatoscópicos mais frequentes e específicos consistem em cabelos em vírgula, saca-rolhas e código Morse.17-19Os cabelos em vírgula constituem hastes pilosas curtas, de espessura uniforme e curvas, podendo adquirir a forma de saca-rolhas em doentes de raça negra ou com cabelo encaracolado.17,19Estão associados tanto ao parasitismo endotrix, como ectotrix.1,18Nos cabelos em código Morse observam-se bandas transversais alternadas, esbranquiçadas e acastanhadas.17
Em grande ampliação (x100), as bandas mais claras surgem como espaços vazios, representando áreas de invasão fúngica, onde a haste é menos resistente e facilmente quebrável.17
Podem também ser observados cabelos em zigzag, caraterizados por hastes com sucessivas dobras em ângulo agudo.18
Verificou-se ainda que a associação entre descamação perifolicular com cabelo distrófico ou fragmentado pode representar um padrão específico da tinha do couro cabeludo.20
Outros achados inespecíficos incluem cabelos quebrados, pontos pretos e cabelos em tufos.21
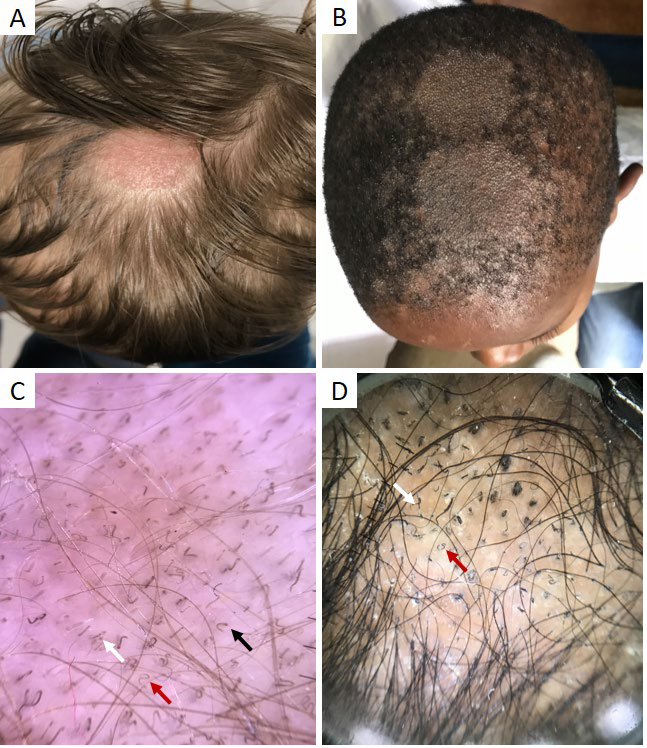
Figura 4 Tinha do couro cabeludo. (A) Área de alopécia na região parietal do couro cabeludo de criança de 5 anos com fototipo II (Microsporum canis). (B) Áreas circulares de alopécia com ligeira descamação em criança com fototipo de VI (cortesia de Prof. Dr.ª Margarida Gonçalo). (C, D) Dermatoscopia: cabelos em vírgula (seta preta), saca-rolhas (seta vermelha) e código Morse (seta branca)
1.5. Verrugas virais
As verrugas virais são proliferações epiteliais benignas da pele e das mucosas, resultantes da infeção pelo vírus do papiloma humano (HPV).22 As verrugas cutâneas são frequentes em idade escolar, com uma prevalência estimada entre 5% e 21,7%, enquanto as anogenitais são menos comuns, desconhecendo-se a prevalência exata na idade pediátrica.22
Nestas últimas, o abuso sexual deve ser excluído, contudo, as principais vias de transmissão nesta faixa etária são a perinatal e a auto ou hetero-inoculação.23,24De acordo com a sua localização anatómica e morfologia, as verrugas são classificadas em vulgares, plantares, planas e genitais ou condilomas. As verrugas têm uma aparência clínica distinta e são habitualmente diagnosticadas a olho nu. No entanto, a sua identificação pode ser difícil nos estadios iniciais e após tratamento.25 A dermatoscopia facilita o diagnóstico e os achados variam com o subtipo.4,13As verrugas vulgares (Fig. 5) exibem tipicamente múltiplas papilas centradas por um vaso (em ponto ou em gancho) circundado por um halo esbranquiçado (padrão “frogspawn”).13,25Os vasos trombosados surgem como glóbulos pretos e, por vezes, estão presentes pequenos pontos hemorrágicos.1,13
As verrugas plantares revelam, à dermatoscopia, áreas verrucosas amareladas, com múltiplos pontos e/ou estrias lineares, vermelhas ou pretas, irregularmente distribuídas, correspondendo a microhemorragias, potenciadas pela pressão exercida sobre a região plantar.4,13,22Estes aspetos permitem distinguir as verrugas das calosidades plantares, que não apresentam microhemorragias, mas exibem uma área homogénea central, avermelhada ou azulada.1 As verrugas plantares devem ainda ser diferenciadas do melanoma acral.13
A dermatoscopia das verrugas planas demonstra pequenos pontos vermelhos regularmente distribuídos num fundo castanho claro ou amarelo.22 Estes achados possibilitam a diferenciação com comedões ou foliculites, caraterizados por uma estrutura redonda central, branca ou amarela, que corresponde a um rolhão de queratina ou pus no infundíbulo.22
Nos condilomas acuminados, a dermatoscopia pode ser útil para distingui-los de patologias não infeciosas, como as pápulas peroladas do pénis, papilomatose vestibular e grânulos de Fordyce.22 O padrão em mosaico é o mais comum e consiste numa rede esbranquiçada que circunscreve áreas centradas por vasos em ponto ou glomerulares dilatados.26
Por vezes, os condilomas revelam múltiplas projeções esbranquiçadas e irregulares, contendo vasos alongados e dilatados, geralmente mais pronunciados à periferia.22,26
A dermatoscopia pode também avaliar a eficácia do tratamento das verrugas vulgares e plantares. O desaparecimento das microhemorragias e do padrão vascular pressupõe um baixo risco de recorrência.1
1.6. Molusco contagioso
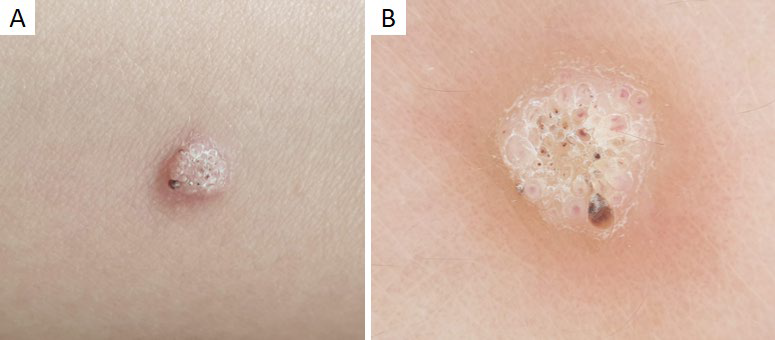
O molusco contagioso (MC) é uma infeção cutânea viral causada por um poxvirus.27 A sua incidência anual é de 2% a 20%, sendo muito comum na infância, principalmente entre os 2 e os 5 anos de idade.27,28Clinicamente (Fig.s 6a,b), manifesta-se por pequenas pápulas umbilicadas, de cor rosada ou branco pérola, únicas ou múltiplas.27 Embora a maioria das lesões de MC seja facilmente diagnosticada com base na sua apresentação clínica, algumas são indistinguíveis de quistos de milia, verrugas virais ou até de nevos de Spitz.1 A dermatoscopia pode ser útil ao demonstrar as caraterísticas típicas desta infeção. No molusco contagioso observa-se uma estrutura central redonda ou polilobulada, branca ou amarelada, circundada por uma coroa de vasos lineares e finos, por vezes ramificados, mas que não intersetam o centro27,29,30(Fig.s 6c,d). A estrutura central corresponde histologicamente à hiperplasia endofítica e lobular da epiderme, enquanto o padrão vascular pode ser explicado pela compressão e separação dos vasos pelos septos fibrosos.1 Por outro lado, as lesões irritadas ou traumatizadas estão frequentemente associadas a vasos punctiformes.29 Estão ainda descritas estruturas brancas com disposição circular, semelhantes a um trevo de quatro folhas, que podem ser observadas à luz polarizada.13,30
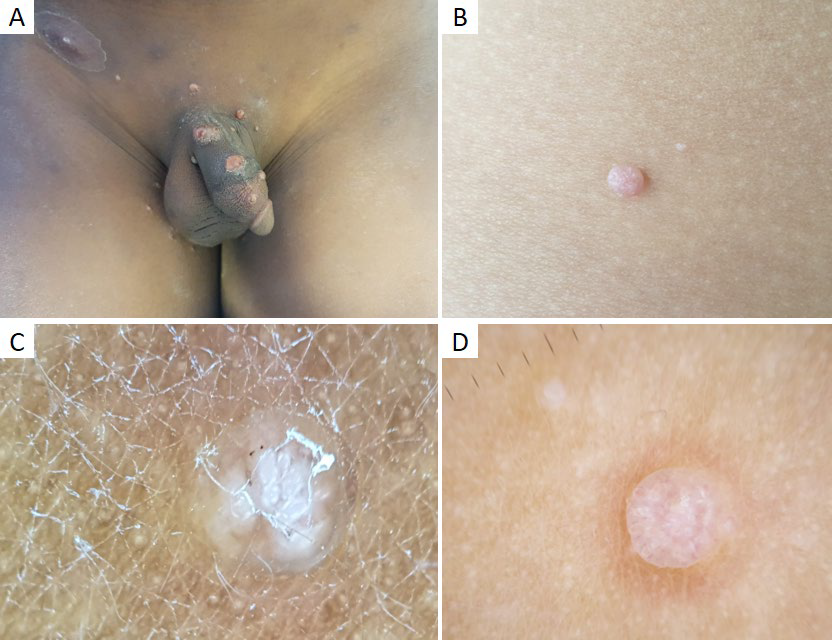
Figura 6 Molusco contagioso. (A) Múltiplas pápulas branco-rosadas com umbilicação central na região genital de criança de 8 anos, após contágio por auto-inoculação. (B) Pápula rosada umbilicada no braço direito de criança de 4 anos. Padrões dermatoscópicos do molusco contagioso: (C) Estrutura branca central polilobulada, com estruturas semelhantes a trevo de quatro folhas. (D) Estrutura branca polilobulada, circundada por vasos lineares e ramificados
2. Dermatoses inflamatórias
2.1. Psoríase
A psoríase é uma doença inflamatória crónica e imunologicamente mediada, que atinge cerca de 0,7% a 2% das crianças.31 Nesta faixa etária, a apresentação mais frequente é a psoríase em placas e o couro cabeludo é a principal área afetada.32 As lesões tendem a ser de menor espessura e dimensão em comparação com os adultos.31 Outras variantes comumente observadas na idade pediátrica são a psoríase gutata (Fig.s 7a,b) e inversa.31,32
O diagnóstico de psoríase nas crianças pode representar um desafio, especialmente nas formas localizadas (psoríase palmoplantar, genital, ou do couro cabeludo).19 Os principais diagnósticos diferenciais incluem a dermite atópica, a pitiríase rubra pilar, a pitiríase rosada, as dermatofitias e a dermite seborreica.31 O exame histopatológico, embora específico, raramente é realizado nas crianças devido ao seu caráter invasivo32
Por outro lado, vários estudos demonstraram a utilidade da dermatoscopia no diagnóstico da psoríase através da identificação de alterações específicas na microvasculatura cutânea, que se correlacionam com alterações histopatológicas precoces.19
A dermatoscopia com baixa ampliação (10x) mostra a presença de vasos em ponto ou glóbulos regularmente distribuídos num fundo vermelho claro.19,33Em maior ampliação (≥100x), os pontos/glóbulos vermelhos surgem como capilares dilatados e torcidos, descritos como “bushy” ou “basket-like”.33 Cada capilar mede cerca de 50 a 110 μm de diâmetro, sendo significativamente superior ao observado na pele sem lesões (15-25 μm).31 Os capilares “bushy-like” predominam no centro da lesão, enquanto na periferia observam-se ansas capilares alongadas, em forma de gancho, paralelas à superfície cutânea.33 Este padrão, quando distribuído uniformemente por toda a lesão, é caraterístico da psoríase e corresponde histologicamente aos capilares dilatados nas papilas dérmicas alongadas.31
O mesmo padrão vascular pode ser observado nas lesões localizadas no couro cabeludo, na região genital e nas palmas e plantas.33 Na psoríase palmoplantar, os capilares estão dispostos linearmente ao longo dos sulcos.33 De salientar que a hiperqueratose pode dificultar a visualização das alterações vasculares.31
Os pontos vermelhos e os capilares “bushy-like” podem ainda ser encontrados noutras dermatoses inflamatórias (p.e. eczema, pitiríase rósea, pitiríase rubra pilar), no entanto, de forma, muitas vezes, isolada e sem distribuição homogénea.32
Num estudo realizado por Lallas et al, verificou-se que a combinação de escamas brancas difusas com vasos em ponto com distribuição regular e sobre um fundo vermelho claro, permitiu o diagnóstico de psoríase em placas com uma sensibilidade de 84,9% e uma especificidade de 88,0%.33
Na psoríase ungueal, a dermatoscopia permite analisar com maior pormenor alterações da matriz (picotado) e do leito (onicólise, manchas salmão e hemorragias em estilhaço), assim como detetar alterações vasculares do hiponíquio e da prega ungueal proximal.34,35Na onicólise, a onicoscopia mostra um bordo vermelho-alaranjado em redor do descolamento e as manchas salmão têm forma e tamanho irregular, com cor vermelha ou alaranjada.35
A dermatoscopia tem sido também utilizada para monitorização terapêutica.1,33O diâmetro dos capilares “bushy-like” diminui com os tratamentos tópicos e sistémicos, e o aparecimento de pontos purpúricos foi descrito como um sinal de boa resposta aos agentes biológicos.33 Por outro lado, o uso excessivo de corticosteróides tópicos pode ser identificado pela observação de linhas vermelhas em redor e sobre as placas psoriáticas, tratando-se de um sinal de atrofia cutânea.33
2.2. Líquen plano
O líquen plano (LP) é uma dermatose inflamatória idiopática que além da pele, pode afetar as mucosas, folículos pilosos e unhas.36Surge geralmente na idade adulta, mas 0,1% a 10% dos casos correspondem a crianças.36 Nesta faixa etária, a apresentação clássica é a mais frequente, mas estão também descritas numerosas variantes, incluindo o LP agudo, hipertrófico, linear, anular, pigmentoso, actínico (Fig.s 8a,b), atrófico, erosivo, penfigóide e bolhoso.37-39O envolvimento da mucosa oral (4% - 39%), couro cabeludo (2% - 11,8%) e unhas (1,7% - 33,3%) é incomum.37
Nos casos com apresentação atípica, o exame histopatológico pode ser necessário para confirmar o diagnóstico. Porém, a dermatoscopia possibilita a identificação de estruturas que podem ser inaparentes a olho nu. As estrias de Wickham, patognomónicas, surgem como linhas branco-pérola, branco-azulado (especialmente em fototipos altos) ou amareladas, com várias morfologias, nomeadamente reticular (a mais comum), linear, anular, radial, foliácea (ramificações secundárias de uma estria central), e “em céu estrelado” (pontos brancos foliculares agrupados).36,40 As estrias correspondem à ortoqueratose compacta sobre a hipergranulose em “v”, estando normalmente presentes nas lesões ativas.1,36
Outros achados dermatoscópicos são: o fundo violáceo ou avermelhado; vasos em ponto ou lineares (correspondendo à dilatação dos vasos papilares e subpapilares, respetivamente), sobretudo na periferia das estrias, ou com padrão perifolicular ou difuso; pontos brancos/amarelos; e estruturas pigmentadas (pontos, glóbulos e áreas reticulares ou homogéneas).36
O padrão dermatoscópico varia com a evolução da doença. Nas lesões iniciais, observam-se estrias de Wickham subtis sobre um fundo avermelhado.36 Posteriormente, as estrias e os vasos tornam-se proeminentes, tendendo a desaparecer nas lesões em regressão.36 Nesta fase, predominam as estruturas pigmentadas com um padrão homogéneo ou granular.1,36 O padrão homogéneo castanho corresponde à incontinência pigmentar na derme e é geralmente transitório.1,36Por outro lado, o padrão granular, representado por múltiplos pontos e grânulos cinzentos ou acastanhados, correlaciona-se com a presença de melanófagos na derme e tende a ser mais persistente.1,36
Alguns subtipos do LP apresentam variações dermatoscópicas. O LP hipertrófico exibe pseudo-comedões preenchidos por rolhões de queratina amarela (“corn pearls”), que correspondem aos infundíbulos dilatados com ortoqueratose.36 No LP pigmentoso e actínico (Fig. 8c), as estrias e os vasos são menos frequentes, predominando as estruturas pigmentadas.36,41No LP agudo, as estrias também são incomuns, mas os vasos são proeminentes.41 O líquen plano pilar, raro na infância, demonstra descamação branca e eritema perifolicular, vasos arboriformes e áreas vermelho-leitoso cobertas por pontos brancos irregulares.37,38,40Quando há envolvimento das unhas, a onicoscopia facilita a visualização das fissuras longitudinais da lâmina ungueal.35
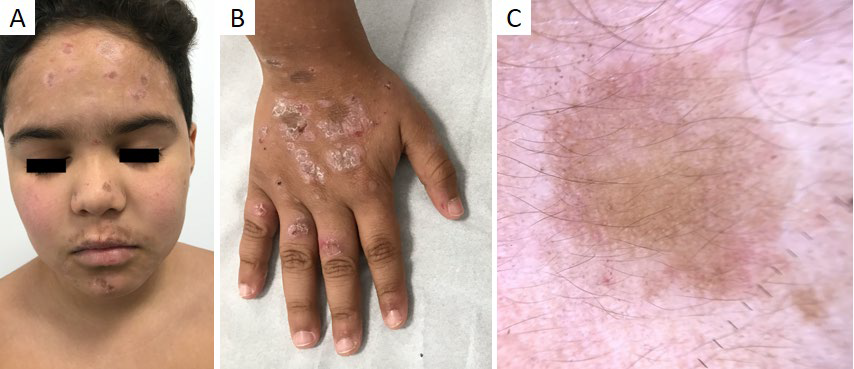
Figura 8 Líquen plano actínico (forma anular). Criança de 9 anos com múltiplas placas anulares com centro acastanhado atrófico e bordo eritemato-descamativo na face (A) antebraços e dorso das mãos (B). (C) Dermatoscopia: padrão homogéneo acastanhado, com escassas estrias de Wickham e grânulos castanhos na periferia
2.3. Dermatoses purpúricas pigmentadas
O líquen aureus (LA) e a púrpura anular telangiectásica de Majocchi (PATM) são dois subtipos incomuns de dermatoses purpúricas pigmentadas, que afetam predominantemente crianças, adolescentes ou adultos jovens.42
Clinicamente, o LA manifesta-se por máculas ou pápulas liquenóides, de coloração castanho-dourada a castanho-arroxeada, que coalescem em placas bem delimitadas, frequentemente solitárias e preferencialmente localizadas nas pernas.42,43A PATM carateriza-se por um número variável de placas eritematosas anulares, com petéquias e telangiectasias finas e curtas nos bordos, habitualmente simétricas e localizadas nas extremidades proximais dos membros inferiores.42 Ambas as dermatoses são assintomáticas ou levemente pruriginosas, e geralmente têm uma evolução crónica.42,43
O diagnóstico é clínico, podendo ser necessário exame histopatológico em caso de dúvida diagnóstica. Nos últimos anos, a dermatoscopia tem também auxiliado no seu diagnóstico diferencial. As dermatoses purpúricas pigmentadas apresentam achados dermatoscópicos semelhantes (Fig.s 9d,e), consistindo em pontos, glóbulos ou manchas, eritemato-purpúricos, não branqueáveis, arredondados ou irregulares, sobre um fundo vermelho-acastanhado ou vermelho-acobreado, correspondendo histologicamente à extravasão de eritrócitos e deposição de hemossiderina na derme papilar, respetivamente.19,42Este último aspeto dermatoscópico tende a ser difuso e proeminente no líquen aureus, e focal e subtil na PATM.2 Adicionalmente, na PATM podem observar-se telangiectasias, em virtude de um aumento pronunciado de vasos dilatados.42 Por outro lado, o LA pode mostrar pontos cinzentos e uma rede castanho-acinzentada, correspondendo a macrófagos repletos de hemossiderina na derme e a hiperpigmentação da camada basal com incontinência pigmentar na derme superior, respetivamente.42,43
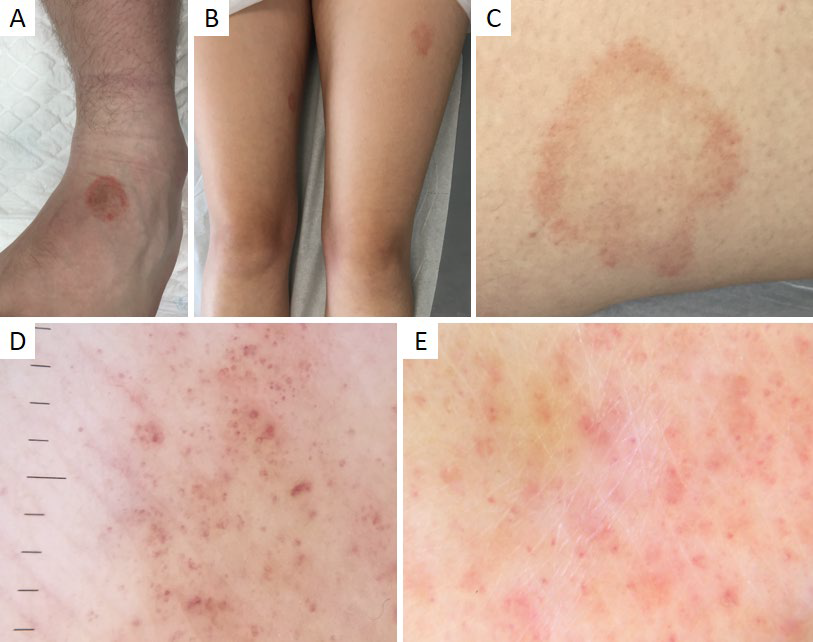
Figura 9 Dermatoses purpúricas pigmentadas. (A) Placa acobreada (líquen aureus) no dorso do pé esquerdo de adolescente de 17 anos. (B) Placa eritematosa (púrpura anular telangiectásica de Majocchi) na face externa da coxa esquerda de doente de 16 anos. (C) Pormenor da lesão anterior, com configuração anular. Dermatoscopia do líquen aureus (D) e da púrpura anular telangiectásica de Majocchi (E): pontos e glóbulos purpúricos num fundo vermelho-acastanhado, mais proeminente e difuso no líquen aureus
2.4. Alopécia areata
A alopécia areata é uma forma de alopécia não cicatricial, de etiologia autoimune, cuja evolução é imprevisível.44
Trata-se de uma patologia comum em idade pediátrica, com uma prevalência estimada de 0,63% nesta faixa etária, e que representa cerca de 20% de todos os casos de alopécia.45,46Carateriza-se tipicamente por áreas de alopécia ovaladas, bem circunscritas, com atingimento preferencial do couro cabeludo (Fig. 10a), mas que podem surgir em qualquer área pilosa.44
O diagnóstico baseia-se na observação clínica, no entanto, outras causas de alopécia podem apresentar manifestações semelhantes, como a tinha do couro cabeludo e tricotilomania.44A tricoscopia (Fig. 10b) pode ser útil quer para diagnóstico, quer para avaliação da atividade da doença.47 Os achados tricoscópicos mais comuns da alopécia areata nas crianças são os óstios foliculares vazios e os cabelos velus, observados em cerca de 80% e 70% dos casos, respetivamente.45
Os óstios amarelos na alopécia areata são abundantes e têm geralmente uma distribuição regular.44,45Contudo, são menos frequentes nas crianças em comparação com os adultos, sendo descritos em 40% a 100% dos doentes.45,47
Estes correspondem a orifícios foliculares dilatados preenchidos por rolhões de sebo e queratina, pelo que são raros nas crianças pequenas devido à baixa atividade das glândulas sebáceas.45,47Além disso, os óstios amarelos nas crianças são predominantemente amarelo-claros, ao passo que nos adultos são tipicamente amarelo-acastanhados.45
Outros achados observados são os óstios foliculares pretos, os cabelos quebrados, em ponto de exclamação, em cone e triangulares, e as constrições Pohl-Pinkus, que predominam na doença ativa.44,47Os óstios pretos correspondem a cabelos fraturados ao nível do couro cabeludo, e diferem dos visualizados na tinha do couro cabeludo e tricotilomania pela uniformidade no diâmetro e forma.47 Na tricotilomania observam-se também cabelos quebrados, mas com diferentes comprimentos, ao contrário da alopécia areata.18
Os cabelos em ponto de exclamação e em cone caraterizam-se por uma porção distal mais espessa e escura que a proximal.47 Os primeiros têm cerca de 1 a 5 mm comprimento, enquanto os últimos são mais longos, não se identificando a porção distal na dermatoscopia.47
Os cabelos triangulares, recentemente descritos, têm uma terminação pontiaguda e uma haste proximal oculta sob um véu branco-acinzentado.45 As constrições Pohl-Pinkus correspondem a áreas da haste capilar com espessura diminuída, que resultam da supressão repetida e de forma rápida da atividade metabólica e mitótica do folículo.47
A tricoscopia viabiliza ainda monitorizar a evolução da doença e sua resposta ao tratamento. Os cabelos velus e sua transformação em cabelos terminais, os cabelos em recrescimento e o sinal peripilar branco predominam na fase de remissão.47 Os cabelos em recrescimento (em círculo ou em crescimento vertical) são mais comuns nas crianças em comparação com os adultos, o que pode resultar de maior crescimento capilar, assim como de remissões espontâneas mais frequentes neste grupo.45,47
CONCLUSÃO
Os procedimentos de diagnóstico invasivos e/ou semi-invasivos são muitas vezes difíceis de realizar na população pediátrica. Desta forma, a dermatoscopia é uma técnica de imagem útil, fácil e rápida de utilizar na prática clínica, auxiliando o diagnóstico e permitindo o acompanhamento de uma variedade de dermatoses.