INTRODUÇÃO
A urticária crónica (UC) caracteriza-se pelo aparecimento de lesões de urticária, angioedema ou ambos, por um período superior a seis semanas. Pode dividir-se em UC indutível (UCI) quando são identificados fatores externos desencadeantes, ou em UC espontânea (UCE) quando não se encontra nenhum fator externo responsável.1 Afeta aproximadamente 1% da população mundial, representando a UCE cerca de dois terços desses casos. Portugal carece de dados concretos sobre a prevalência da UCE, mas, tal com noutros países, esta patologia tem maior incidência em mulheres e a idade média de aparecimento é 46,5 anos.2 Tem ainda impacto notável na vida do doente a nível pessoal e profissional, bem como económico, com custos diretos e indiretos associados, que incluem não só fármacos, como também idas aos serviços de urgência, absentismo e presenteísmo.3 Existe assim a necessidade de estabelecer o diagnóstico correto de UCE, com uma boa definição dos diferentes subtipos e caracterização da sua gravidade e, consequentemente, estabelecer atempadamente o tratamento mais adequado.
Pretende-se com este trabalho rever os marcadores que permitam guiar na prática clínica a gestão do doente no que se refere à resposta farmacológica. Tratando-se de uma patologia crónica com grande impacto na qualidade de vida, principalmente quando o controlo sintomático não é obtido, torna-se relevante indagar sobre marcadores que permitam guiar o médico para o fármaco mais adequado. Assim, será possível estabelecer o tratamento mais adequado a cada caso de forma célere, evitando atrasos no controlo da sintomatologia e exposição a fármacos com reduzida eficácia nesse caso particular.
MÉTODOS
Para a presente revisão procedeu-se a uma pesquisa na base de dados da PubMed com os seguintes termos: “chronic AND spontaneous urticaria treatment”, obtendo um total de 512 resultados. Após a aplicação dos seguintes filtros: língua inglesa e portuguesa, artigos publicados no período de 1 de janeiro de 2018 até 18 de agosto de 2020 e estudos realizados em humanos, obtiveram-se 179 resultados.
Com base no título e abstract, foram incluídos 39 artigos. Foram ainda incluídos 9 artigos considerados relevantes, tendo por base as referências bibliográficas de artigos retirados originalmente.
A URTICÁRIA CRÓNICA ESPONTÂNEA
Definição e etiopatogenia
A urticária representa um grupo de diferentes padrões de reação cutânea com um quadro clínico caracterizado pelo aparecimento de placas fugazes eritemato-edematosas pruriginosas. Na UC, sobretudo na forma de UCE estas lesões persistem mais de 6 semanas, por vezes até vários meses ou anos. O angioedema, que acompanha a UCE em cerca de 40% dos doentes, não é pruriginoso e apresenta uma resolução mais lenta (>24 horas), associando-se geralmente a uma urticária mais grave, mais duradoura e resistente ao tratamento.1,4,5
Existe uma lacuna grande relativamente à etiologia da UCE, apesar de terem sido identificadas algumas potenciais causas, mas sem ainda se ter esclarecido exatamente de que forma levam ao seu aparecimento.1,4O mecanismo fisiopatológico fundamental da UCE consiste na desgranulação dos mastócitos e basófilos, resultando na libertação de diversos mediadores, principalmente a histamina. Estas substâncias levam à vasodilatação e aumento da permeabilidade capilar, causando as placas eritematosas bem delimitadas e/ou o angioedema. Simultaneamente ocorre a estimulação de terminações nervosas sensoriais responsável pelo prurido. A não identificação da causa que conduz a esta ativação celular patológica limita o tratamento atual da UCE ao seu controlo sintomático.1,4,6
Entre os vários mecanismos fisiopatológicos envolvidos na desgranulação mastocitária têm sido identificados fatores autoimunes e/ou auto-alérgicos, bem como a ativação de cascatas inflamatórias ou da coagulação.
Autoimunidade e/ou auto-alergia
A teoria auto-imune assenta na presença, já demonstrada, de anticorpos da classe IgG contra o recetor de alta afinidade da IgE (IgG anti-FcεRI) da superfície dos mastócitos e basófilos, bem como de IgG contra a própria IgE (IgG anti-IgE) à superfície das células (autoimunidade tipo IIb). Todavia, não existe consenso relativamente à prevalência destes auto-anticorpos em doentes com UCE, nem é de momento possível fazer a sua medição na prática corrente. Na presença de outros co-fatores, ainda mal identificados, as IgG anti-FcεRI e IgG anti-IgE conseguem ativar e induzir a desgranulação de mastócitos e basófilos. A ativação destes últimos é demonstrada também pela basopenia detetada em doentes com UCE, sugerindo o seu recrutamento para a pele aquando da crise aguda de urticária, ou a sua desgranulação e/ou destruição por estes anticorpos.5,7-9Verifica-se igualmente uma maior prevalência de doenças autoimunes em doentes com UCE, como tiroidite autoimune,10 artrite reumatoide ou lúpus eritematoso sistémico, reforçando a teoria da autoimunidade.11,12Por fim, a UCE apresenta uma maior incidência em mulheres, e é sabido que o sexo feminino tem uma maior incidência de doenças autoimunes.13
Além deste mecanismo fisiopatológico, na UCE podem ainda detetar-se IgE contra auto-antigénios, como IgE anti-peroxidase tiroideia (IgE anti-TPO), IgE anti-IL-24 e anti-dsDNA, que se fixam à superfície de mastócitos e basófilos e serão capazes de induzir a sua desgranulação quando expostos ao auto-antigénio (autoimunidade tipo I ou auto-alergia).7,9,14
O teste de soro autólogo (ASST - autologous serum skin test) e teste de ativação de basófilos (BAT - basophil activation test) permitem averiguar se o doente apresenta uma base autoimune tipo IIb. O ASST consiste na injeção intradérmica de soro do próprio doente, o que provoca uma pápula urticariana (reação de flare) quando positivo. É um teste rápido, de leitura imediata, e quando positivo pressupõe a existência de auto-anticorpos funcionantes anti mastócito/basófilo (que, de momento, só podem ser doseados em situações experimentais). O BAT avalia a libertação de histamina e a expressão de marcadores de ativação à superfície de basófilos de dadores em resposta à estimulação com soro de doentes com UCE.
Contudo, estes testes não estão disponíveis para o uso por rotina na prática clínica diária e não está provada a sua completa acuidade.1,4
Os testes ASST e BAT são mais frequentemente positivos em doentes com UCE quando comparando com doentes saudáveis.12 Estes mesmos testes, quando positivos, relacionam-se mais com a associação entre UCE e a presença de anticorpos IgG anti-FcεRI e/ou anti-IgE e IgE sérica baixa (autoimunidade tipo IIb). Doentes com predomínio de IgE contra auto-antigénios (autoimunidade tipo I ou auto-alergia) tendem a apresentar testes ASST e BAT negativos e valores de IgE sérica mais próximos do limite superior da normalidade ou acima deste.1,8,11Apesar de ser possível detetar estes anticorpos em doentes com UCE em maior percentagem do que na população em geral, estes também podem ocorrer em indivíduos sem UCE. Além disso, tal como noutras patologias, existem doentes com tiroidite de Hashimoto e anticorpos IgE anti-TPO sem UCE.14 A deteção destes anticorpos indica uma forte possibilidade de uma causa autoimune/ auto-alérgica numa subpopulação de doentes com UCE, mas não constitui condição única e suficiente para o seu desenvolvimento.12,15
Inflamação
Com indícios cada vez mais claros que a autoimunidade pode ser uma das causas de UCE faz sentido pensar nesta patologia como um estado pró-inflamatório. Verificou-se assim que doentes com UCE podem ter níveis de proteína C-reativa (PCR) superiores a indivíduos controlo saudáveis, estando este marcador elevado em cerca de um terço dos doentes. Pode associar-se também um aumento da velocidade de sedimentação (VS), apesar de não ser tão significativo.16,17
Indivíduos com ASST positivo têm níveis mais altos de PCR que doentes com este teste negativo. Do mesmo modo, doentes com níveis altos de PCR apresentam um teste ASST positivo mais frequentemente.
Contudo, não é possível extrapolar estas observações para toda a população com UCE. Não se verificam diferenças nos marcadores de autoimunidade, como imunoglobulinas e diferentes autoanticorpos, entre doentes com PCR alta ou normal.17
Obesidade, excesso de peso e síndrome metabólica são estados pró-inflamatórios mais frequentes na UCE do que na população em geral. Quando presentes, associam-se a uma doença mais severa e a marcadores inflamatórios mais elevados.8,14
Cascata da Coagulação
Vários estudos demonstraram que a cascata da coagulação pode ser ativada em doentes com UCE, não se sabendo de que forma exata contribui para o seu desenvolvimento.14,18Esta ativação poderá decorrer da expressão do fator tecidular nos eosinófilos ou da lesão de vasos sanguíneos.11,14Todavia, na UCE não existem alterações da hemostase clinicamente relevantes nem maior frequência de eventos trombóticos.7 O marcador da coagulação mais significativamente aumentado nestes doentes são os D-dímeros, que se associam habitualmente a uma forma de doença mais severa.1,8
Outras causas de UCE
São escassos os dados científicos que suportam outras teorias como possíveis causas de UCE.1 É o exemplo dos anti-inflamatórios não esteroides (AINE) ou de outros fármacos (como a codeína) que podem levar a uma reação de urticária não alérgica, ou agravamento da UCE, não mediado por IgE, mas por ativação direta do Mas-related G protein coupled receptor X2 (MRGPRX2).19 Infeções bacterianas podem pontualmente desencadear UCE por mecanismos mal conhecidos, como é o exemplo das infeções estafilocócicas. Apesar de terem sido detetadas IgE contra as enterotoxinas estafilocócicas, a sua frequência não revelou ser estatisticamente significativa em doentes com UCE, tendo sido estudada numa amostra de pequena dimensão.20
Diagnóstico da UCE
O diagnóstico da UCE é essencialmente clínico e inicia-se por uma anamnese o mais completa possível. Deve-se inquirir sobre a duração das lesões individuais e caracterização das mesmas, tempo de evolução do quadro clínico, sintomas associados, presença de angioedema, história familiar e pessoal de urticária, ocorrência em momentos específicos (por exemplo, perante mudanças de temperatura ou numa viagem ao estrangeiro), terapêutica farmacológica, possíveis infeções e doenças autoimunes, tratamentos realizados e resposta aos mesmos. Este inquérito tem como objetivo excluir patologias que fazem diagnóstico diferencial com a UCE, como síndromes auto-inflamatórios adquiridos, vasculite urticariana e fármacos capazes de induzir lesões semelhantes (por exemplo, AINE e inibidores da enzima conversora da angiotensina). O exame físico, importante para a objetivação das lesões, pode não ser possível dado o carácter fugaz das lesões.1
De acordo com as recomendações atuais está indicada a realização de análises sanguíneas, que incluem hemograma completo e PCR ou VS em todos os casos, mas outros parâmetros podem ser avaliados se a clínica assim o justificar, como por exemplo IgE sérica total, D-dímeros, anticorpos anti-tiroideus e anti-nucleares e fatores do complemento. Apesar da UCE não apresentar alterações laboratoriais específicas, esta avaliação e a biópsia cutânea permitem a exclusão de patologias que podem levar a quadros clínicos semelhantes. Adicionalmente pode realizar-se o ASST e o BAT, úteis para tentar objetivar o subtipo de UCE dependente de reação autoimune tipo IIb.1,4
Antes de instituir o tratamento farmacológico da UCE, que tem como objetivo o controlo sintomático absoluto e, simultaneamente, a melhoria da qualidade de vida do doente, deve ser avaliada a atividade da urticária. Para tal pode recorrer-se regularmente ao questionário Weekly Urticaria Activity Score (UAS7) e ao Urticaria Control Test (UCT), avaliando também a eficácia do tratamento. Para analisar a qualidade de vida pode recorrer-se ao Índice de Qualidade de Vida Dermatológico (DLQI) ou ao Chronic Urticaria Quality of Life Questionnaire (CU-Q2oL), recentemente aprovado na língua portuguesa e que incide especificamente nos sintomas de urticária.1,4,6Os valores de cut-off do UAS7, UCT e DLQI, bem como os scores do CU-Q2oL, encontram-se nas Tabelas 1 a 4, respetivamente.
Tabela 1 Valores de cut-off do UAS7.
| Valores UAS7 | Sintomas |
|---|---|
| 0 | Sem sintomas |
| 1-6 | Urticária controlada |
| 7-15 | Urticária ligeira |
| 16-27 | Urticária moderada |
| 28-42 | Urticária grave |
UAS7: Weekly Urticaria Activity Score.
Tabela 2 Valores de cut-off do UCT.
| Valores UCT | Controlo da Urticária |
|---|---|
| <12 | Urticária mal controlada |
| >12 | Urticária bem controlada |
UCT: Urticaria Control Test Score.
Tabela 3 Valores de cut-off do DLQI.
| Valores DLQI | Impacto na Qualidade de Vida |
|---|---|
| 0-1 | Não afeta a qualidade de vida |
| 2-5 | Ligeiro |
| 6-10 | Moderado |
| 11-20 | Elevado |
| 21-30 | Extremamente Elevado |
DLQI: Índice de Qualidade de Vida Dermatológico
Tabela 4 Scores do CU-Q2oL
| Valores CU-Q2oL | Impacto na Qualidade de Vida |
|---|---|
| Este questionário não apresenta valores de cut-off definidos, sendo antes apresentado como um contínuo | |
| 23 (score mínimo) | Qualidade de Vida ótima |
| 115 (score máximo) | Qualidade de Vida extremamente afetada |
CU-Q2oL: Chronic Urticaria Quality of Life Questionnaire.
Tratamento
De acordo com as atuais normas de orientação, o tratamento de primeira linha da UCE consiste na administração de anti-histamínicos H1 de segunda geração (AH2g) nas doses aprovadas, sem indicação para privilegiar qualquer princípio ativo. A sua eficácia deve ser avaliada em 2 a 4 semanas, ou mais cedo, caso se trate de um doente com sintomatologia muito grave. Se o controlo não for completo poder-se-á aumentar a dose aprovada até quatro vezes ou substituir por outro AH2g, sendo razoável realizar até três vezes uma substituição.
Considera-se on-label a substituição por outro princípio ativo antes do aumento da dose dos AH2g. Se estas alternativas revelarem ser insuficientes, poder-se-á avançar para a terapêutica de terceira linha, o omalizumab (OMZ), mas apenas após quatro semanas da implementação da terapêutica de segunda linha. Se mesmo após a introdução deste fármaco o controlo da urticária não for obtido, poder-se-á recorrer, em uso off-label, à ciclosporina (CA) que constitui a quarta linha terapêutica. A sua utilização deve ser bem ponderada pelos potenciais efeitos adversos graves.1,4Na Fig. 1 é apresentado o algoritmo terapêutico para o tratamento da UCE segundo as normas portuguesas.
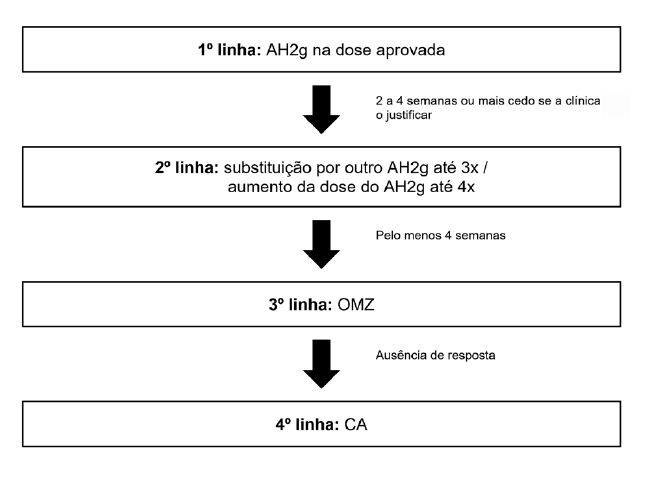
AH2g: anti-histamínicos H1 de segunda geração; OMZ: omalizumab; CA: ciclosporina
Figure 1 Algoritmo terapêutico para o tratamento da UCE em Portugal
Nas exacerbações da UCE podem ser introduzidos ciclos curtos de corticosteroides sistémicos, por um período máximo de 10 dias. Estes fármacos revelam ser úteis no alívio sintomático apenas no evento agudo, não estando indicados por períodos mais longos ou como tratamento de manutenção da UCE.1,4
Outras terapêuticas pontualmente utilizadas revelam-se benéficas, mas são indicadas apenas como último recurso, uma vez que não apresentam evidência científica que sustentem o seu uso sistemático. Em subpopulações específicas como crianças, grávidas e idosos, uma vez que não existem normas específicas, é consensual que devem ser usadas somente as terapêuticas on-label.1,4
Existem Marcadores Preditivos de Resposta ao Tratamento da UCE?
Anti-histamínicos H1
Atuam pelo bloqueio dos recetores H1 da histamina, localizados em células endoteliais, músculo liso, terminações nervosas sensoriais e sistema nervoso central. Ao bloquearem estes recetores inibem a ligação da histamina, diminuindo os sintomas típicos da UCE: ao nível das células endoteliais levam à diminuição da permeabilidade vascular e, consequentemente, do edema e ao nível dos nervos sensoriais diminuem o prurido e eritema reflexo. Atualmente recomendase apenas o uso de AH de segunda geração, dado não apresentarem efeitos anticolinérgicos e associarem-se a poucos, ou mesmo nenhuns, efeitos sedativos. Os AH de primeira geração foram proscritos pelos efeitos secundários associados, principalmente os sedativos, bem como pela interferência no sono REM.1
Os AH2g são recomendados no tratamento da UCE, mas na prática 50% dos doentes, ou mais, não responde às doses recomendadas, nem mesmo com as doses mais elevadas recomendadas como segunda linha terapêutica.13,21-23A ausência tão marcada de resposta pode resultar do facto de existirem outros mediadores libertados pelos mastócitos ou outras células também envolvidas na UCE. Nos infiltrados celulares das lesões dérmicas podem-se encontrar também basófilos, eosinófilos, neutrófilos e linfócitos, sendo estes casos ainda mais refratários aos anti-histamínicos.1,12
Um dos principais fatores para a ausência de resposta aos AH2g relaciona-se com a fisiopatologia autoimune da UCE. Doentes com o ASST positivo têm uma maior probabilidade de resistência aos AH2g, comparativamente com os que apresentam este teste negativo.12,16,24,25Uma análise retrospetiva com cerca de 1000 doentes concluiu que indivíduos com níveis de PCR mais altos se associam frequentemente a um ASST positivo e, na sua maioria, a uma pior resposta aos AH2g.17 Outro estudo com uma amostra semelhante avaliou a relação da autoimunidade, particularmente a autoimunidade tiroideia, com a UCE e concluiu que doentes com o ASST positivo apresentam uma pior resposta aos AH2g comparativamente com os que apresentam um resultado negativo.10Também o BAT positivo se tem relacionado com uma precária resposta a estes fármacos16, mas de forma não consensual.16,25Um estudo observacional que incluiu 549 doentes com UCE, avaliou fatores preditivos de prognóstico e resistência ao tratamento, e não detetou uma relação entre o ASST e a resposta ao tratamento, mas apenas que um score UAS7 elevado aquando do diagnóstico é fator preditivo de resistência ao tratamento com AH2g.22
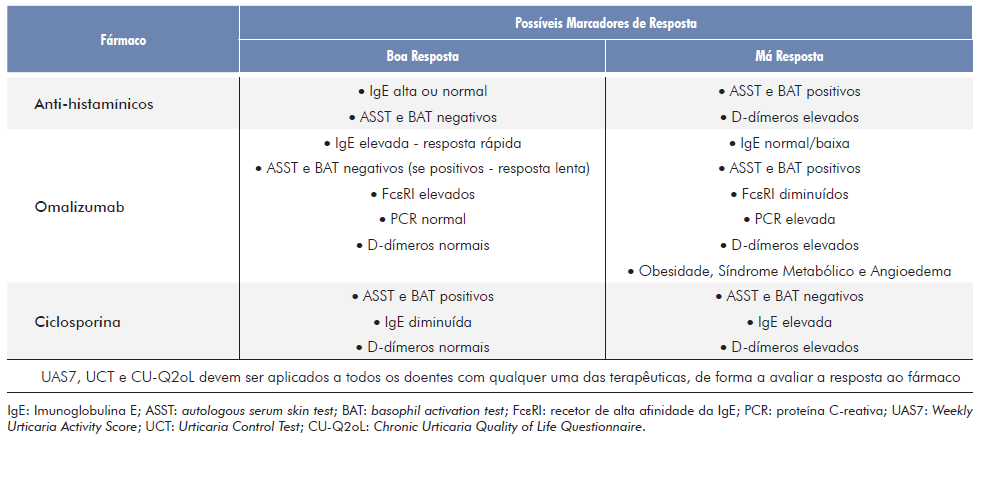
Outro marcador passível de ser preditivo da resposta aos AH2g é a IgE sérica. Como referido, um ASST positivo associa-se a anticorpos IgG anti-FcεRI e IgG anti-IgE e a valores mais baixos de IgE. Desta forma, um doente com níveis altos de IgE terá, à partida, um ASST negativo e, por isso, maior probabilidade de responder favoravelmente aos AH2g.12 Por fim, níveis elevados de D-dímeros poderão ser preditivos de uma resposta desfavorável a esta terapêutica.16,24,25(Tabela 5)
Omalizumab
O OMZ é um anticorpo monoclonal humanizado anti-IgE que diminui os níveis de IgE livre ao formar um complexo com esta imunoglobulina, impedindo a sua ligação ao recetor mastocitário. O seu mecanismo de ação na UCE ainda não é completamente compreendido, mas sabe-se que diminui a ativação dos mastócitos e basófilos e, secundariamente, também reduz a expressão celular do FcεRI.9,26,27A diminuição da ativação dos basófilos pode ser objetivada pela reversão da basopenia periférica.28-30A ligação do OMZ à IgE livre provoca um incremento da IgE total pelo aumento da fração complexada.27
O OMZ revelou ser bastante eficaz em doentes com UCE refratários aos AH2g, com apenas uma pequena percentagem de doentes (menos de 30% de doentes) a necessitar de recorrer à CA.19,31
Revelou ainda ser seguro, apresentando uma baixa percentagem de efeitos adversos (menor que 20%), nomeadamente cefaleias, astenia, artralgias e reações no local de administração, que não impossibilitam o seu uso.19,31,32Com o seu uso crescente, verificou-se existirem três tipos de resposta ao OMZ: os doentes que respondem rapidamente, os que respondem lentamente e os que não respondem ao medicamento. Contudo, não existe consenso quanto ao tempo de resposta que delimita cada grupo.26,27,31
O marcador que apresenta melhor relação com a resposta ao OMZ é a IgE sérica doseada antes do início da terapêutica. Doentes com níveis mais altos tendem a responder favoravelmente a este fármaco,16,19,23,24,33,34como confirmado em quatro estudos observacionais que incluíram quase 1000 doentes com UCE, para avaliar os fatores que melhor predizem a resposta ao OMZ.26,27,31,35Dois dos estudos observacionais, com 322 e 113 doentes, confirmam ainda que doentes com o ASST e o BAT positivos tendem a responder mais lentamente ao OMZ.27,31A resposta lenta ao OMZ é explicada pelos baixos níveis de IgE, sendo necessária a diminuição secundária dos FcεRI mastocitários para ocorrer melhoria clínica nos doentes em que predominam IgG anti-FcεRI e IgG anti-IgE.12,25Os doentes que não respondem ao OMZ caracterizam-se por terem níveis basais de IgE bastante baixos e por esse valor não aumentar no decurso do tratamento.19,26,27,31,33Para avaliar se o doente está a responder ao OMZ é proposta a “regra de 2x4”: se o valor de IgE duplicar nas primeiras quatro semanas de tratamento é expectável uma ausência de resposta ao OMZ.27,33Contudo, dois artigos de revisão contradizem esta hipótese de uma IgE basal elevada ser preditiva de uma resposta favorável ao OMZ.8,16Um estudo observacional retrospetivo que analisou os fatores relacionados com a resistência ao OMZ em 106 doentes não confirmou a relação entre os níveis de IgE e a resposta ao tratamento.36 Outro estudo com 132 doentes não identificou nenhum parâmetro analítico como marcador de resposta ao OMZ 37 e outro estudo prospetivo com 117 doentes também não encontrou qualquer correlação.32 Esta relação entre os níveis de IgE e a resposta ao OMZ pode ser influenciada pela coexistência de atopia, que se associa a valores elevados desta imunoglobulina e que deve ser considerada aquando da sua interpretação. Num estudo observacional avaliou-se a IgE total e a atopia em 76 doentes resistentes ao OMZ. No global, não foram detetadas diferenças significativas entre os respondedores e os resistentes ao OMZ no que se refere aos níveis de IgE, mas, após excluir os doentes com atopia, aqueles que responderam ao OMZ apresentaram doseamentos desta imunoglobulina mais elevados comparativamente com o grupo de doentes resistentes.38
Outro marcador proposto para avaliar a resposta ao OMZ é o nível basal de FcεRI e a sua alteração durante o tratamento. Doentes com ASST positivo apresentam níveis de IgG anti-FcεRI mais altos, o que se associa a uma diminuição destes recetores nos mastócitos pela sua internalização. Contrariamente, em doentes com o ASST negativo os níveis destes anticorpos são mais baixos e a expressão do FcεRI é significativamente mais alta.39 Num doente que responde rápido ao OMZ é esperado que a expressão deste recetor diminua, apesar dos níveis iniciais mais altos. O mesmo acontece, ainda que de forma mais lenta, nos doentes que têm uma resposta mais tardia ao OMZ. Pelo contrário, um doente resistente ao OMZ, além de inicialmente apresentar níveis baixos, estes não se alteram durante o curso do tratamento.8,19,23,24,33Estes dados foram confirmados num estudo prospetivo com 44 doentes com resposta favorável ao OMZ, mas não revelou diferenças na diminuição deste recetor entre os respondedores rápidos e lentos.40 Um ensaio clínico randomizado duplamente cego com uma amostra de 30 doentes, em que 20 receberam tratamento com OMZ e os restantes 10 placebo, confirmou a relação entre os níveis basais elevados de IgE, bem como o decréscimo acentuado dos FcεRI, e a boa resposta ao OMZ, enquanto os doentes resistentes a este fármaco apresentaram uma menor redução deste marcador e níveis basais mais baixos de IgE.41
A PCR é outro biomarcador que pode estar elevado em doentes com UCE e que pode predizer uma resposta desfavorável ao OMZ.8
Três estudos observacionais retrospetivos, com cerca de 300 doentes, concluíram que os doentes tendem a apresentar um decréscimo da PCR coincidente com a melhoria da UCE em resposta ao OMZ, contrariamente aos doentes resistentes ao fármaco.28,29,36Contudo, um estudo observacional não demonstrou qualquer diferença nos valores da PCR entre os doentes que responderam ao OMZ e os resistentes, pelo que o seu uso como preditor de resposta pode estar comprometido.17
Os D-dímeros, elevados em casos de UCE mais severa16, foram propostos como marcadores de resposta desfavorável ao OMZ.8,33
Um ensaio clínico não controlado identificou esta relação e demonstrou um decréscimo em doentes que respondem ao OMZ (à semelhança da PCR).42 Contudo, apesar do decréscimo com o tratamento ser unânime, os níveis iniciais de D-dímeros nem sempre estão estatisticamente relacionados com a resposta ao OMZ.16 Dois estudos observacionais, com 25 e 470 doentes, apresentaram resultados opostos, com indivíduos com D-dímeros iniciais mais baixos a serem resistentes ao OMZ ou a não se relacionarem com a resposta a este fármaco, respetivamente.26,43
A presença de obesidade e síndrome metabólico tem também impacto na resposta ao OMZ, com os doentes resistentes a este fármaco a apresentarem mais frequentemente estas comorbilidades e níveis mais altos de PCR.8,36O angioedema também se revela um fator adverso na resposta ao OMZ, além de estar associado a UCE com maior atividade, refletindo-se em UAS7 mais altos31,44(Tabela 5).
Ciclosporina
A CA é um imunomodelador que inibe os linfócitos T helper, bloqueando a produção de citocinas com consequente diminuição da síntese de IgE. Como tem uma ação não específica, atua em várias citocinas e acaba por exercer o seu efeito em várias células do sistema imunitário. É um fármaco utilizado na UCE de forma off-label, apenas como quarta linha terapêutica devido aos efeitos secundários, que incluem nefrotoxicidade, hipertensão arterial e, ainda, um potencial incremento do risco de malignidade, que aumenta com a duração da exposição a este fármaco. É de notar que ainda não existem estudos clínicos randomizados sobre o uso da CA na terapêutica da UCE, sendo os dados de eficácia disponíveis resultantes de estudos clínicos com um número reduzido de doentes.45
Nestes estudos, verificou-se que doentes com ASST e BAT positivos apresentam uma resposta tendencialmente favorável à CA,8,12,23-25,45assim como os doentes com IgE sérica baixa ou muito baixa, como comprovado num ensaio retrospetivo com 34 doentes com UCE.46 Ainda uma análise prospetiva, com uma amostra de 34 doentes com UCE, conclui de igual forma que a redução mais significativa do UAS7 após tratamento com CA foi observado em doentes com ASST positivo e níveis de IgE baixos.47Apenas uma análise retrospetiva, com 106 doentes com UCE, não comprovou a associação entre o ASST positivo e a boa resposta à CA.48 Contudo, da maioria dos estudos podemos inferir que o perfil de doentes que responde favoravelmente à CA tem níveis de IgE baixos ou muito baixos e ASST e BAT positivos, estando subjacente uma autoimunidade tipo IIb e, em oposição, os doentes com níveis de IgE mais alta e ASST e BAT negativos, associando-se a uma autoimunidade tipo I, são mais refratários a esta terapêutica e respondem rapidamente ao OMZ.
De forma semelhante ao que se verificou para os AH2g e OMZ, níveis basais elevados de D-dímeros também se associam a uma resposta desfavorável ao tratamento com a CA.16,24,25(Tabela 5)
Pertinência e Benefício no Uso de Marcadores Preditivos de Resposta ao Tratamento
Perante os dados apresentados, verifica-se não ser possível integrar definitivamente os doentes em diferentes subtipos de UCE de acordo com a sua etiopatogenia. De momento apenas é possível inferir se o doente terá uma base autoimune e qual o subtipo (I ou IIb), ou outra, permanecendo neste caso totalmente desconhecida a sua causa. Apesar da limitação na definição etiológica da UCE, esta divisão parece ser útil na integração destes dois subtipos de doentes na provável resposta ao tratamento farmacológico.
Com esta estratificação de doentes verificou-se que aqueles que apresentam uma aparente fisiopatologia autoimune revelam fraca resposta aos AH2g, contrariamente ao que ocorre com o OMZ e CA. Doentes com um ASST e BAT positivos, associados a níveismais baixos de IgE e níveis mais altos de PCR, representando um subtipo de autoimunidade tipo IIb, apresentam uma resposta desfavorável aos AH2g, respondem favoravelmente à CA e tendem a responder ao OMZ, apesar de tal ocorrer mais tardiamente (após 4-6 meses). Os doentes que apresentam níveis mais altos de IgE e que frequentemente têm o ASST e o BAT negativos, representando uma forma imunológica com IgE anti-self (autoimunidade tipo I ou autoalérgica), revelam uma resposta favorável e rápida ao OMZ, ainda que com uma recidiva mais rápida após a sua suspensão, e uma resposta desfavorável à CA. Por último, doentes que não apresentam qualquer indício de base autoimune, ou seja, com ASST e BAT negativos, IgE com valores normais ou baixos e PCR normal, revelam uma resposta favorável aos AH2g, poderão responder à CA e muito provavelmente vão ser resistentes ao OMZ. Os D-dímeros, quando elevados, constituem o único marcador que revela ser preditivo de uma reposta desfavorável aos três fármacos. Importa notar que existem estudos com dados discrepantes para todos os biomarcadores identificados. Por um lado, são marcadores não específicos de UCE, uma vez que podem encontrar-se alterados noutras patologias passíveis de coexistir com a urticária, interferindo com a sua interpretação. Por outro lado, os estudos atualmente existentes são em número reduzido e com qualidade limitada, com amostras pequenas, rondando as centenas ou dezenas de doentes, e os ensaios clínicos mais recentes carecem de grupo controlo. Torna-se assim evidente a necessidade de ensaios clínicos controlados e randomizados para o estudo de marcadores de resposta ao tratamento farmacológico. Existe ainda a necessidade de uniformizar os valores de cut-off do ASST, os intervalos de tempo em que os marcadores devem ser avaliados e os espaços de tempo que definem a resposta ao tratamento com o OMZ. É necessário ainda estabelecer normas mais precisas relativamente a este tratamento, especificamente no que se refere à possibilidade de aumentar a dose de OMZ em caso de falência do controlo sintomático com as doses aprovadas e qual o período de tempo mínimo para testar a terceira linha terapêutica até se avançar para a CA.
CONCLUSÃO
Apesar de atualmente não ser possível validar definitivamente o uso clínico destes biomarcadores para orientação da resposta ao tratamento, será possível recorrer aos mesmos em certos doentes e utilizá-los na prática clínica corrente, nomeadamente no que se refere ao doseamento da IgE total, PCR e D-dímeros (disponíveis em todos os laboratórios), e o ASST e o BAT (exequíveis em clínicas mais especializadas). Contudo, a clínica deve prevalecer sobre os resultados analíticos, nomeadamente a avaliação dos questionários UAS7, UCT e CU-Q2oL que devem ser realizados de forma sistemática, sendo esta a análise que deve guiar a escalada terapêutica. Assim, na orientação do tratamento de um doente com UCE, de acordo com as recomendações atuais, o primeiro fármaco a introduzir seria um AH2g. Mesmo com um perfil de resposta desfavorável, não seria adequado iniciar logo o OMZ, pois tem um custo significativamente superior e a administração é subcutânea mensal, contrastando com os AH2g de baixo preço e administração oral. Assim, perante um doente que se mantém sintomático, seria possível aumentar até quatro vezes a dose recomendada dos AH2g ou substituir por outro princípio ativo. Se o doente continuar sintomático ao fim de 4 semanas e apresentar um perfil favorável ao OMZ a sua introdução estaria indicada, pois trata-se de um fármaco seguro com efeitos adversos raros e de reduzida gravidade. Se o perfil fosse antes favorável aos AH2g seria indicado insistir nesta terapêutica além das 4 semanas. Não seria lícito avançar para a CA sem testar de forma adequada as terapêuticas anteriores, devido ao seu perfil de segurança inferior.
Ainda que com as limitações anteriormente apontadas, tendo por base o entendimento da fisiopatologia da UCE e do mecanismo de ação dos fármacos nesta patologia, podemos inferir, apoiados na maioria dos estudos, que nas UCE resistentes aos AH2g o perfil de doentes que responde favoravelmente à CA tem níveis de IgE baixos ou muito baixos e ASST e BAT positivos, estando subjacente uma autoimunidade tipo IIb, enquanto que os doentes com níveis de IgE mais alta e ASST e BAT negativos, associando-se uma autoimunidade tipo I, são mais refratários à terapêutica com a CA e respondem rapidamente ao OMZ.