1. Introdução
As doenças oncológicas constituem um conjunto de entidades nosológicas com uma importância substantiva e progressiva no panorama da morbi-mortalidade a nível mundial. No entanto, a sua heterogeneidade, decorrente da possibilidade de eclosão em qualquer órgão ou tecido do corpo humano, influencia decisivamente as diferentes causalidades, incidências, prevalências, diagnósticos, tratamentos e mortalidades.
Sendo uma patologia intrinsecamente associada ao meio ambiente e aos comportamentos, tem uma significativa capacidade de prevenção primária (a profilaxia), através do afastamento dos factores de risco importantes, como sejam o tabagismo, a alimentação inadequada, o sedentarismo, o consumo excessivo de bebidas alcoólicas, o ambiente profissional de risco, os incorrectos comportamento sexuais e reprodutivos e algumas infecções. No entanto, essa sua capacidade encontra-se, na prática, bastante limitada, pois tais factores de risco estão amplamente associados a atitudes e comportamentos muito intrincados nas sociedades e nos seres humanos. É muito difícil induzir esse tipo de alterações comportamentais, tanto mais que a) - não existe uma causalidade inequívoca (excepto nos casos do tabagismo e da infecção por HPV), b) - é raro que um único factor de risco seja o responsável pela causalidade e c) - os tempos de latência entre a exposição e a eclosão da doença são normalmente muito dilatados.
Outra arma, fundamental, disponível para a diminuição da mortalidade (e, em algumas localizações, da incidência) por esta patologia é a prevenção secundária. Esta define-se como a detecção e tratamento da doença antes que surjam sinais e sintomas, ou seja, na fase pré ou infra-clínica.
Há várias modalidades de prevenção secundária de cancro:
A - Diagnóstico precoce
B - Rastreio “oportunístico”
C - Rastreio organizado populacional
D - Cuidados personalizados
A - O Diagnóstico precoce tem uma base individual, pois requer que seja a pessoa a procurar os cuidados de saúde devido a um sinal ou sintoma suspeito. Mas requer, igualmente, que o indivíduo tenha a literacia em saúde necessária para identificar a sua existência e esteja predisposto a recorrer a esses cuidados de saúde, adoptando uma actuação activa de prevenção individual.
B - O Rastreio “oportunístico” assenta mais numa atitude tendencialmente populacional, embora casuística e não organizada. Assim, aquando duma visita aos cuidados de saúde, por alguma causa não relacionada com motivos de prevenção oncológica, os profissionais aproveitam esse momento para realizar, ou requisitar, testes de rastreio/diagnóstico dirigidos à detecção precoce de patologia oncológica. Tem uma reduzida eficiência populacional, conduzindo também a desigualdades sociais, pois apenas aqueles que estão inseridos activamente nos sistemas de saúde beneficiam com esta metodologia. Pode, pois, considerar-se que reflecte uma insuficiência ou falha na igualdade e equidade dos sistemas de saúde, pelo que, conceptualmente, tem um interesse muito limitado e não deveria existir.
C - O Rastreio organizado populacional tem uma nítida perspectiva comunitária, dirigida para os indivíduos sem sinais e sem sintomas, e está sujeito à análise custo-efectividade (pré e pós-intervenção) e estuda a pessoa num processo multifásico com intervenções de agressividade diagnóstica progressiva.
D - Os Cuidados personalizados correspondem a uma intervenção ainda mais estruturada na procura do diagnóstico precoce em oncologia. São concebidos numa base individual através da qual qualquer pessoa deveria ter uma estratificação dos seus riscos. Assim sendo, toda a intervenção de diagnóstico precoce estaria dirigida a cada indivíduo, o que condicionaria os tipos de cancro a serem prevenidos, o tipo de diagnóstico a ser realizado, e a sua periodicidade. Trata-se de um tipo de metodologia que, a prazo, poderá ser gradualmente implementado, à medida que o conhecimento científico for avançando. Um exemplo deste tipo de actuação consiste no chamado “rastreio de populações de alto-risco”, sujeitos a determinantes genéticas, hereditárias e ambientais agressivas e particulares.
A implementação do tipo de actividades de prevenção oncológica numa determinada população é condicionada pela Política de saúde que, por sua vez, se apoia em relevantes estudos provenientes da saúde pública e da economia da saúde (prioridades da sociedade, estado da situação na procura e na oferta de cuidados, caracterização da epidemiologia das referidas doenças e evidência científica).
2. Princípios gerais do rastreio
O rastreio (aqui como sinónimo de “rastreio organizado populacional”) pode ser definido como a aplicação de um teste para identificar a doença assintomática e precoce, sendo o seu objectivo primário a redução da mortalidade (no caso do cancro da mama) e/ou da incidência (no caso do colo do útero e colorrectal). Além disso, um rastreio tem importantes consequências adicionais, como sejam a necessidade de se disponibilizarem vultuosos recursos financeiros, a possibilidade de haver uma potencial poupança a médio e longo prazo e, ainda, os efeitos na qualidade de vida, positivos ou negativos (Hakama et al. 2008).
Como o cancro é sempre uma doença potencialmente letal, o primeiro objectivo do rastreio oncológico (e tratamento subsequente) é o aumento da sobrevida dos doentes detectados (com a melhor qualidade de vida possível). O primeiro indicador da sua eficiência é a diminuição da mortalidade (específica e/ou geral), mas outros indicadores indirectos (“surrogate”) podem ser usados, como a taxa de adesão da população, o estadio na detecção da doença, a menor agressividade da intervenção, o aumento da sobrevida, os indicadores de rendimento, a ocorrência de cancros de intervalo e a morbilidade psicológica. (European Commission 2006; Arbyn et al. 2008; Bond et al. 2013)
O rastreio oncológico requer critérios a) relativos à doença (a existência de altas, incidência, prevalência e mortalidade), o conhecimento da história natural, a possibilidade de nela intervirmodificando o seu curso clínico, e, idealmente, uma significativamente grande fase pré-clínica), b) relativos ao teste de rastreio (teste simples, aceitável, com baixo custo, seguro e de aplicação rápida, bem como possuidor de adequadas sensibilidade, especificidade e valores preditivos positivo e negativo), c) relativos ao rendimento (com diagnóstico definitivo e tratamento adequado disponíveis imediatamente) e d) relativos ao efeito (com redução evidenciável e significativa da incidência e/ou, antecipados por indicadores intermédios favoráveis, semelhantes e comparáveis aos indicadores padrão).
O rastreio tem também critérios de implementação e de execução bem definidos, como sejam (Wilson e Jungner 1968; Andermann et al. 2008):
1. O programa de rastreio deverá responder a uma necessidade reconhecida
2. Os objectivos do rastreio deverão ser definidos no início do seu planeamento
3. Deverá haver uma populacão-alvo definida
4. Deverá haver evidência científica sobre a eficiência e efectividade do programa de rastreio
5. A gestão do programa ter em atenção todos os seus componentes com uma especial atenção à coordenação dos serviços clínicos, aos procedimentos do teste e à educação permanente dos colaboradores e da população
6. Deverá haver procedimentos de controlo e garantia de qualidade, com mecanismos para minimizar os potenciais riscos do rastreio
7. O programa deverá assegurar consentimento informado nas suas diferentes fases, confidencialidade e respeito pela autonomia das pessoas rastreadas
8. O programa deverá promover a equidade e o acesso ao rastreio pela totalidade da população
9. A avaliação do rastreio deverá ser definida desde o início do seu planeamento
10. Os benefícios globais do rastreio deverão ser superiores aos malefícios
A União Europeia é taxativa na seguinte declaração, de 2003: “The screening tests ..... can only be offered on a population basis in organised screening programmes with quality assurance at all levels, if good information about benefits and risks, adequate resources for screening, follow-up with complementary diagnostic procedures and, if necessary, treatment of those with a positive screening test are available.” (Council of the European Union 2013)
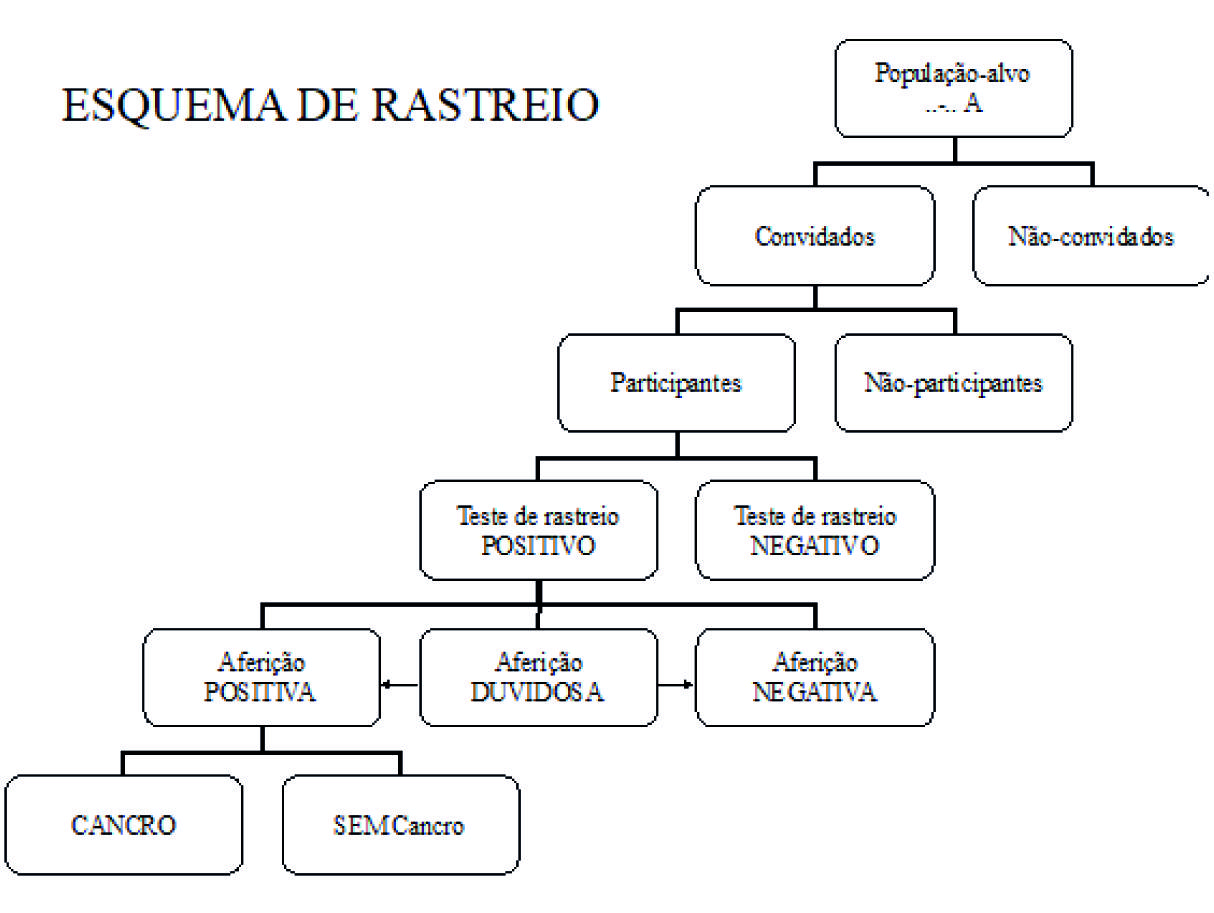
O processo de rastreio, como processo multifásico, exige a organização cuidada dos seus vários componentes (figura 1 e tabela 1):
Tabela 1 Componentes dos programas de rastreio oncológico
| Componente | Procedimentos |
|---|---|
| Populacional | Definição da populacão-alvo |
| Identificação dos indivíduos | Medidas para conseguir boas coberturas e participação |
| Execução do teste | Infra-estruturas para colher o material e a análise do material de rastreio Programas de controlo de qualidade para a obtenção do material de rastreio e sua análise e interpretação |
| Clínico | Infra-estruturas para diagnóstico, tratamento e acompanhamento dos doentes com cancros (ou lesões pré-neoplásicas detectadas no rastreio) |
| Coordenação | Um sistema de referência ligando o rastreio, a unidade de rastreio e a infra-estrutura clínica Um sistema que assegure o processo de convocação e re-convocação Um sistema que forneça informação de retorno aos utentes e aos profissionais de saúde |
Adaptado de Hakama (2008)
O processo de rastreio é semelhante para todas as localizações tumorais dele passíveis. Inicia-se na identificação e individualização da população-alvo (género, grupo etário, critérios de exclusão e de inclusão), prossegue com o convite individual e personalizada, a execução e análise do teste de rastreio, a eventual convocatória para consulta clínica (de “aferição”) e o eventual encaminhamento dos casos suspeitos para uma instituição hospitalar para diagnóstico final, tratamento e acompanhamento. Todo este processo deverá estar sujeito a mecanismos de controlo e garantia de qualidade, de modo a ser possível maximizar os benefícios e minimizar os malefícios.
3. Recomendações metodológicas
A União Europeia recomenda o rastreio organizado populacional em três localizações tumorais: mama feminina, colo do útero e colorrectal (tabela 2).
Tabela 2 Teste primário, idade e intervalo entre testes para rastreio da mama, colo do útero e colorrectal em programas europeus organizados (Armaroli et al. 2015)
| Localização | |
|---|---|
| Mama | Mulheres a partir dos 50 anos e não antes dos 40 anos A partir dessa idade, todos os 2 anos até aos 70-75 anos |
| Colo do útero | Tanto a citologia (Pap) como a pesquisa de virus do papilloma humano Se a citologia for usada para rastreio, início aos 25-35 anos e a partir daí cada 3-5 anos Se a pesquisa de HPV for usada para rastreio, início aos 35 anos (geralmente não antes dos 30) e a partir daí cada 3-5 anos Independentemente do teste usado, as mulheres deverão participar no rastreio até aos 60-65 anos, e continuar a realizá-lo, excepto se os testes mais recentes forem normais |
| Colorrectal | Homens e mulheres a partir dos 50-60 anos A partir dessa idade, cada 2 anos se o teste for a pesquisa de sangue oculto nas fezes (gFOBT) ou o teste imunoquímico fecal (FIT) A partir dessa idade, cada 10 anos ou mais se o teste de rastreio for a sigmoidoscopia flexível (FS) ou a colonoscopia (CT) A maioria dos programas continua a enviar convites para rastreio até aos 70-75 anos |
Estas recomendações baseiam-se, sobretudo, em estudos randomizados para o caso dos rastreios do cancro da mama e do cancro colorrectal, e em estudos observacionais no caso do cancro do colo do útero, em que a evidência não-experimental foi de tal modo clara que não se considerou necessário realizar estudos randomizados.
A definição do género e do grupo etário da população-alvo é importante, baseando-se nos conceitos de estratificação de risco - factores de risco, incidência, prevalência, mortalidade - e nas características operativas do testes de rastreio - sensibilidade, especificidade e valores preditivos - de molde a permitir uma “boa” definição dos casos verdadeiro-negativos e verdadeiro-positivos, bem como a minimizar os casos falso-negativos e falso-positivos.
O intervalo de rastreio está associado à história natural da doença e aos tempos “teóricos” de aparecimento e de progressão tumoral.
3.1. Rastreio do cancro da mama feminina
Os vários estudos realizados têm, de uma forma consistente, evidenciado a eficácia e a efectividade do rastreio de cancro da mama. Meta-análises de ensaios clínicos randomizados e revisões sistemáticas mostram uma significativa redução no risco relative da mortalidade por cancro da mama entre 0.80-0.82, apesar de diferenças no acompanhamento e no outcome. (Gotzsche e Jorgensen 2013; Fitzpatrick-Lewis, Hodgson e Ciliska 2011; Independent 2012)
Os resultados dos estudos observacionais evidenciam também reduções significativas da mortalidade, tanto quando se consideram as idades limítrofes aos 50-69 anos, entre 25 e 48%, tal como em estudos de tendência temporal, da ordem dos 1-9% ao ano, e entre 28 e 36% numa análise pré e pós-rastreio no intervalo entre 15 e 30 anos de acompanhamento. (Broeders et al. 2012; Gabe e Duffy 2005).
3.2. Rastreio do cancro do colo do útero
A evidência da efectividade do rastreio de cancro do colo do útero com citologia convencional (teste de Papanicolau) provém “apenas” de estudos de observação, seja de estudos de coorte, caso-controlo, tendência temporal e ecológicos, podendo estimar-se a redução da incidência em cerca de 66% (Strategies 2005), com variações muito dependentes do (maior) grau de organização e da (maior) taxa de participação das populações-alvo.
A posterior introdução alternativa do teste de HPV, seja sequencialmente ao anterior seja como teste de rastreio inicial, evidenciou resultados muito significativos comparativamente ao teste de Papanicolau. (Ronco et al. 2014; Ronco et al. 2006; Ronco et al. 2008).
Quanto às idades mais apropriadas para rastreio, os dados disponíveis sugerem que este terá um melhor custo-efectividade em idades superiores aos 30 anos. (Ronco et al. 2014).
3.3. Rastreio do cancro colorrectal
Uma meta-análise de estudos randomizados (Hewitson et al. 2007) com utilização do teste de pesquisa de sangue oculto nas fezes pelo método “gFOBT” permitiu evidenciar uma redução de cerca de 16% na mortalidade por cancro colorrectal, embora sem redução da incidência. O uso do teste imunoquímico fecal (FIT) permitiu uma redução de cerca de 32% na mortalidade do segmento rectal, mas sem aparente impacto na redução na mortalidade por cancro do cólon ou conjunto do tracto colorrectal (Zheng et al. 2003).
No caso do uso de sigmoidoscopia flexível (FS), evidenciou-se uma redução da mortalidade entre 28 e 50% (Elmunzer et al. 2012; Scand 1999; Hoff et al. 2009; Atkin et al. 2010; Segnan et al. 2011; Schoen et al. 2012). Já para o uso da colonoscopia (CT) os estudos de observação parecem indicar uma redução de 29 a 65% de redução da mortalidade por cancro colorrectal e de 48 a 67% na incidência (Winawer et al. 1993; Baxter et al. 2009; Brenner et al. 2010; Brenner et al. 2011).
Os vários estudos já publicados parecem indicar que a idade óptima de rastreio parece estar nos 50-69 anos para qualquer dos testes utilizados, com diferentes eficácias marginais nos utentes dentro destes grupo etário e nas idades limítrofes, provavelmente porque aqules utilizam diferentes critérios tempo de seguimento e de outcome (Hardcastle et al. 1996; Kronborg et al. 1996; Lindholm, Brevinge, Haglind 2008; Mandel et al. 1993; Scholefield et al. 2002; Mandel et al. 1999).
4. Efeitos indesejáveis do rastreio
Sendo a mortalidade o indicador primário de eficácia, eficiência e efectividade do rastreio organizado populacional, com reflexo populacional, haverá situações major que tem um potencial enorme na diminuição desse impacto (figura 1).
Na verdade, poderá haver cancro nos não-convidados e nos não-participantes, bem como poderá haver “cancros de intervalo” (cancros diagnosticados após um resultado negativo na avaliação do teste de rastreio, na avaliação no processo de aferição, no diagnóstico final - “verdadeiros” cancros de intervalo por não existirem ou, “falsos-negativos” por não serem detectados, por erro no procedimento -, e antes de nova ronda de rastreio).
Outro dos efeitos indesejáveis potenciais do rastreio é o “sobrediagnóstico” (“overdiagnosis”). Este termo assume que haverá cancros diagnosticados que nunca iriam causar sintomas ou a morte durante a esperança de vida expectável dos utentes e que, além disso, conduzem a um tratamento que não seria, de outro modo, necessário. Sendo uma estimativa (pois não há, nem eticamente pode haver estudos comparativos entre diagnosticar e tratar versus diagnosticar e não tratar), não temos números reais e, além disso, o método de cálculo tem variado muito entre os diferentes investigadores (Independent 2012).
O eventual efeito iatrogénico de procedimentos de rastreio e de diagnóstico tem sido também alvo de estudo, sobretudo no caso das radiações no uso da mamografia e no caso de perfurações, sangramento e problemas cardiovasculares no caso da colonoscopia. No caso da mamografia tem havido estudos sobre o efeito prejudicial das radiações, sobretudo quando a sua utilização é introduzida precocemente e a mulher cumpre a grande maioria das voltas (de 2 em 2 anos). A sua quantificação é difícil e poderá ser estimada no aparecimento de 1,6 cancros por 100.000 mulheres (Gelder et al. 2011; Yaffe, Mainprize 2011). Quanto à colonoscopia, as estimativas apontam para uma percentagem de 0,06 a 0,5% (Quintero et al. 2012; Pox et al. 2012).
Atenção especial tem sido dada, sobretudo nos últimos tempos, à morbilidade psicológica decorrente de qualquer das etapas do rastreio, com estudos de avaliação e introdução de medidas conducentes à sua diminuição (Brett et al. 2005; Bond et al. 2013; Brewer, Salz, Lillie 2007). A informação é aqui um factor fundamental.
5. Desafios
Actualmente, a população possui cada vez maior acesso a fontes de informação em saúde (nem sempre as mais correctas) e tem, naturalmente, aumentado a sua literacia. Fundamentalmente, deseja maior esperança de vida e com maior qualidade. É neste quadro que crescem os desafios que a sociedade, em geral, e os cuidados de saúde, em particular, têm que solucionar.
Entre estes seriam de destacar
- a diminuição das barreiras aos rastreios,
- a atenção a novos testes passíveis de serem utilizados,
- a atenção aos estudos que, neste momento, avaliam a possível integração de outras localizações tumorais no “cabaz de cancros rastreáveis”,
- o estudo de intervenções, passivas ou activas, de diminuição da morbilidade psicológica,
- o reforço da informação dos utentes,
- a formulação de critérios eficazes de estratificação de risco para rastreio de populações de alto-risco.
Serão aspectos que, forçosamente, veremos desenvolver num futuro mais ou menos distante.