Introdução
O hipertiroidismo é um distúrbio patológico no qual ocorre uma síntese e secreção inapropriadamente elevadas de hormonas tiroideias (HT) pela glândula tiroideia.1-2
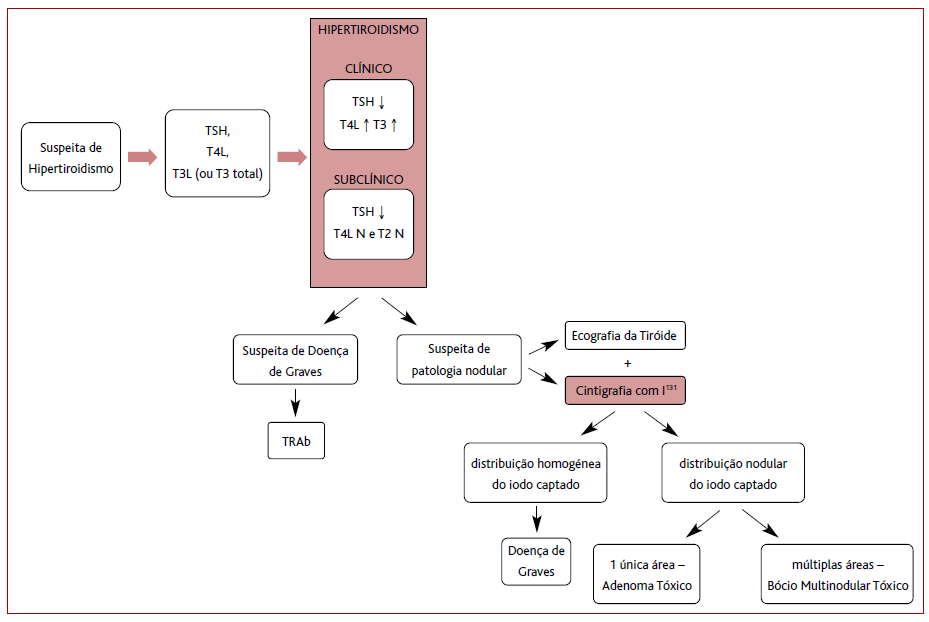
O hipertiroidismo pode ser clínico ou subclínico.1 O hipertiroidismo manifesto ou clínico é caracterizado por uma concentração sérica de TSH (hormona estimulante da tiroide) muito reduzida ou indetetável, com concentrações séricas elevadas das hormonas tiroideias: tiroxina ou tetraiodotironina (T4), triiodotironina (T3) ou ambas.1 O hipertiroidismo subclínico é caracterizado por concentrações séricas de TSH muito reduzidas, mas com concentrações de T4 e T3 normais.3
A tireotoxicose é a síndroma clínica caracterizada pelo excesso de HT em circulação, independentemente da origem, por exemplo, através da ingestão sub-reptícia de T4L (tiroxina livre).2
Métodos
Foi realizada uma revisão da literatura, através de pesquisa nas bases de dados eletrónicas PubMed, UpToDate e Cochrane Library. A pesquisa incluiu linhas de orientação internacionais e nacionais, artigos de revisão e casos clínicos sobre hipertiroidismo. Nesta revisão foram incluídos os artigos científicos com data de publicação até dez anos, sendo a pesquisa realizada entre março de 2018 e janeiro de 2019.
Os termos de pesquisa utilizados incluíram a nomenclatura MeSH: thyroid, hyperthyroidism, Graves disease, multinodular goiter e antithyroid agents.
Resultados
Epidemiologia
A prevalência global de hipertiroidismo é de 0,8% na Europa, com uma prevalência de hipertiroidismo clínico que varia entre 0,5 e 0,8%.4 Embora existam poucos dados sobre as diferenças étnicas, tipicamente o hipertiroidismo é mais frequente entre caucasianos, sendo a sua prevalência superior com o avançar da idade.4 A incidência de hipertiroidismo subclínico é mais elevada em zonas geográficas pobres em iodo.4
Etiologia
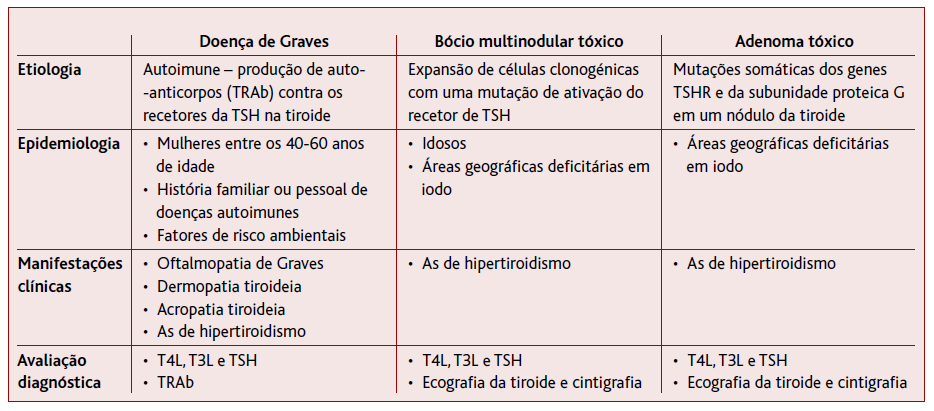
A causa mais comum de hipertiroidismo é a doença de Graves, seguida pelo bócio multinodular tóxico e pelo adenoma tóxico (Tabela 1).1-2
Doença de Graves
A doença de Graves (DG) é a causa mais frequente de hipertiroidismo em áreas geográficas com ingestão suficiente de iodo.4-6 Embora possa afetar indivíduos de qualquer idade, é mais frequente em mulheres entre os 40 e os 60 anos de idade e em pessoas com história pessoal ou familiar de doenças autoimunes.2,5
A DG resulta de interações complexas entre fatores genéticos e ambientais.3 No seu conjunto, os fatores genéticos contribuem para 80% do risco de desenvolver a doença, enquanto os restantes 20% estão associados com fatores de risco ambientais, nomeadamente tabagismo, gravidez, hormonas sexuais, stress, infeções e ingestão adequada de iodo.5
Trata-se uma doença autoimune, provocada pela produção de autoanticorpos contra os recetores da TSH na tiroide.1-2 Estes anticorpos - TRAb (thyroid stimulating hormone receptor antibody) - ligam-se aos recetores de TSH na superfície das células foliculares da tiroide, ativando-os e estimulando a síntese descontrolada e excessiva de T4 e T3 e a hipertrofia da glândula tiroideia.4-6 A determinação dos níveis sérios de TRAb permite confirmar com elevada sensibilidade e especificidade que a DG é a causa do hipertiroidismo.5 A pesquisa de outros anticorpos, nomeadamente contra a tireoglobluina e contra a peroxidase da tiroide (TPO) é desnecessária, uma vez que podem ser encontrados quer na DG como em outras etiologias, designadamente na tiroidite de Hashimoto.5
A DG está associada a um conjunto de manifestações extra-tiroideias patognómicas, nomeadamente a oftalmopatia de Graves, a dermopatia tiroideia e a acropatia tiroideia, que ocorrem em 25%, 1,5% e 0,3% dos pacientes, respetivamente.2,5,8 A oftalmopatia de Graves manifesta-se frequentemente com diplopia, edema periorbital, dor retro-orbitária e exoftalmia.2,4 A dermopatia tiroideia é uma rara manifestação da DG, coexistindo quase sempre com a oftalmopatia tiroideia (ocorre em 1-4% dos pacientes com oftalmopatia) e caracteriza-se por espessamento cutâneo e hiperpigmentação da pele, principalmente na zona pré-tibial.2,4 A acropatia é a mais rara das manifestações extra-tiroideias da DG e apresenta-se com baqueteamento dos dedos das mãos e dos pés.4 Quando estes sintomas característicos ocorrem em conjunto com hipertiroidismo e bócio difuso, o diagnóstico de DG é quase imediato.5
A DG é particularmente difícil de diagnosticar em pacientes idosos, faixa etária em que o hipertiroidismo está associado frequentemente a incipientes sintomas e sinais.5 Existem também pacientes com oftalmopatia de Graves que clinicamente não apresentam hipertiroidismo, designada por doença de Graves eutiroideia ou doença oftálmica eutiroideia, situação rara, que em muitas circunstâncias é precursora de DG clássica ao fim de meses a anos de oftalmopatia.5,9
Bócio multinodular tóxico
O bócio multinodular tóxico (BMT) é a segunda causa mais frequente de hipertiroidismo nos EUA e a primeira em idosos que residem em áreas geográficas deficitárias em iodo.2 É uma patologia pouco frequente em idade pediátrica, a sua prevalência aumenta com o envelhecimento e na presença de um padrão alimentar com conteúdo reduzido em iodo.1,7
Os nódulos tiroideus são um achado incidental frequente em pessoas assintomáticas, com uma incidência entre 9,4% e 27,0%.7 O diagnóstico de BMT deve ser excluído sempre que os achados do exame objetivo ou de exames de imagem sejam compatíveis com doença nodular da tiroide.7
Os nódulos surgem a partir da replicação frequente de células clonogénicas que transportam em si uma mutação de ativação somática dos recetores de TSH na tiroide.2
No diagnóstico de BMT, a primeira linha de investigação deve incluir uma determinação de TSH e uma ecografia da glândula para avaliar as características dos nódulos.7 Na presença de um doseamento de TSH reduzido, a cintigrafia da tiroide esta recomendada para distinguir entre nódulos hiperfuncionantes (nódulos quentes) ou hipofuncionantes (nódulos frios).6-7
Na presença de nódulos frios é necessário excluir doença maligna, principalmente se existir um nódulo de grande volume, o que aumenta a probabilidade de malignidade.7
Adenoma tóxico
O adenoma tóxico (AT) é um nódulo tiroideu único, de funcionamento autónomo, responsável pela síntese excessiva e descontrolada de HT independentemente do estímulo da TSH.10 Mutações somáticas dos genes TSHR (recetor da TSH) e da subunidade proteica G provocam a ativação constitutiva do recetor de TSH e provocam o crescimento do adenoma e a produção descontrolada de HT.11
No AT, ao contrário do que se passa na DG e em outras causas autoimunes, analiticamente não se verifica a presença de anticorpos (nem TRAb nem TPO) que se liguem ao recetor de TSH na glândula tiroideia.10
Manifestações clínicas e complicações
As manifestações clínicas do hipertiroidismo podem ir desde o estado assintomático até à tempestade tiroideia (Tabela 2).2
Tabela 2 Sinais e sintomas do hipertiroidismo
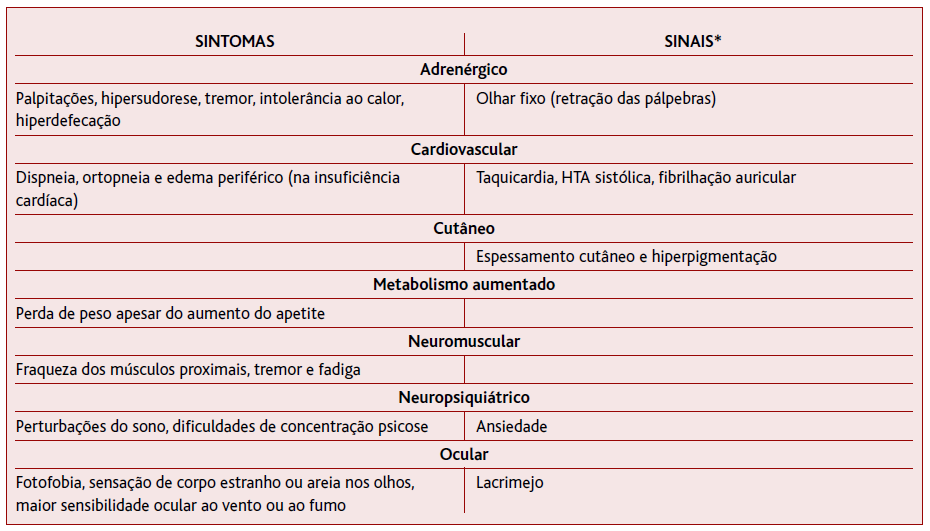
*Exclui os sinais de oftalmopatia, dermopatia e acropatia específicos da doença de Graves.
As HT influenciam quase todos os tecidos e órgãos do corpo humano, tendo um papel regulador em muitas funções fisiológicas.1,4 A elevação das HT aumenta a termogénese dos tecidos e a taxa metabólica basal, reduz os níveis de colesterol sérico e diminui a resistência vascular sistémica.1 No entanto, existe apenas uma moderada correlação entre o grau de elevação das HT e os sinais e sintomas clínicos resultantes desse excesso.1
Elevados níveis de hormonas tiroideias amplificam a sinalização de catecolaminas, através do aumento do número de recetores beta-adrenérgicos na superfície das células.2 Em resultado dessa estimulação surgem os sintomas adrenérgicos, nomeadamente palpitações, intolerância ao calor, hipersudorese, tremor, olhar fixo (provocado pela retração das pálpebras) e hiperdefecação.2
O metabolismo aumentado provoca perda de peso apesar do aumento de apetite, e os sintomas neuromusculares incluem fraqueza dos músculos proximais, tremor, fadiga, perturbações do sono e dificuldades de concentração.2,4 Outras manifestações incluem dispneia, polidipsia náuseas e vómitos e irregularidades menstruais.4 Os sintomas psiquiátricos variam de ansiedade a psicose franca.2
Outra complicação grave associada ao hipertiroidismo é a paralisia periódica tireotóxica, mais prevalente no continente asiático, caracterizada pela tríade: paralisia muscular, hipocaliémia aguda e tireotoxicose.4
Os pacientes idosos com hipertiroidismo apresentam um menor número de sintomas e menos evidentes; no entanto, estão mais suscetíveis a complicações cardiovasculares.4,13 Comparativamente com indivíduos da mesma faixa etária sem patologia da tiroide, os doentes com hipertiroidismo e idade superior a 60 anos têm um risco três vezes superior de desenvolver fibrilhação auricular, assim como um risco aumentado de eventos embólicos secundários à fibrilhação auricular.4
Pacientes com hipertiroidismo de longa-duração não tratado podem desenvolver hipertensão arterial sistólica, fibrilhação auricular (10 a 15% dos pacientes) ou insuficiência cardíaca (5,8% dos pacientes), para além de osteoporose e anormalidades do sistema reprodutor, designadamente ginecomastia nos homens e diminuição da fertilidade nas mulheres.2,4,13
Em doentes com hipertiroidismo verificou-se um risco aumentado de mortalidade por todas as causas, sendo a insuficiência cardíaca a principal responsável por eventos cardiovasculares.2,4
Diagnóstico
Ao examinar o paciente com hipótese diagnóstica de hipertiroidismo deve ser realizada uma história clínica detalhada e exame objetivo que inclua: determinação da frequência cardíaca, pressão arterial, frequência respiratória e peso corporal e avaliação da glândula tiroideia (tamanho, sensibilidade, simetria e presença de nódulos).1,13 É também importante avaliar a função pulmonar, cardíaca e neuromuscular, assim como a presença ou ausência de edemas periféricos, sinais oculares ou mixedema pré-tibial.1
Na suspeita de hipertiroidismo, a avaliação laboratorial inicial deve incluir a determinação dos níveis séricos de T4 livre (T4L), de T3 livre (ou T3 total) e de TSH.5 Embora a determinação de T4L em concentrações séricas elevadas com uma concentração de TSH diminuída confirme o diagnóstico, em cerca 2-4% dos pacientes com hipertiroidismo os níveis de T4L são normais, com elevação apenas dos níveis de T3 livre ou de T3 total, o que se designa por tireotoxicose de T3.5
Os restantes exames de diagnóstico são selecionados em função da hipótese etiológica mais provável, nomeadamente determinar os níveis de TRAb na suspeita de DG (Figura 1).1
A cintigrafia com iodo radioativo (I131) é um meio complementar de diagnóstico importante no diagnóstico diferencial do hipertiroidismo.2 A percentagem de I131 captado pela glândula tiroideia é elevada na DG, no BMT e no AT, enquanto que na tiroidite a captação de iodo é muito reduzida (entre 0 a 2%).2 Uma distribuição homogénea do iodo captado é compatível com DG, sendo uma acumulação de I131 numa única área indicativo de AT ou em múltiplas áreas de BMT.2,14
A ecografia da tiroide é um exame custo-efetivo e está recomendada na confirmação de patologia nodular da tiroide.6 É uma alternativa segura à cintigrafia da tiroide, constituindo o exame de primeira linha diagnóstica durante a gravidez, amamentação e na tireotoxicose induzida por amiodarona.2 A ecografia da tiroide com Doppler a cores é uma técnica de imagem útil para distinguir variantes nodulares da DG de BMT não-autoimune e de tiroidite de Hashimoto.5
Tratamento
A escolha da modalidade terapêutica para o hipertiroidismo depende da entidade etiológica, idade do paciente, sintomas, comorbilidades e preferências pessoais.2,7,13 Existem três opções no tratamento do hipertiroidismo: fármacos antitiroideus de síntese, ablação com iodo radioativo e cirurgia.1,4 É recomendado o tratamento em todos os pacientes que apresentem sintomas de hipertiroidismo.1
Em pacientes com hipertiroidismo sintomático, independentemente da etiologia, é recomendado o tratamento com beta-bloqueantes, especialmente com idade superior a 65 anos, frequência cardíaca em repouso superior a 90 batimentos por minuto ou coexistência de doença cardiovascular.1 Os beta-bloqueantes de primeira linha são o atenolol e o propanolol.2 O propanolol (em doses de 10-40mg, administrado três a quatro vezes por dia) é um beta-bloqueante não-seletivo, sendo o agente preferido em mulheres grávidas e a amamentar.1-2 O atenolol (em doses de 25-100mg, administrado uma a duas vezes por dia) apresenta uma relativa seletividade (bloqueia apenas os recetores β-1), menos efeitos adversos e maior adesão terapêutica, mas está contraindicado durante a gravidez.1
No caso do propanolol, para além de diminuir sintomas de hipertiroidismo, como palpitações e tremor, tem a vantagem adicional de diminuir a conversão periférica de tiroxina em triiodotironina, sendo esta última a hormona biologicamente ativa.15
Nas situações de hipertiroidismo subclínico devem ser tratados todos os doentes com TSH < 0,1mU/L.1,14 Nas situações de hipertiroidismo subclínico, com níveis de TSH entre 0,1 e 0,4mU/L (sendo 0,4mU/L o limite inferior do normal), o tratamento está recomendado em: todos os indivíduos de idade igual ou superior a 65 anos; pacientes com fatores de risco cardiovasculares, doença cardíaca ou osteoporose; e mulheres na pós-menopausa, sem terapêutica com estrogénios ou bifosfonatos instituída.1
A utilização de fármacos antitiroideus de síntese constitui um tratamento conservador, sem exposição a radiação, com risco reduzido de hipotiroidismo subsequente ao tratamento, sem efeitos adversos na oftalmopatia de Graves e que pode ser realizada com segurança durante a gravidez e o aleitamento materno.5,12 Contudo, tem como desvantagens uma elevada taxa de recidiva, necessita de monitorização clínica frequente, está associada a efeitos adversos e os pacientes demonstram uma fraca adesão ao esquema terapêutico.5,7
O metimazol é o fármaco antitiroideu de primeira linha, exceto durante o primeiro trimestre de gravidez.2,5 O metimazol é introduzido em esquema de titulação na dose inicial de 5-40mg diários, por via oral, em toma única ou em doses fracionadas.1-2 Sendo o objetivo determinar qual a dose de metimazol que permite a normalização da função tiroideia, as guidelines da American Thyroid Association sugerem uma dosagem inicial diária de metimazol de: 5 a 10mg para níveis de T4L entre 1-1,5 vezes o limite superior do normal; 10 a 20mg para níveis de T4L entre 1,5-2 vezes o limite superior do normal; e 30-40mg para níveis de T4L entre 2-3 vezes o limite superior do normal.1,7 O esquema terapêutico deve ser ajustado para cada paciente, com monitorização dos níveis séricos de T4L e T3 total a cada duas a seis semanas após iniciado o metimazol.1-3 Uma vez alcançado o eutiroidismo, a avaliação clínica e laboratorial pode ser realizada em intervalos de dois a três meses e em pacientes sob terapêutica de longa duração a monitorização pode ser alargada para intervalos de seis meses.1
O propiltiouracilo (PTU) é o fármaco antitiroideu de segunda linha, apresentando uma duração de ação mais reduzida e um risco superior de efeitos adversos comparativamente ao metimazol.1,5 O esquema terapêutico é habitualmente iniciado com 50-150mg de PTU administrado duas a três vezes por dia até ao restabelecimento da função tiroideia normal.1 Geralmente, a dose de manutenção de PTU situa-se nos 50mg diários divididos em duas a três tomas.1 No primeiro trimestre de gravidez é o antitiroideu de eleição devido ao risco de embriopatias associado ao metimazol.5
Relativamente à utilização de radioterapia com iodo radioativo (I131) constitui um tratamento definitivo, mas acarreta, como consequências, hipotiroidismo crónico, exposição a radiação e controlo moroso do hipertiroidismo.5-6
A possível progressão ou ocorrência de novo de oftalmopatia de Graves verifica-se quer com a utilização dos fármacos antitiroideus de síntese como após a radioterapia com iodo radioativo.16 Embora o mecanismo fisiopatológico que provoca o surgimento ou exacerbação da oftalmopatia de Graves pós-tratamento não seja inteiramente compreendido, o seu desenvolvimento relaciona-se com as concentrações séricas de HT ao longo do tempo.16 O agravamento da oftalmopatia de Graves foi demonstrado como sendo mais provável em pacientes com níveis séricos de HT mais elevados, relativamente aos pacientes com hipertiroidismo diagnosticado precocemente e em eutiroidismo aquando do tratamento.16
A tiroidectomia apresenta como vantagem o facto de possibilitar um tratamento definitivo, sem exposição a radiação e com controlo imediato do hipertiroidismo.10 No entanto, também se traduz em hipotiroidismo durante toda a vida do doente e a necessidade de uma intervenção cirúrgica, com a possibilidade de eventos adversos associados.5 Por isso, raramente é utilizada como primeira linha de tratamento em qualquer região do globo.5
O tratamento da DG incluiu a utilização de fármacos antitiroideus de síntese, a radioterapia com iodo radioativo (I131) e a remoção cirúrgica da tiroide.5,8 Na Europa, a abordagem farmacológica é frequentemente a primeira linha no tratamento da DG, enquanto nos EUA o Iodo radioativo é a opção preferida.5,12 Ao contrário do BMT, a remissão da DG ligeira foi reportada em séries americanas em até 30% dos casos.1
O BMT uma doença progressiva (exceto se for desencadeado pelo excesso de ingestão de iodo), que raramente entra em remissão.4 Por esse motivo, é indicada a radioterapia com iodo ou tiroidectomia para o seu tratamento definitivo.4,12 No entanto, os fármacos antitiroideus de síntese são necessários para restaurar o eutiroidismo antes das intervenções definitivas e, menos frequentemente, são utilizados como terapêutica de longo-prazo em doentes com contra-indicações para os tratamentos definitivos ou com uma esperança de vida reduzida.4 A tiroidectomia é a opção preferida se o bócio provoca sintomas compressivos, como sensação de globo, disfagia ou ortopneia.2,4
Os fármacos antitiroideus de síntese podem controlar o hipertiroidismo, mas não induzem a sua remissão, pelo que a radioterapia com iodo ou a tiroidectomia são as principais opções de tratamento para o AT.2,14 Em doentes selecionados, quer por contraindicação para a tiroidectomia ou por recusarem o tratamento com iodo radioativo, os antitiroideus de síntese de síntese podem ser usados como tratamento a longo-prazo.2
O tratamento com iodo radioativo é uma das opções de tratamento no AT e na DG; no entanto, as doses do radiofármaco e os objetivos são diferentes.10,12 No AT, o objetivo é eliminar o tecido tiroideu autónomo e reestabelecer o eutiroidismo, com taxas reduzidas de hipotiroidismo pós-radiação, enquanto na DG o tecido tiroideu é virtualmente e totalmente eliminado, sendo expectável o hipotiroidismo pós-radiação, com necessidade de administração de levotiroxina para o resto da vida.10,14
Conclusões
Apesar de múltiplas etiologias, as causas mais comum de hipertiroidismo são a doença de Graves, o bócio multinodular tóxico e o adenoma tóxico. Os exames complementares de diagnóstico são selecionados em função da hipótese etiológica mais provável. Apesar da utilidade da determinação dos níveis sérios de TRAb no diagnóstico da doença de Graves, trata-se de um exame não comparticipado no âmbito dos cuidados de saúde primários. Existem três opções no tratamento do hipertiroidismo: fármacos antitiroideus de síntese, ablação com iodo radioativo e cirurgia. É fundamental realizar um diagnóstico correto da etiologia responsável pelo hipertiroidismo, uma vez que a abordagem terapêutica depende da etiologia, mas também da idade do paciente, sintomas, existência de comorbilidades e preferências pessoais.