Introdução
O iodo é um oligoelemento fundamental para a síntese das hormonas tiroideias triiodotironina (T3) e tiroxina (T4), sendo essencial à vida.1 As hormonas da tiroide são fundamentais para o desenvolvimento de vários órgãos, nomeadamente o cérebro, para o crescimento e para a regulação de funções tão importantes como a frequência cardíaca e temperatura corporal. (2 A tiroide concentra 70-80% do iodo disponível no organismo, pelo que a depleção de iodo é a principal causa de patologia tiroideia. (3
Já em 1999 a Organização Mundial da Saúde (OMS) estimou que 130 dos 191 Estados-membros tinham um problema significativo de perturbações por défice de iodo e que aproximadamente 740 milhões de pessoas sofriam de bócio - 13% da população total do mundo. (4 Em 2004 estimou-se que dois mil milhões de pessoas em todo o mundo tinham risco de deficiência de iodo e 20% viviam na Europa. (5
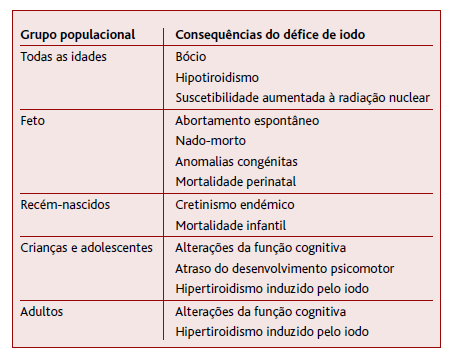
Segundo a OMS, a deficiência de iodo é a causa evitável mais importante de dano cerebral. (6 Pessoas que vivem em áreas com deficiência severa de iodo podem ter um quociente de inteligência (QI) até 13,6 pontos abaixo das comunidades sem deficiência. Por outro lado, as perturbações por défice de iodo (Tabela 1) estão entre os distúrbios nutricionais menos dispendiosos e mais fáceis de prevenir. (6 Em 1993, a OMS e a United Nations Children’s Fund (UNICEF) recomendaram a iodização universal do sal como a principal estratégia para eliminar as perturbações por défice de iodo. (6
Nos anos 70-80 foram realizados os primeiros estudos em regiões com deficiência severa de iodo, nomeadamente na Nova Guiné, (7 no Zaire (atual República Democrática do Congo) (8 e no Peru. (9 Estes associaram a suplementação de iodo à diminuição da prevalência de cretinismo, melhoria do desenvolvimento psicomotor e aumento do QI. Embora a deficiência severa de iodo nas grávidas seja atualmente rara na maioria dos países, a deficiência moderada durante a gravidez continua a ser um problema comum. (10
Sabe-se que os primeiros mil dias de vida (incluem a conceção e os primeiros dois anos de vida) correspondem ao período crítico de desenvolvimento da criança, com maior impacto na saúde futura. (11 No que concerne ao iodo, este tem um papel fundamental na síntese de hormonas tiroideias e no crescimento e desenvolvimento cerebral durante a vida fetal e os primeiros anos de vida. (12 Por isso, a deficiência de iodo pode originar inadequado desenvolvimento cognitivo, comportamental e, no extremo, pode resultar em cretinismo da criança. (6 O feto só consegue sintetizar hormonas tiroideias de uma forma significativa a partir das vinte semanas de gestação, dependendo do aporte materno de iodo até esta altura. (13
Em Portugal, a Direção-Geral da Saúde (DGS) emitiu a Orientação n.o 011/2013, de 26/08/2013, “Aporte de iodo em mulheres na preconceção, gravidez e amamentação”, (12 que recomenda a suplementação de iodo com 150 a 200 μg/dia, sob a forma de iodeto de potássio, a mulheres em preconceção, grávidas ou em amamentação, desde o período pré-concecional até ao fim do aleitamento materno exclusivo, o que se tornou numa prática clínica comum em Portugal desde então. No entanto, esta orientação baseia-se em estudos cujos outcomes são a medição de iodúria e a função tiroideia. Numa amostra de 3.631 grávidas, em dezassete maternidades do interior, litoral e regiões autónomas de Portugal, verificou-se que o aporte de iodo era insuficiente em 83% das grávidas do Continente, (14 92% da Madeira e 99% dos Açores, (15 de acordo com as recomendações da OMS. Noutro estudo, realizado na região do Minho em mulheres em idade fértil e grávidas, estas também apresentavam deficiência de iodo com uma mediana de excreção de iodo urinário < 75 μg/L. (16 Verificou-se também a existência de bócio em 14% das grávidas. Num outro estudo, na mesma região, o perfil das hormonas tiroideias durante a gravidez não era o adequado para suprir as necessidades do feto. (17 Contudo, não existe referência a estudos originais que demonstrem a mais-valia da suplementação, quer durante a gravidez quer no desenvolvimento do bebé, ou seja, que tenham como resultados o impacto na qualidade e quantidade de vida da grávida ou do bebé.
Assim, existe uma lacuna em termos de conhecimento sobre o efeito da deficiência leve de iodo durante a gravidez e os seus potenciais efeitos negativos no desenvolvimento neuropsicológico da criança, (18 uma vez que os estudos previamente realizados avaliaram a iodúria ou a função tiroideia e não resultados clínicos com interesse para o doente, como a mortalidade perinatal, o crescimento e desenvolvimento, QI, desempenho escolar e a prevalência de perturbação de hiperatividade e défice de atenção (PHDA).
Desta forma, torna-se importante rever a literatura médica para determinar se a suplementação de iodo tem impacto em resultados clínicos, mais do que em surrogate endpoints, uma vez que a deficiência de iodo poderá afetar o neurodesenvolvimento mesmo com função tiroideia normal. (18
Métodos
Esta revisão foi redigida segundo a metodologia de revisão baseada na evidência, recorrendo à análise de normas de orientação clínica (NOC), revisões sistemáticas, meta-análises e ensaios clínicos aleatorizados e controlados (randomized controlled trial - RCT) indexados nas bases de dados National Institute for Health and Care Excellence, Agency for Healthcare Research and Quality, Canadian Medical Association Practice Guidelines Infobase, The Cochrane Library, Database of Abstracts of Reviews of Effectiveness, Bandolier, Evidence Based Medicine Online e PubMed. Foram utilizados para a pesquisa os termos MeSH iodine e pregnancy.
Incluíram-se artigos com data de publicação igual ou posterior ao ano 2000 e escritos em língua inglesa ou portuguesa. Foram excluídos estudos cujas participantes tinham patologia tiroideia, o feto apresentava malformações graves ou a criança tinha patologia que comprometesse a função neurocognitiva.
A pergunta de investigação formulada, segundo a estratégia PICO, tem como: População - grávidas; Intervenção - suplementação de iodo; Comparação - placebo ou sem suplementação; Outcomes - impacto no desenvolvimento neurocognitivo da criança, na gravidez e na mortalidade e crescimento infantil.
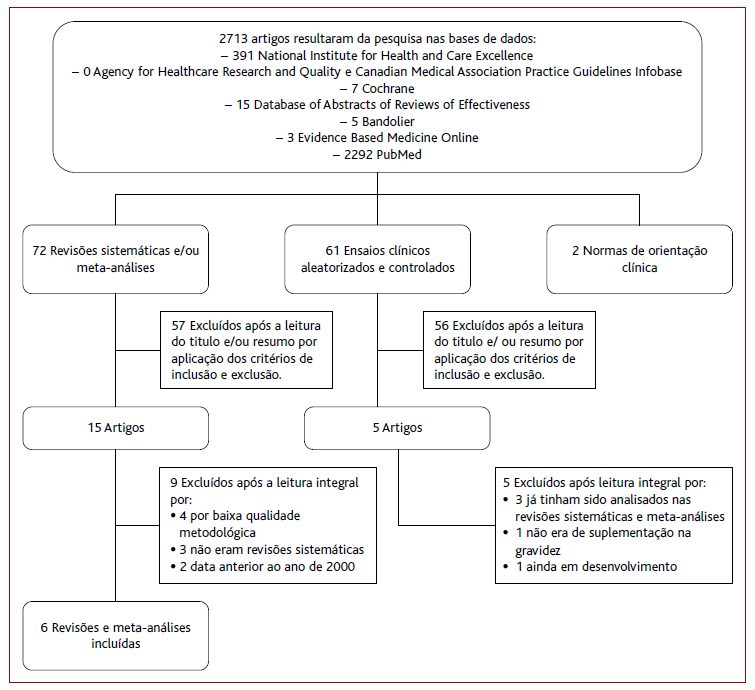
A seleção dos artigos foi feita de forma sequencial (Figura 1). A pesquisa inicial resultou em 2.713 artigos, que inicialmente foram triados pela leitura do título e/ou resumo. Foram excluídos 2.578 artigos por não se enquadrarem no objetivo, não cumprirem os critérios de inclusão ou serem repetidos, tendo sido obtidos 72 revisões sistemáticas/meta-análises, 61 RCT e duas NOC. Posteriormente procedeu-se à leitura integral dos artigos e discussão dos resultados que cumprem o objetivo desta revisão. Os RCT foram excluídos por não conterem suplementação durante a gravidez, por se encontrarem em desenvolvimento ou já terem sido analisados nas revisões sistemáticas/meta-análises. No final foram incluídos seis artigos (revisões sistemáticas e meta-análises) e duas NOC.
Resultados
Normas de orientação clínica (Tabela 2)
A American Thyroid Association19 recomenda a suplementação de iodo durante a gravidez e lactação com 150 µg/dia; idealmente as mulheres que planeiam engravidar devem iniciar esta suplementação três meses antes. Em regiões ou países onde o sal iodado e a suplementação diária de iodo não são acessíveis deve ser administrada uma dose anual de 400 mg de óleo iodado a grávidas e mulheres em idade fértil. Esta norma usou o American College of Physicians Grading System e classificou a primeira recomendação com força de recomendação forte e evidência de qualidade moderada, o que significa que se pode aplicar à maioria dos pacientes na maioria das circunstâncias, sem reservas. A segunda recomendação foi classificada com força de recomendação fraca e evidência de qualidade moderada, o que significa que a melhor ação pode diferir, com base nas circunstâncias ou nos valores dos pacientes.
A Endocrine Society20 recomenda a suplementação de iodo antes da conceção e durante a gravidez com 150-200 µg/dia. A evidência e força de recomendação foram classificadas pelo Sistema USPSTF (United States Preventive Services Task Force) em fair e B, respetivamente, e pelo Sistema GRADE (Grades of Recommendation Assessment, Development and Evaluation) com qualidade baixa e recomendação 2 (fraca).
Revisões sistemáticas e meta-análises (Tabela 3)
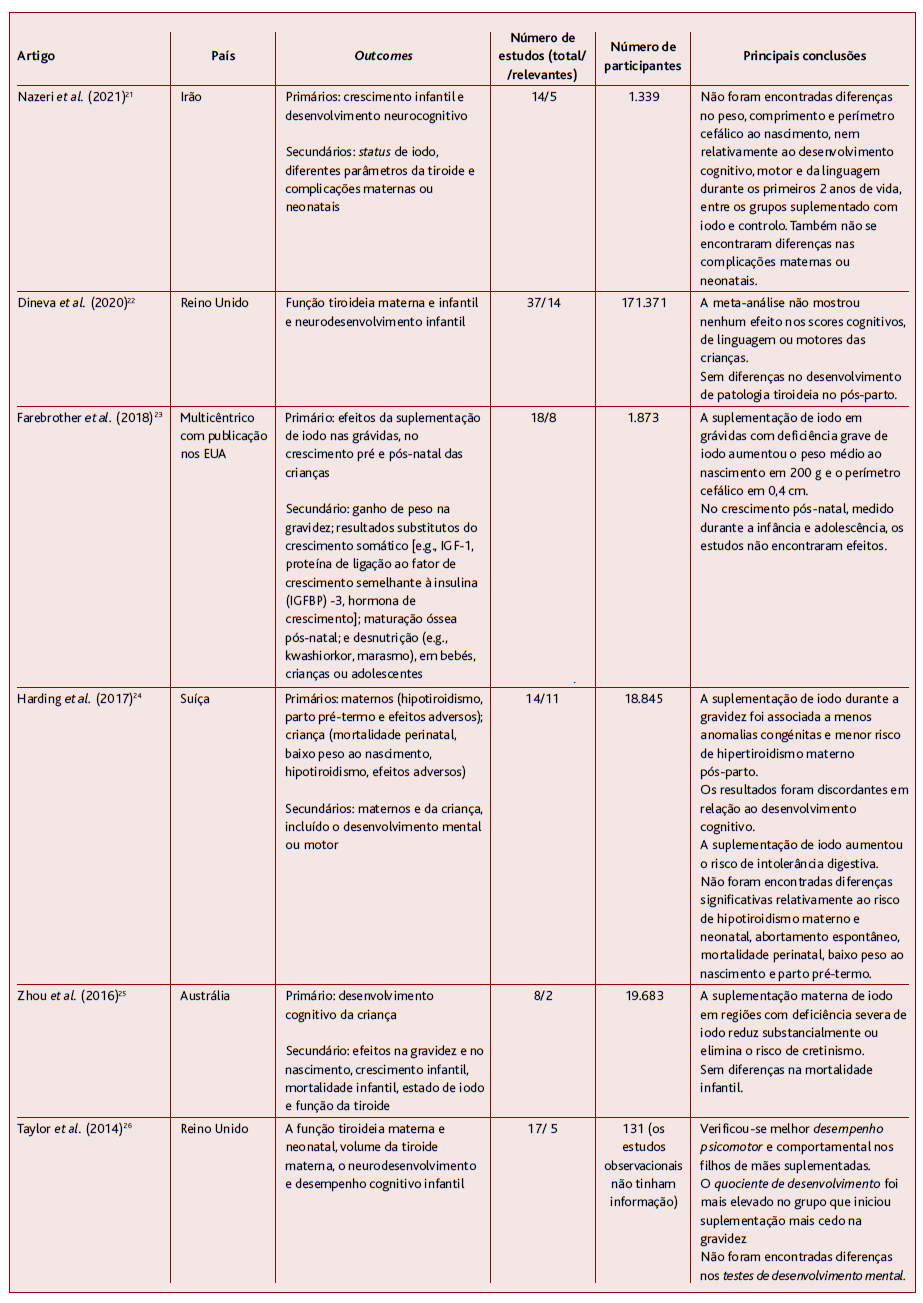
A revisão de Nazeri e colaboradores, de 2021, (21 teve como objetivo analisar os efeitos da suplementação de iodo na gravidez, no crescimento infantil e no desenvolvimento neurocognitivo. Catorze estudos foram incluídos na revisão sistemática, dos quais cinco estudos foram incluídos na meta-análise (1.339 participantes). Na meta-análise não foram encontradas diferenças no peso, comprimento e perímetro cefálico ao nascimento, nem relativamente ao desenvolvimento cognitivo, motor e da linguagem durante os primeiros dois anos de vida entre os grupos suplementados com iodo e controlo em áreas com deficiência leve. Foram também relatadas complicações maternas e neonatais em alguns estudos, mas a frequência destas não diferiu entre os grupos.
A revisão de Dineva e colaboradores, de 2020, (22 incluiu 14 estudos (171.371 participantes) que abordaram o neurodesenvolvimento infantil, dos quais três eram RCT que suplementaram as grávidas com 150 ou 200 μg iodo por dia. A meta-análise de dois RCT (59 e 832 participantes) não mostrou nenhum efeito nos scores cognitivos, de linguagem ou motores das crianças cujas mães receberam suplemento de iodo comparativamente com o grupo placebo. Nenhum dos RCT encontrou efeito benéfico ou prejudicial da suplementação materna de iodo no desenvolvimento motor da criança medido entre um e dois anos. Em dois estudos não aleatorizados e/ou inadequadamente controlados houve efeito benéfico da suplementação de iodo (200 ou 300 μg/dia) no desenvolvimento motor aos 1,5 anos. O desenvolvimento cognitivo e a linguagem aos um-dois anos, QI, velocidade de processamento, função executiva global e desempenho auditivo aos 5,4 anos não diferiram entre os grupos iodo e controlo. Um estudo de coorte relatou efeito benéfico do iodo, fornecido como sal iodado dois ou mais anos antes da conceção, no QI de crianças dos seis aos doze anos. Não foram encontradas diferenças relativamente ao desenvolvimento, tipo ou gravidade de patologia tiroideia no pós-parto. Dois estudos de intervenção relataram melhor quociente de socialização e um comportamento mais favorável em filhos de mães que receberam suplementação de iodo do que naqueles cujas mães não receberam suplementação durante a gravidez. Por outro lado, num estudo norueguês, os filhos de mulheres com baixa ingestão de iodo (< 160 μg/dia) e que tomaram suplemento de iodo ≤ 200 μg/dia eram mais propensos a ter problemas comportamentais, tiveram maior risco de diagnóstico de PHDA e um score de sintomas de PHDA elevado aos oito anos em comparação com os filhos de mães não suplementadas.
A revisão de Farebrother e colaboradores, de 2018, (23 avaliou os efeitos da fortificação ou suplementação de iodo no crescimento pré (medido pelo peso ao nascimento) e pós-natal. Incluiu oito estudos aleatorizados e não aleatorizados (1.873 participantes) que compararam os efeitos da suplementação de iodo nas grávidas com placebo, sal não iodado ou nenhuma intervenção no crescimento das crianças. A suplementação de iodo em grávidas com deficiência grave de iodo aumentou o peso médio ao nascimento em 200 g, mas a suplementação na deficiência leve e moderada não mostrou efeito no crescimento pré-natal. Um ensaio relatou um aumento de 0,4 cm no perímetro cefálico em regiões com deficiência severa, mas este efeito da suplementação não foi observado na deficiência leve a moderada. Contudo, a meta-análise não encontrou efeito do iodo sobre o peso ao nascimento nem perímetro cefálico. No crescimento pós-natal, medido durante a infância e adolescência, os estudos não mostraram efeito em nenhum dos grupos (deficiência severa, moderada ou leve). Estes foram avaliados com qualidade baixa.
A revisão de Harding e colaboradores, de 2017, (24 incluiu catorze ensaios clínicos controlados e aleatorizados ou quase aleatorizados de suplementação de iodo materno na preconceção, gravidez ou pós-parto. Os resultados considerados incluíram a função tiroideia materna e infantil, mortalidade perinatal, parto prematuro, peso ao nascimento e intolerância digestiva materna. Foram considerados relevantes onze estudos conduzidos entre 1966 e 2011, com 18.845 participantes. A maioria dos estudos usou doses diárias de iodo entre 75-300 μg, mas quatro utilizaram uma dose única de 400-1600 μg por via oral ou injetável. Em dois ensaios verificou-se uma menor frequência de anomalias congénitas (incluindo cretinismo) no grupo iodo. Em três estudos realizados em regiões com deficiência leve a moderada de iodo, a suplementação de iodo durante a gravidez foi associada a uma diminuição do risco de hipertiroidismo materno pós-parto, mas verificaram-se taxas aumentadas de intolerância gastrointestinal. Em dois ensaios a suplementação de iodo foi associada a uma diminuição não significativa do risco de mortalidade perinatal; contudo, todas as mortes neonatais ocorreram num único ensaio realizado numa área com deficiência severa de iodo. Os resultados foram discordantes relativamente ao desenvolvimento cognitivo, mas com efeitos positivos do iodo no desenvolvimento mental em dois ensaios em áreas com deficiência severa. Os riscos de hipotiroidismo materno e neonatal, abortamento espontâneo, baixo peso ao nascimento, parto pré-termo não diferiram entre os grupos suplementado e não suplementado.
A revisão de Zhou e colaboradores, de 2016, (25 incluiu apenas RCT com o objetivo de avaliar a eficácia e segurança da suplementação de iodo durante a gravidez ou no período pré-concecional, no desenvolvimento e crescimento das crianças, em comparação com placebo ou nenhuma suplementação. O resultado primário foi o desenvolvimento cognitivo da criança e os resultados secundários incluíram efeitos na gravidez e no nascimento, crescimento infantil, mortalidade infantil, status de iodo e função da tiroide materna e infantil. Apenas dois RCT, com 16.500 e 3.183 participantes, relataram resultados sobre o desenvolvimento infantil, sendo que um demonstrou claramente que a suplementação materna de iodo em regiões com deficiência severa de iodo reduz substancialmente ou elimina o risco de cretinismo. Os estudos realizados em regiões com deficiência severa não mostraram diferenças na mortalidade infantil nem nos parâmetros ao nascimento (peso, comprimento, perímetro cefálico). Nos seis RCT restantes, conduzidos em regiões com deficiência leve a moderada de iodo, não foram avaliados o desenvolvimento infantil, crescimento nem efeitos na gravidez.
A revisão de Taylor e colaboradores, de 2014, (26 analisou sete RCT e oito estudos observacionais de suplementação de iodo em mulheres grávidas em regiões com deficiência leve a moderada de iodo. Os resultados considerados incluíram a função tiroideia materna e neonatal, volume da tiroide materna, bem como o neurodesenvolvimento e desempenho cognitivo infantil. Os RCT com suplementação materna foram todos conduzidos na Europa, utilizaram doses orais de iodo entre 50 e 300 µg por dia. Um RCT, com 131 participantes, e quatro estudos observacionais avaliaram os efeitos da suplementação materna de iodo no neurodesenvolvimento infantil entre os seis e os dezoito meses. Nenhum encontrou diferenças nas escalas de desenvolvimento mental, embora não seja explícito que escalas foram usadas. Verificou-se melhor desempenho psicomotor e comportamental nos filhos de mães suplemen-tadas. O quociente de desenvolvimento foi mais elevado no grupo que iniciou suplementação mais cedo na gravidez (quatro a seis semanas). Um estudo de coorte conduzido em Espanha associou a suplementação materna com uma dose ≥ 150 µg/dia a menores índices de desenvolvimento psicomotor em comparação com as mães suplementadas com < 100 µg/dia. Todos os estudos analisados apresentavam qualidade baixa a moderada.
Discussão
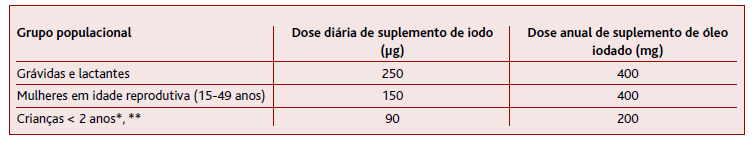
A deficiência de iodo é um problema de saúde pública a nível mundial sobejamente conhecido, que tem sido alvo de medidas para melhorar o estado nutricional de iodo das populações. As grávidas e lactantes são um grupo especialmente afetado pelo défice de iodo, devido ao aumento das necessidades, como verificado em vários estudos através da baixa concentração urinária de iodo. A OMS considera que a iodização universal do sal é a medida mais eficaz para tratar e prevenir a deficiência de iodo. Todavia, enquanto esta medida não abrange 90% das famílias é recomendada a suplementação dos grupos mais vulneráveis - mulheres em idade reprodutiva, grávidas e crianças com menos de dois anos (Tabela 4). (6
Em países com programas eficazes de iodização do sal, embora as crianças em idade escolar apresentem níveis suficientes de iodo alguns estudos indicam que grávidas e lactantes têm níveis inadequados. (27-29 Por isso, apesar desta recomendação, a suplementação dos grupos mais vulneráveis mesmo em regiões onde mais de 90% das famílias usam sal iodado deve ser equacionada, uma vez que este pode nem sempre ser uma fonte suficiente de iodo.
Na pesquisa realizada foram encontradas duas NOC, da American Thyroid Association19 e da Endocrine Society. (20 A primeira recomenda a suplementação de iodo antes da conceção, durante a gravidez e lactação com 150 µg por dia e em regiões ou países onde o sal iodado e a suplementação diária de iodo não são acessíveis a administração de uma dose anual de 400 mg de óleo iodado. A segunda NOC recomenda a suplementação de iodo antes da conceção e durante a gravidez com 150-200 µg por dia. Em Portugal, a recomendação da DGS12 é de suplementar com 150-200 μg/dia em mulheres em preconceção, grávidas ou a amamentar. A OMS6 recomenda a suplementação de grávidas e lactantes com 250 μg de iodo por dia, dependendo da cobertura populacional do sal iodado.
Verificou-se que existem poucas NOC de boa qualidade relativamente a esta suplementação, mas nas NOC atuais existe concordância em suplementar desde a preconceção até ao aleitamento materno exclusivo com doses entre 150-200 µg por dia.
Da análise dos estudos verificou-se que as consequências da deficiência severa de iodo no desenvolvimento neurocognitivo, como o cretinismo e o bócio, estão bem esclarecidas. Os resultados mostraram, de forma consistente, efeitos positivos do iodo (e.g., na eliminação do cretinismo ou no aumento do QI) em regiões com deficiência severa de iodo. (24-25 Contudo, os estudos apresentaram resultados divergentes relativamente ao desenvolvimento neurocognitivo em áreas com deficiência leve a moderada. A revisão de Taylor e colaboradores26 concluiu que a suplementação de iodo, na deficiência leve a moderada, tem efeitos benéficos com melhor desenvolvimento psicomotor e comportamental. Por outro lado, outras revisões e meta-análises não encontraram efeito no desenvolvimento cognitivo, (26 motor, de linguagem ou comportamento. (21-22
Atualmente, a deficiência severa de iodo não é frequente na Europa, existindo ainda dúvidas sobre os efeitos adversos mais subtis no neurodesenvolvimento dado o número reduzido de ensaios clínicos que avaliem os efeitos da suplementação da grávida no desenvolvimento cognitivo da descendência. O estudo Swedish Iodine in Pregnancy and Development in Children18 pode ajudar a esclarecer esta questão no futuro, uma vez que se propõe analisar o desenvolvimento neuropsicológico das crianças até aos catorze anos, cujas mães foram suplementadas durante a gravidez num país com provável deficiência leve de iodo.
Numa revisão sistemática que analisou os diferentes tempos de iniciação da suplementação de iodo, os estudos incluídos apontaram para os benefícios da suplementação precoce. (26 Crianças cujas mães foram suplementadas na preconceção ou no início da gravidez apresentaram melhores resultados nos testes de desenvolvimento cognitivo. Contudo, nenhum dos estudos foi desenhado como RCT.
Os estudos que analisaram a mortalidade perinatal e infantil não encontram diferenças entre os grupos suplementado e não suplementado. (21,24-25 Todos foram considerados de qualidade baixa.
Em relação ao crescimento neonatal, uma revisão apontou haver efeito positivo do iodo no peso e no perímetro cefálico. (23 Estes estudos não eram RCT e apresentavam qualidade muito baixa. Outras revisões não encontraram qualquer efeito. (21,24
Os estudos analisados não mostraram efeitos da suplementação de iodo na gravidez ou complicações maternas (abortamento, parto pré-termo, diabetes gestacional, etc.). (21,24 Apenas um estudo, com baixa qualidade, sugere haver diminuição do risco de hipertiroidismo no pós-parto. (24
As inconsistências nas evidências e a falta de efeitos positivos relativamente ao papel da suplementação de iodo na deficiência leve a moderada podem ser explicadas pelo estado nutricional de iodo materno antes da gravidez, pelas diferenças nas doses e formas de suplementação, pelos diferentes momentos do início da suplementação e o tipo de testes cognitivos usados nos diversos estudos. (22
As reservas de iodo maternas antes da gravidez podem permitir que a tiroide se adapte à baixa ingestão de iodo durante a gravidez e mantenha a função normal, (30 o que pode justificar os resultados/efeitos nulos encontrados em estudos realizados em países com iodização do sal, pela otimização das reservas de iodo antes da gravidez.
O conteúdo de iodo nos alimentos e na água é altamente variável, o que pode influenciar o estado basal de iodo da grávida e influenciar a definição de grupos por grau de deficiência, sendo necessário monitorizar os níveis de iodo e a sua ingestão. (31
Por outro lado, o aumento abrupto da ingestão de iodo em mulheres com ingestão habitualmente baixa pode estar associado a resultados negativos, como foi observado na coorte norueguesa previamente referida. (32-33
As principais formas de suplementação foram com óleo iodado, injetável ou comprimidos de iodeto de potássio. Nesta diferença temos que a suplementação de iodo na forma injetável, em dose única, permite um maior controlo das tomas em relação ao iodeto de potássio por via oral, que tem frequência de ingestão diária.
Alguns estudos suplementaram com iodo em multivitamínicos/minerais, o que dificulta o isolamento do seu efeito do dos outros componentes e pode induzir a confundimento. As doses utilizadas nos ensaios clínicos no grupo suplementado com iodeto potássio variaram entre 150 e 300 µg/dia. Na suplementação de iodo sob a forma de óleo iodado foi administrada uma dose única entre 95 e 1600 mg de iodo, sendo a maioria de 400 e 950 mg.
Relativamente ao grupo controlo, alguns estudos usaram um grupo controlo suplementado (com multivitamínicos/minerais, sal iodado ou doses mais baixas de iodo) em vez de um placebo, o que também dificulta a identificação do efeito de um só nutriente; nomeadamente os estudos espanhol e norueguês que indicaram efeitos negativos. (22
Os métodos de avaliação do neurodesenvolvimento utilizados constituem outro aspeto importante. O desempenho cognitivo de bebés e crianças é afetado pelo seu humor, motivação e quantidade de sono. Fatores ambientais, incluindo a pessoa que conduz os testes, quem está presente durante os mesmos e onde estes são realizados, podem influenciar o desempenho da criança. Além disso, a maioria dos testes cognitivos foi elaborada em países desenvolvidos, baseados nas suas características culturais e, por isso, podem não ser reprodutíveis em crianças de outros países. Na maioria dos estudos foram usados testes de desenvolvimento global (e.g., a Escala de Desenvolvimento Infantil de Bayley) para determinar a capacidade cognitiva geral das crianças. No entanto, estes métodos abrangentes podem detetar apenas efeitos nutricionais altamente significativos. (34 Funções cognitivas específicas (e.g., atenção e memória) são reguladas por mecanismos neuronais distintos, que poderão ser afetados por diferentes alterações nutricionais. (35 Portanto, testes de avaliação cognitiva que analisam capacidades específicas podem ser mais sensíveis para detetar efeitos subtis de intervenções nutricionais na cognição. Além disso, os testes de desenvolvimento global, se conduzidos na infância, podem ter baixa capacidade preditiva para inteligência e comportamento infantil. (36-37 De facto, na coorte espanhola, o efeito negativo no desenvolvimento motor aos doze meses com doses ≥ 150 µg/dia38-39 não foi confirmado aos 4-5 anos. (40 Embora os testes cognitivos possam ter maior validade em idades mais avançadas também existem mais fatores de confundimento. (41
Vários fatores afetam o metabolismo do iodo e a função tiroideia, podendo exacerbar a deficiência de iodo. Deficiências nutricionais, incluindo de ferro e selénio, podem levar à diminuição da produção das hormonas tiroideias, dado que as enzimas envolvidas dependem desses nutrientes. (42 Compostos encontrados naturalmente em alguns alimentos, como na mandioca, sorgo, soja e milho-painço, e em poluentes, como o perclorato e os nitratos, também podem afetar negativamente o metabolismo do iodo e a função da tiroide. (43 Conhecidas como bociogénicos, estas substâncias podem competir com o iodo para ser absorvido pela tiroide. Bebés e crianças parecem ser particularmente vulneráveis aos efeitos dos bociogénicos e os efeitos geralmente são vistos quando se regista deficiência de iodo prévia. (24 Um estudo sugere que um tipo de PCB (policlorobifenilos) tem impacto negativo no neurodesenvolvimento, podendo mitigar o efeito benéfico da suplementação de iodo em zonas com deficiência leve. (44
Em relação aos critérios de inclusão, apesar de só terem sido incluídos artigos a partir do ano 2000 neste trabalho, as revisões sistemáticas e meta-análises analisadas incluíram estudos realizados a partir da década de 60.
A qualidade da maioria dos ensaios clínicos e outros estudos incluídos nas revisões sistemáticas e meta-análises foi considerada muito baixa ou baixa, embora em alguns tenha sido considerada moderada. Os fatores foram vários, como a falta de informação sobre a ocultação, alocação, metodologia de aleatorização dos participantes, os métodos para geração de sequência e ocultação de alocação, ou foi considerado haver alto risco de viés de seleção.
Por outro lado, a heterogeneidade dos estudos nas meta-análises foi quase sempre baixa. Significa que os estudos eram comparáveis, o que aumenta o poder estatístico das meta-análises, constituindo um fator a favor da validade das conclusões.
Apesar de não ser objetivo desta revisão abordar a segurança, este é um assunto que não deve ser subvalorizado. Embora a suplementação de iodo seja geralmente considerada uma intervenção segura para mulheres grávidas, a ingestão excessiva deste nutriente pode ter consequências. Por isso, a suplementação de todas as grávidas, por rotina, pode não ser isenta de riscos, como foi observado nas coortes espanhola38-39 e norueguesa, (32-33 referidas anteriormente. Estas evidências, principalmente de estudos observacionais, são consideradas de fraca qualidade e os efeitos negativos não foram confirmados em nenhum RCT. Noutro estudo verificou-se um aumento do risco de intolerância digestiva em grávidas com deficiência leve a moderada. (45 A qualidade desta evidência foi considerada muito baixa.
Na verdade, poucos ensaios clínicos investigaram os efeitos adversos da suplementação de iodo durante a gravidez, permanecendo a incerteza se a dose recomendada de suplementação de iodo é segura para grávidas que vivem em áreas com iodo suficiente.
A ideia de que os suplementos de iodo na dose recomendada (150-200 µg/dia) são seguros poderá decorrer do facto de que essas doses estão muito abaixo do tolerable upper intake level de 600-1100 µg, (25 mas faltam estudos que o comprovem.
Regita-se um intenso debate sobre se os ensaios com grupo controlo/placebo são éticos, devido à existência de recomendações de suplementação com iodo desde a preconceção até a lactação. (46 Assim, a presença de um grupo de grávidas não suplementadas constitui uma limitação importante nos estudos de intervenção com iodo, dado o conhecimento atual sobre os efeitos potencialmente graves da deficiência de iodo no feto. (26
Conclusões
Na atualidade existem poucos estudos de boa qualidade que avaliem os efeitos da suplementação de iodo durante a gravidez no desenvolvimento neurocognitivo da criança, na gravidez e no feto, principalmente em regiões com deficiência leve a moderada. Por isso, os resultados devem ser interpretados com precaução. Além disso, verificaram-se algumas limitações na validade interna e comparabilidade dos estudos e, portanto, nas conclusões retiradas.
Relativamente aos efeitos maternos e infantis não foram encontrados efeitos importantes, mas os dados eram limitados e os estudos de baixa qualidade.
Considerando a importância potencial das reservas de iodo, estudos futuros devem incluir medidas para avaliar a ingestão de iodo antes da gravidez. Além disso, os ensaios clínicos podem ser melhorados com o uso de testes que meçam competências cognitivas globais e específicas. A escolha do teste cognitivo específico deve ser baseada nos mecanismos neuronais que se espera serem alterados pelo iodo. Para determinar a função cognitiva na infância e adolescência os estudos futuros devem considerar analisar o desempenho escolar.
Em suma, não há evidências de boa qualidade suficientes para apoiar as recomendações atuais de suplementação de iodo durante a gravidez em áreas com deficiência leve a moderada. São necessários RCT bem desenhados e de boa qualidade que esclareçam os potenciais benefícios para o doente (patient oriented evidence that matter) e avaliem a segurança desta suplementação.
Agradecimentos
À Dra. Raquel Braga pelo apoio metodológico, na discussão acerca da seleção dos artigos e na apreciação dos níveis de evidência.