INTRODUÇÃO
A epilepsia é uma doença crónica do foro neurológico, caracterizada por uma predisposição para o surgimento de crises epiléticas - descargas eletro-neuronais anormais desencadeadores de alterações involuntárias no movimento e/ou função corporal, estado de consciência e/ou comportamento - com consequências neurobiológicas, cognitivas, psicológicas e sociais importantes (1). Esta doença afeta cerca de 50 milhões de pessoas em todo o mundo (2), sendo que, a nível nacional, e de acordo com a Liga Portuguesa Contra a Epilepsia (LPCE), estima-se que afete entre 4 a 7 indivíduos por cada mil habitantes, traduzindo-se numa prevalência de 40 a 70 mil casos (3). Ao longo dos próximos anos prevê-se um aumento nesta prevalência, acompanhando o aumento da esperança média de vida, com consequente crescimento na proporção de indivíduos que sobrevivem a doenças potencialmente geradoras de epilepsia, nomeadamente o acidente vascular cerebral (AVC) (4), causa mais comum na génese da epilepsia em adultos (5). Atualmente, o tratamento da epilepsia baseia-se essencialmente no recurso a fármacos antiepiléticos (AED’s), cujo propósito consiste no controlo e/ou diminuição da frequência das crises epiléticas, com uma crescente disponibilização de alternativas farmacológicas (6, 7). Contudo, para além dos benefícios terapêuticos, o uso destes fármacos está diversas vezes associado ao surgimento de efeitos colaterais indesejados (8). Sabe-se que 40-50% dos doentes apresentam efeitos adversos à terapêutica farmacológica, tais como alterações cognitivas e gastrointestinais, modificações do sono, ganho ou perda ponderal, distúrbios hidroeletrolíticos (p.ex.: hiponatremia), entre outros (9). De facto, as escolhas terapêuticas devem ser feitas tendo em conta cada individuo como um caso singular, ponderando-se não só a eficácia farmacológica, mas também os potenciais efeitos adversos do fármaco, nomeadamente aqueles relacionados com o estado nutricional (EN) (8). As alterações ao nível do EN podem ser uma consequência direta da terapia farmacológica na epilepsia, nomeadamente ao nível da alteração no metabolismo de determinados micronutrientes e/ou diminuição na absorção de vitaminas, mas também uma consequência indireta, através das alterações do paladar, ingestão alimentar, ganho ou perda de peso (10). Assim, consequentemente, poderão gerar-se défices de micronutrientes potenciando complicações graves, como por exemplo, osteopenia e/ou osteoporose na ocorrência de défice de vitamina D (11 - 14) ou anemia megalobástica no caso da deficiência de vitamina B12 e/ou vitamina B9 (14, 15). Bem como, agravar-se uma situação de obesidade e/ou até mesmo de desnutrição, no caso de um aumento ou diminuição do apetite e ingestão alimentar, respetivamente (16, 17). Enquanto que as informações sobre as interações entre fármacos são frequentemente reconhecidas pelos profissionais de saúde, informações acerca de interações fármaco- nutriente são muitas vezes esquecidas e raramente mencionadas, embora não sendo menos importantes (8, 18). Nesse sentido, a finalidade deste trabalho é rever e avaliar, com base na literatura científica mais recente existente, as implicações nutricionais inerentes ao uso de fármacos antiepiléticos em doentes com epilepsia, quais os mecanismos subjacentes, bem como as formas de mitigação das possíveis alterações nutricionais.
METODOLOGIA
A presente pesquisa bibliográfica foi realizada nas bases de dados MEDLINE® e Scopus e no motor de busca Google Scholar, com a utilização dos seguintes termos: ”epilepsy”, “antiepileptic pharmacological therapy”, “nutritional status”, “drug-nutrient interaction”, entre março e julho de 2020. Da secção inicial de 79 artigos, apenas 44 foram incluídos nesta revisão cujo título e/ou resumo abordassem questões relacionadas com o tema. Foram excluídos artigos publicados até ao ano de 2000.
Implicações Nutricionais da Terapêutica Farmacológica Antiepilética
Vitamina D
Os fármacos antiepiléticos normalmente são lipossolúveis, para que consigam atravessar a barreira hematoencefálica e exercer a sua ação no sistema nervoso central (SNC). Deste modo, para possibilitar a sua eliminação pelos rins, é necessária a sua conversão, a nível hepático, em metabolitos hidrossolúveis. O sistema hepático é composto por dois subsistemas: um constituído pelas enzimas do retículo endoplasmático (sistema microssomal, que integra o citocromo P450) e outro no citoplasma e nos organelos celulares (sistema não microssomal). A maior parte dos fármacos são metabolizados pelo sistema microssomal hepático (CYP450). Com o intuito de facilitar a eliminação dos fármacos, alguns AED’s apresentam indução metabólica do sistema CYP450 (7).
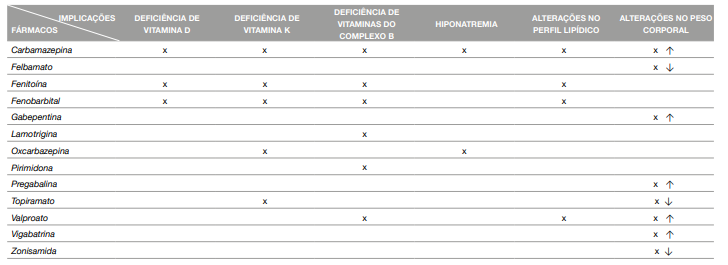
A vitamina D é extensamente metabolizada pelas enzimas do citocromo P450 - CYP2R1 e CYP27B1. Os fármacos antiepiléticos indutores destas enzimas, como a carbamazepina, fenitoína e fenobarbital, promovem a metabolização da vitamina D ativa (calcitriol) em metabolitos menos ativos, levando a uma diminuição dos níveis séricos de vitamina D (19). Sabe-se que a vitamina D é um constituinte essencial na saúde óssea (13) e, portanto, as alterações bioquímicas referidas anteriormente conduzem à remoção do cálcio a nível ósseo (12, 14, 20), resultando numa diminuição da densidade mineral óssea. Estima-se que 20% a 65% dos doentes epiléticos desenvolvem osteopenia e inclusive osteoporose, do mesmo modo que apresentam duas a seis vezes mais fraturas ósseas em comparação com a população em geral (11-14). Além do mais, a deficiência de vitamina D pode contribuir para o metabolismo anormal de glicose, níveis séricos de lípidos irregulares, como também para o desenvolvimento de distúrbios imunológicos (por exemplo, esclerose múltipla), doenças cardiovasculares, neurodegenerativas, e eventualmente algumas neoplasias (especialmente no cólon) (20).
Vitaminas do Complexo B
O uso prolongado de fármacos antiepiléticos também poderá diminuir as concentrações séricas das vitaminas do complexo B (14), nomeadamente a vitamina B1 (21), B2, B6 (22, 23), B7 (21), B9(22-24) e B12 (22 - 24).
O défice de folato está associado, essencialmente, à utilização de fenitoína e carbamazepina, que interferem na sua absorção (8, 22 - 24). Porém, o uso do valproato (8), o fenobarbital, a pirimidona e a lamotrigina (8) também foram associados à deficiência de ácido fólico (21). São vários os mecanismos propostos para explicar a deficiência de folato. Um deles é o facto de a terapêutica farmacológica, particularmente a fenitoína, inibir a folato-conjugase no intestino delgado (8). O folato encontra-se nos alimentos sob a forma de poliglutamatos, porém o nosso organismo apenas absorve na forma de monoglutamatos. Deste modo, é necessário haver hidrólise, mediada pela enzima folato-conjugase, dos poliglutamatos em monoglutamatos (14, 24). Os fármacos antiepiléticos ao interferirem com esta enzima, diminuem a absorção desta vitamina (8, 14, 24), potenciando o seu défice. Outra razão é o caso de a fenitoína (8, 15) e a carbamezepina induzirem o aumento da atividade do sistema microssomal hepático, promovendo uma aceleração do metabolismo do ácido fólico, e por conseguinte diminuição desta vitamina no organismo (24). Já o valproato, um inibidor enzimático, pode causar deficiência da vitamina B9 pela inibição da glutamato formil- transferase, enzima responsável pela formação do ácido folínico, metabolito ativo do ácido fólico (10, 14). De facto, o ácido fólico e a vitamina B12 são cofatores importantes da metionina sintetase, enzima interveniente na conversão de homocisteína em metionina pela via de remetilação (15, 23). Portanto, o défice de folato e/ou de cobalamina conduz a um aumento de homocisteína (14, 15, 24). A hiperhomocisteinemia, definida como concentração de homocisteína superior a 12 mmol/L, é significativamente maior nos doentes epiléticos que na população em geral, e tem sido reconhecida como um fator de risco para as doenças cardiovasculares, como a aterosclerose, em doentes com epilepsia (15, 23). O baixo status de folato e o aumento de homocisteína, associados ao tratamento com AED’s, podem contribuir para alterações da função cognitiva e malformações fetais (15), particularmente defeitos do tubo neural (23). Ademais, consta-se que os baixos níveis séricos destas vitaminas podem originar anemia megaloblástica (14, 15). Para além da anemia e do aumento de homocisteína, doenças psiquiátricas (15), cancro (15), osteoporose (15), redução da síntese de mielina e de catecolamina, correlacionadas com défices cognitivos e malformações congénitas, estão igualmente implícitas (14). Outras vitaminas do complexo B, nomeadamente a vitamina B6, B1 (21), B2 e a B7 (21), têm igualmente os seus níveis séricos diminuídos devido ao tratamento farmacológico (14). A possível explicação para o sucedido é novamente atribuída à indução enzimática por parte destes fármacos. Em particular na vitamina B6, o seu défice pode também contribuir para o aumento dos níveis de homocisteína (22). Isto porque a homocisteína, resultante do metabolismo do aminoácido metionina, é metabolizada por duas vias metabólicas, uma delas a via transsulfuração, onde a homocisteína é convertida em cisteína pela cistationa ß-sintetase, enzima que utiliza vitamina B6 como cofator (23).
Alterações dos níveis séricos de zinco, cobre e selénio
Apesar dos estudos sobre o impacto da terapêutica farmacológica nas concentrações séricas de minerais ser escassa, e por vezes controversa, estes parecem também ser influenciados pela utilização crónica de AED’s (14, 25, 26). Independentemente da oposição dos estudos, sugere-se que o metabolismo de zinco e cobre é alterado, induzindo deficiência e aumento (26, 27) dos seus níveis séricos, respetivamente (14, 28). A elevada concentração sérica de cobre foi principalmente associada à intensificação da síntese hepática de ceruloplasmina, proteína que contém mais de 95% do cobre sérico (25), com consequente aumento da sua absorção (14, 26, 28). A eventual explicação deve-se essencialmente ao papel indutor de determinados fármacos (fenitoína, fenobarbital, carbamezepina (25, 26)). O excesso de cobre é capaz de provocar múltiplos sintomas, incluindo: náuseas, vómitos, diarreia, dor abdominal, enxaqueca, icterícia, entre outros. Mais concretamente em crianças, esta abundância está relacionada com comportamentos hiperativos e distúrbios de aprendizagem (27). Doentes com epilepsia estão igualmente em risco de défice de selénio, que tal como o zinco, possui funções antioxidantes (14). Efetivamente, a fenitoína, a carbamazepina e o valproato produzem ROS que usam os recursos destes antioxidantes. A depleção de selénio pode induzir hepatotoxicidade, devido aos mecanismos contra as ROS não serem completamente eficientes, pelo facto de o efeito antioxidante do selénio estar deficitário (14).
Hiponatremia
A hiponatremia, definida como concentrações de sódio no sangue inferiores a 135 mmol/L, é bastante comum em doentes com epilepsia tratados com carbamazepina (29) e oxcarbazepina (30, 31). Estes fármacos potenciam a absorção de água a nível renal ao interagirem diretamente no complexo recetor vasopressina 2 - proteína G e aumentando a expressão de aquaporina 2 (30), o que leva à redução dos níveis de sódio no sangue. Na maioria dos casos, os doentes que desenvolvem hiponatremia são assintomáticos (30, 31) ou apresentarem sintomas inespecíficos (30). Contudo e apesar de serem ocasiões invulgares, sintomas clinicamente relevantes podem estar presentes, nomeadamente náuseas, vómitos, aumento da frequência das crises, dores de cabeça, dificuldades respiratórias, entre outros (30, 31).
Perfil lipídico
São vários os marcadores serológicos relevantes para o risco cardiovascular (colesterol total, frações lipídicas aterogénicas e homocisteína) afetados pelos fármacos antiepiléticos, particularmente os indutores enzimáticos (32). Isso inclui a fenitoína (32, 33), a carbamazepina (32, 33) e o fenobarbital (33), embora o valproato, um não indutor do metabolismo hepático, pareça também apresentar algumas modificações no perfil lipídico (34 - 36). Dados epidemiológicos demonstram que os doentes epiléticos exibem taxas de mortalidade e morbilidade vascular significativamente mais altas que a população em geral (32, 35), apresentando 1,5 a 2,5 vezes maior risco de letalidade por doenças cardiovasculares (34). O efeito dos fármacos anteriormente mencionados deve-se à indução das enzimas do citocromo P450, particularmente a enzima CYP51, envolvida na biossíntese de colesterol em humanos (33, 35). O colesterol é sintetizado a partir de acetil-CoA, que se converte em mevalonato e, consequemente, em lanoesterol. A enzima lanoesterol 14α-desmetilase (CYP51) catalisa a conversão de lanoesterol em intermediários de colesterol (34, 35). Deste modo, a indução desta enzima conduz ao aumento do nível sérico de colesterol total, como também ao aumento da fração LDL (34). Além do mais, a carbamazepina estimula a síntese hepática de colesterol e aumenta a formação e o tamanho dos ácidos biliares, que por sua vez promovem a absorção de colesterol a nível intestinal, propiciando a formação de micelas (33). Como se sabe, as concentrações séricas de lípidos podem ser influenciadas por vários fatores, nomeadamente estilos de vida (35), idade, género e Índice de Massa Corporal (34). Todavia, o tratamento farmacológico é um elemento que se deve ter em consideração, já que as alterações ao nível do perfil lipídico são um dos efeitos colaterais mais significativos nos doentes com epilepsia, pelo facto de se correlacionarem intimamente com o risco acentuado de doença cardiovascular.
Peso corporal
Consta-se frequentemente que mudanças de peso nos doentes epiléticos se relacionam com o tratamento farmacológico (37). Na sua generalidade, os fármacos antiepiléticos estão associados quer ao ganho quer à perda de peso, ainda que alguns não apresentem esse efeito (37, 38).
Aumento de peso:
São vários os fármacos que se correlacionam com o aumento de peso nestes doentes, sendo os principais o valproato, a pregabalina (39), a gabapentina, carbamazepina e a vigabatrina (37, 38, 40). Os mecanismos patogénicos induzidos por este fármaco são possivelmente multifatoriais (41, 42). As hipóteses encontradas são várias e incluem: alterações no sistema hipotalâmico, hiperinsulinemia e resistência à insulina, elevados níveis de leptina e alterações no nível sérico de outras hormonas e neuropeptídeos (adiponectina, grelina, visfatina, galanina e o neuropeptídeo Y) (37, 38, 41, 42).
O controlo da ingestão e do gasto energético é complexo e é regulado pelo SNC e periférico por vários neuropeptídeos e citocinas, que têm sua ação no hipotálamo (38, 41, 42). Preconiza-se, por exemplo, que o valproato estimule diretamente o hipotálamo, uma vez que é um agonista do neurotransmissor GABA, melhorando a sua transmissão dentro do eixo hipotalámico, sucedendo-se um aumento de apetite. De facto, o aumento de peso pode representar um risco para a saúde do indivíduo, podendo ocasionar situações de sobrecarga ponderal com todos os riscos cardiometabólicos associados (16). Em específico nas mulheres, o ganho de peso associado ao valproato constitui um fator
de risco para o desenvolvimento da Síndrome do Ovário Poliquístico (SOPC), caracterizada por irregularidades na menstruação, excesso de androgénios, ovários poliquísticos, hiperinsulinemia e dislipidemia (16, 38).
Perda de Peso:
A perda de peso e a anorexia estão entre os efeitos adversos mais comummente relatados em crianças e adultos jovens com epilepsia (43). Neste âmbito, os fármacos referenciados abrangem o topiramato, felbamato e zonisamida (16, 37, 38). Similarmente aos mecanismos de aumento de peso, as explicações para a perda de peso envolvem consequências metabólicas nos processos periféricos e/ou centrais que regulam a hemeostase energética, alterações nas hormonas leptina, insulina, adiponectina e galanina (16, 38, 43) e modificações no metabolismo da glicose e lípidos (43). Embora a perda de peso seja desejável em indivíduos com sobrepeso ou obesidade, esta pode ser problemática em indivíduos nutricionalmente vulneráveis, como é recorrente em doentes epiléticos (16, 43). Identicamente ao excesso de peso/obesidade, a redução de peso pode acarretar consequências negativas para a saúde como, por exemplo, comprometendo o crescimento e normal desenvolvimento em crianças e adolescentes (38). A Tabela 1 apresenta um resumo das implicações nutricionais dos vários fármacos antiepiléticos.
ANÁLISE CRÍTICA
Da revisão realizada, é possível concluir que existem diversas investigações acerca das eventuais consequências nutricionais advenientes do uso de antiepiléticos. Não obstante, os mecanismos inerentes às interações fármaco-nutriente são muitas vezes complexos e ainda incompreendidos. Uma monitorização e avaliação regular do EN com instituição de terapêutica nutricional precoce e ajustada é essencial para a prevenção e/ou correção de qualquer desequilíbrio nutricional que ocorra, tornando-se fundamental a atuação do Nutricionista inserido numa equipa de trabalho multidisciplinar. Salienta-se que a promoção de uma alimentação equilibrada, variada e adequada a cada doente é indispensável, auxiliando no controlo das crises epiléticas, do peso corporal e do surgimento de comorbilidades (21). A prescrição de suplementos de micronutrientes específicos também deve ser um fator a considerar aquando da terapia nutricional, quer no desenvolvimento de estratégias preventivas, quer de tratamento (21, 44). Para isso, além da monitorização terapêutica dos fármacos antiepiléticos, é imprescindível que os valores analíticos dos micronutrientes e frações lipídicas aqui mencionados sejam monitorizados com alguma regularidade.
CONCLUSÕES
Não obstante de ainda serem necessários ensaios clínicos mais minuciosos, de forma a conhecer em maior detalhe quais as interações fármaco-nutriente com verdadeiro significado clínico e quais os mecanismos exatos para tal ocorrência, cada vez mais se sabe que é importante ter em consideração que a terapêutica farmacológica pode ter impacto negativo no EN do doente epilético, e que uma avaliação nutricional deve fazer sempre parte da monitorização da terapia instituída. Assim sendo, o Nutricionista assume um papel preponderante na gestão da doença, tanto na avaliação nutricional como na prescrição de uma terapia nutricional personalizada. Vários estudos mostram um papel promissor da nutrição e alimentação na epilepsia, sendo esta um fator-chave para a melhoria na qualidade de vida e outcomes clínicos destes doentes.