Introdução
A investigação relacionada com medicamentos é um processo contínuo, onde as terapêuticas que hoje administramos foram o objeto dos ensaios clínicos (EC) de ontem. A finalidade dos ensaios é aplicá-los na prática clínica diária, sendo o doente o principal beneficiado deste progresso científico.
A área da oncologia tem acompanhado o desenvolvimento da medicina no surgimento contínuo de novas terapêuticas, o que implica o desenho prévio dos ensaios clínicos.
Cada EC é realizado segundo um protocolo, onde são descritos todos os procedimentos necessários para alcançar os objetivos propostos. Este documento especifica os aspetos do estudo, desde a seleção de doentes, o tratamento, a colheita de dados, a notificação de eventos adversos, a determinação de resposta, os procedimentos de controlo e os procedimentos necessários para a análise dos dados. Neste sentido, os resultados do ensaio são uniformes a todos os centros de investigação onde o estudo está a ser desenvolvido.
Cada profissional da equipa de investigação tem um papel crucial com funções bem definidas (Guideline for Good Clinical Practice, 2016). A prática clínica do enfermeiro em Ensaio Clínico integra várias funções (ONS, 2016; Ness & Royce, 2017), existindo países com especialização nesta área. Em Portugal ainda não está desenvolvida esta especificidade, no entanto, o enfermeiro de ensaios clínicos necessita de adquirir diversas competências e desenvolver formação especializada dentro da equipa do EC.
2. Tipologia de ensaios clínicos
A procura de terapêuticas para a cura das diversas doenças começa de forma rudimentar e embrionária antes de Cristo, sendo que no último século foram desenvolvidos procedimentos padronizados para melhorar os resultados obtidos e a segurança dos participantes. É de destacar, em 1947, a importância do Código de Nuremberga (os princípios da proteção dos participantes e o seu consentimento voluntário para a participação nos ensaios clínicos), assim como a Declaração de Helsínquia (os princípios éticos médicos), em 1964.
Segundo a alínea l) da Lei nº 21/2014 o ensaio clínico é definido como “qualquer investigação conduzida no ser humano destinada a descobrir ou verificar os efeitos clínicos, farmacológicos ou os outros efeitos farmacodinâmicos de um ou mais medicamentos experimentais, ou identificar os efeitos indesejáveis de um ou mais medicamentos experimentais, ou analisar a absorção, a distribuição, o metabolismo e a eliminação de um ou mais medicamentos experimentais, a fim de apurar a respetiva segurança e eficácia.”
Os EC englobam assim um conjunto de procedimentos de investigação efetuados por profissionais de saúde (médicos, enfermeiros, farmacêuticos, técnicos de laboratório, etc.) em ambiente laboratorial e hospitalar, com vista a desenvolver terapêuticas. Porém é necessário garantir a sua segurança, eficácia e reportar as reações adversas (RA), a sua tolerância e dose máxima tolerada pelos participantes.
Estes estudos implicam a autorização prévia de diversas entidades nacionais e internacionais, entre elas a Autoridade Nacional do Medicamento e Produtos de Saúde, I. P. (Infarmed), a Comissão de Ética para a Investigação Clínica (CEIC), a Comissão Nacional de Proteção de Dados (CNPD) e a Agência Europeia do Medicamento, que têm como função monitorizar a segurança na utilização dos fármacos experimentais e garantir o acompanhamento dos mesmos de acordo com a legislação vigente (Karlberg, & Speers, 2010). Os EC de medicamentos para uso humano são regulados pela Lei nº 21/2014 de 16 de abril, alterada pela Lei nº 73/2015 de 27 de julho.
De salientar que o EC de determinado medicamento, com as indicações constantes e aprovadas no resumo das características do medicamento (RCM), tem uma perspetiva social e global, onde todos os doentes que cumpram os critérios de inclusão podem participar.
A atividade dos ensaios clínicos proporciona um conjunto diversificado de benefícios diretos e indiretos para o desenvolvimento social e económico, dos quais se salientam o contributo em áreas distintas, consoante o beneficiário, nomeadamente:
Para o cidadão - acesso precoce e gratuito; benefício para futuros doentes; melhoria dos cuidados assistenciais; potencial para aumentar qualidade e/ou tempo de vida dos doentes;
Para a comunidade científica - aumento do conhecimento científico; estabelecimento de redes de investigação, nacionais e internacionais e retenção de talento;
Para a economia - redução da despesa pública e contributo para a sustentabilidade do sistema de saúde, assim como criação de valor para outras indústrias, criação de emprego e atração de investimento (Apifarma, 2019).
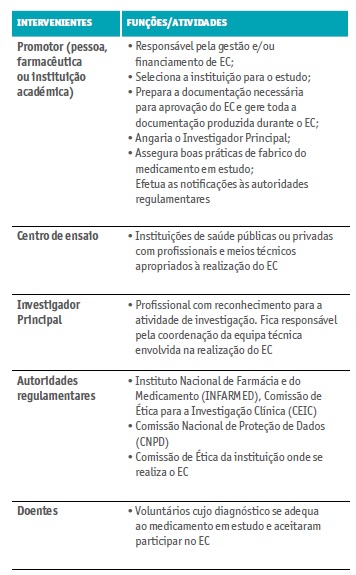
A realização de um EC é antecedida por um longo processo com fases bem definidas (Apifarma, 2019; Shamley & Wright, 2017; Borges, 2013; Karlberg, & Speers, 2010) e com diversos intervenientes com funções específicas (Quadro I). O promotor do EC é o responsável por toda a gestão do processo, seleciona o investigador principal a nível local, notifica as autoridades regulamentares nacionais e internacionais, escolhe as instituições internacionais onde decorrerá o estudo e prepara toda a documentação de suporte necessária. Neste processo de escolha são efetuadas várias visitas do promotor à instituição de saúde selecionada.
Para a participação no EC é efetuada a triagem através dos pré-requisitos de elegibilidade do participante voluntário em função dos critérios de inclusão e exclusão desenhados para o estudo.
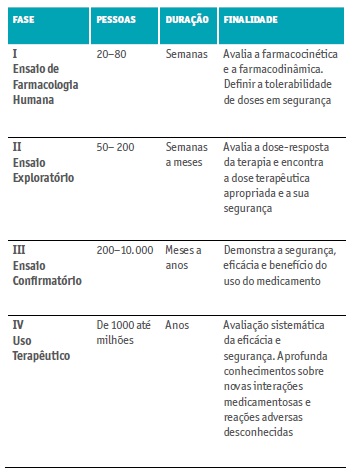
Os EC estão divididos em 4 fases (Quadro II), cada uma com objetivos definidos para se poder progredir para a fase seguinte (Apifarma, 2019; Shamley &Wright, 2017; Borges, 2013; Karlberg, & Speers, 2010). A Fase Zero desenhada mais recentemente, situa-se entre a pesquisa pré-clínica e a Fase I, nesta etapa são selecionados voluntários (até 10) aos quais são administradas doses subterapêuticas (1% da dose farmacológica). Esta dosagem com baixo risco de toxicidade permite investigar a interação do medicamento com o organismo humano (Karlberg, & Speers, 2010).
Na Fase I, os participantes podem ser adultos saudáveis ou com doença específica (ex. oncológica) para a qual o medicamento se destina a tratar. O medicamento é utilizado pela primeira vez no ser humano e procura-se determinar a dose máxima tolerada, num reduzido número de pessoas. É avaliada assim a segurança do medicamento.
Quadro II: Fases dos Ensaios Clínicos
Adaptado de: Apifarma, 2019; Shamley &Wright, 2017; Borges, 2013; Karlberg, & Speers, 2010.
A Fase II tem como objetivo obter mais dados de segurança e começar a avaliar a eficácia do novo medicamento. Esta fase permite avaliar a atividade biológica do medicamento, determinando a sua segurança e tolerabilidade.
Na Fase III, milhares de doentes são estudados por um período de tempo maior. Nesta fase o doente/voluntário pode ser tratado com o produto de investigação ou com o placebo. O objetivo é comparar tratamentos e obter mais informação sobre a segurança, a eficácia e a interação de medicamentos. Os ensaios de fase III devem fornecer todas as informações necessárias para a elaboração do Resumo das Características do Medicamento (RCM) e da bula (Folheto Informativo) do medicamento.
A Fase IV identifica e estabelece os efeitos secundários até então desconhecidos ou ainda não classificados e os fatores de risco associados. Possibilita assim o conhecimento detalhado sobre a segurança e eficácia do medicamento em estudo. Esta fase é também chamada Farmacovigilância.
3. O papel do enfermeiro em ensaio clínico
Os Enfermeiros podem desempenhar diversas funções nestas fases dos ensaios clínicos, desde a prestação de cuidados diretos à coordenação dos próprios estudos.
A atividade do enfermeiro implica a responsabilidade de valorizar a vida e a qualidade de vida através de cuidados de excelência e seguros (EOE,2015; REPE, 1996). Considerando a especificidade dos EC, estes princípios são essenciais. A prática clínica do enfermeiro em EC implica: o reforço no Consentimento Informado, o fornecer informação sobre o ensaio clínico com base nos princípios éticos, a avaliação biométrica, a receção e administração dos medicamentos em investigação, efetuar colheita de produtos biológicos, o processamento das amostras com envio das mesmas para o laboratório central e a monitorização das reações adversas (OE 2020; ONS, 2016; Ness & Royce, 2017).
As competências do enfermeiro oncologista em EC têm como base os princípios de defesa da segurança do doente, o respeito pela integridade do protocolo e a adesão aos padrões de qualidade de enfermagem, mantendo sempre uma comunicação eficaz (OE 2020; ONS, 2016). Neste sentido, o enfermeiro atua como elo de ligação entre o doente, família e o médico assistente.
Segundo a Oncology Nursing Society (ONS, 2016), as competências dos enfermeiros em EC são:
Adesão aos Padrões Éticos:
Desempenhar as atividades de acordo com os padrões da prática de enfermagem
e com o Código Deontológico.
Promover o cumprimento contínuo dos principais conceitos éticos de respeito pelo indivíduo, beneficência e justiça.
Assegurar que os membros das populações vulneráveis sejam identificados e que os seus direitos sejam salvaguardados.
Aderir a regulamentos de conflito de interesses e políticas específicas da instituição.
Atuar em conjunto com a Gestão de Risco para desenvolver e implementar intervenções que visem mitigar o risco.
Avaliar e relatar situações que podem levar à má conduta em pesquisa.
Conformidade do Protocolo:
Utilizar o processo de enfermagem para identificar as necessidades de cuidados ao doente no contexto do desenho da investigação.
Identificar os objetivos primários e secundários do estudo e as medidas de resultados.
Aderir aos regulamentos, políticas e procedimentos institucionais e nacionais aplicáveis e relacionados com o EC.
Contribuir para discussões sobre a viabilidade da implementação do protocolo com foco específico em questões clínicas, recursos disponíveis, coordenação do estudo, segurança do doente e qualidade dos dados.
Facilitar e participar em reuniões com patrocinadores, monitores e auditores.
Fornecer relatórios oportunos, precisos e completos sobre eventos adversos ou problemas imprevistos.
Consentimento Informado:
Cumprir políticas e processos institucionais para o cumprimento do consentimento informado.
Colaborar com o investigador principal para garantir que o processo de consentimento inicial e contínuo seja realizado e documentado.
Avaliar a perceção do doente sobre as informações fornecidas durante o processo de consentimento informado.
Recrutamento e Manutenção de Doentes:
Reconhecer e identificar os recursos ou grupos institucionais ou comunitários que possam ajudar a atingir as metas de recrutamento.
Identificar fatores facilitadores e barreiras ao recrutamento e manutenção em EC, tais como fatores demográficos e populações carentes.
Identificar recursos, grupos institucionais ou comunitários que podem ajudar a atingir as metas de recrutamento.
Auxiliar o investigador principal e os sub-investigadores na coordenação efetiva dos esforços de recrutamento e retenção no estudo.
Gestão de Doentes em EC
Colaborar com o investigador para verificar a elegibilidade do doente para o EC, avaliar eventos adversos e garantir a gestão de sintomas em conformidade com o protocolo.
Educar o doente e a família quanto à participação no protocolo, condição clínica e/ou processo da doença.
Identificar os doentes que requerem maior avaliação e gestão de enfermagem.
Avaliar os eventos adversos e garantir a gestão de sintomas com base em evidências, conforme permitido pelo protocolo.
Avaliar os fatores que afetam a adesão do doente às atividades específicas do protocolo.
Documentar e Gerir informação:
Documentar todos os cuidados de enfermagem ao doente no processo clínico da instituição.
Manter a privacidade e a confidencialidade dos documentos do doente.
Participar no desenvolvimento de documentos, modelos e formulários para a investigação.
Participar na preparação de relatórios para agências reguladoras apropriadas e órgãos de monitorização ou conselhos.
Gestão de Dados e Tecnologia da Informação:
Aderir ao plano de gestão de dados desenvolvido para cada EC e ajudar na solução de problemas relacionada com a informatização de dados.
Participar nas atividades de controle de qualidade para garantir a integridade dos dados, incluindo respostas em tempo útil às consultas à base de dados ou ao patrocinador.
Proteger o doente, protocolo e confidencialidade científica, garantindo a segurança dos dados de pesquisa e informações pessoais de saúde.
Inserir dados nos sistemas de recolha de dados eletrónicos, conforme o aplicativo.
Gestão Financeira:
Facilitar procedimentos exigidos pelo estudo para facilitar a recuperação dos custos das atividades relacionadas com o protocolo.
Estas competências estão todas interrelacionadas exigindo uma comunicação eficaz na relação interprofissional de toda a equipa. Em Portugal, o Estatuto da Ordem dos Enfermeiros, na alínea c) do artigo 112.º, refere que “o enfermeiro assume, como membro da equipa de saúde, o dever de integrar a equipa de saúde, em qualquer serviço em que trabalhe, colaborando, com a responsabilidade que lhe é própria, nas decisões sobre a promoção da saúde, a prevenção da doença, o tratamento e recuperação, promovendo a qualidade dos serviços.”
A estas funções mais generalistas, o enfermeiro oncologista em EC desenvolve uma subespecialidade que ao longo dos últimos anos se tem vindo a evidenciar devido ao papel multifacetado e essencial do enfermeiro na equipa de ensaios clínicos.
Conclusão
Os EC em humanos visam melhorar a sua saúde sem colocar em risco a vida. Desde o ano de 1900 que os enfermeiros estão envolvidos em EC como membro integrante da equipa pluriprofissional.
O enfermeiro oncologista tem desenvolvido conhecimentos científicos e competências específicas na área, para deste modo cumprir os protocolos pré-estabelecidos em segurança e proteger os direitos dos participantes, assim como a credibilidade dos dados obtidos.
Os domínios do enfermeiro no ensaio clínico, definidas pela ONS, permitem ter um papel diversificado, desde assumir todos os procedimentos de gestão da administração e monitorização do medicamento até, em determinados centros, passar pela co-coordenação dos estudos.
Trata-se de uma atividade recente, ainda com um caminho a percorrer quanto aos limites e abrangência da nossa intervenção clínica neste contexto, mas, pelas experiências se pelas diretivas internacionais, pensamos que em Portugal se está a dar bons passos para uma certificação das nossas competências e por um papel ativo na condução destes estudos.