INTRODUÇÃO
A síndrome do túnel cárpico (STC) é uma condição progressivamente dolorosa do punho e mão causada pela compressão do nervo mediano, ao nível do túnel cárpico na face anterior do punho. O nervo mediano enerva sensorialmente os primeiros três dedos e a metade radial do quarto dedo. A afetação motora ao nível do punho pode apresentar um quadro de parestesias e dor, assim como perda de força de preensão por atrofia muscular da zona tenar. Muitas das vezes o primeiro sintoma são parestesias noturnas (acroparestesia noturna), com alívio após mudança de posição e massagem1, sintomas com sensibilidade de 51-96% e especificidade de 27-68%2. Vários são os fatores de risco para esta síndrome, apesar de ainda permanecerem dúvidas sobre a sua correta etiologia. Esta revisão propõe-se a visualizar a STC além dos movimentos repetitivos, cargas e vibrações, procurando fornecer uma perspetiva diferente ao relacioná-la com estilos de vida desadequados, como síndrome metabólica ou resistência à insulina.
Síndrome do túnel cárpico: enquadramento
Os principais fatores de risco para esta síndrome incluem determinados fatores ocupacionais (profissões que envolvam movimentos repetitivos, cargas/ esforços ou que usem ferramentas manuais e vibratórias)1,2,4,5, insuficiência renal; condições médicas que cursem com inflamação (sobretudo a nível dos tendões e membranas sinoviais como a artrite reumatóide, lúpus, gota), a diabetes mellitus tipo 2 (DM2, cuja patofisiologia será descrita adiante)1,6,7, fraturas do punho1,3, algumas doenças do colagénio, hipotireoidismo, presença de tumores1, acromegalia4,5, amiloidose (por depósito), obesidade e índice de massa corporal (IMC) elevado cujo risco de STC pode aumentar duas a quatro vezes5,8,9 e gravidez (afetando até 62% das grávidas, maioritariamente no terceiro trimestre). As justificativas poderão estar relacionadas com flutuações hormonais, ganho ponderal ou aumento da quantidade de líquido intersticial).
Durante algum tempo acreditava-se que apenas o movimento repetitivo dos punhos causava STC, mas agora existe um consenso de que a STC é causada por um estreitamento do tamanho do túnel cárpico (o que implica volume aumentado das estruturas que o atravessam, ou diminuição das dimensões do túnel), sendo apenas exacerbada pelo movimento repetitivo. Por outras palavras, os diâmetros podem variar entre indivíduos, sendo a incidência superior no sexo feminino que normalmente possui pulsos mais estreitos (podendo aumentar o seu risco em três vezes de desenvolver STC)2,4,5,10 e geralmente assumem trabalhos com tarefas mais repetitivas, conjugadas com responsabilidades domésticas que possam acumular alguns fatores de risco eventualmente equivalentes5. Por outro lado, existe uma associação que relaciona o estrogénio a esta condição, sendo que os mecanismos pelos quais isso acontece ainda não são bem conhecidos (segundo os autores, é provável que afete o conteúdo de colagénio, rigidez ou proliferação dos fibroblastos nos tendões)11.
No caso específico da DM2 é bem conhecido o termo “pé diabético” derivado dos problemas de cicatrização característicos desta patologia, mas começa também a ser reconhecida a “mão diabética”, um termo usado para descrever os seus distúrbios músculo-esqueléticos: contratura de Dupuytren, tenossinovite estenosante e STC, podendo atingir outras áreas do membro superior (como a capsulite adesiva e a síndrome do túnel cubital); existe evidência que sugere que estes casos devem ser sempre avaliados para resistência à insulina como despiste12,13. A maior incidência de STC em DM2 é bem documentada, afetando em média um em cada três diabéticos14,15, podendo atingir os 45% nos diabéticos versus 12% na população geral16. As características da mão diabética simbolizam mudanças estruturais do tecido conjuntivo: o edema tenossinovial e a glicação acelerada resultam na formação de ligações cruzadas do colagénio que potenciam a fibrose dessas estruturas, reduzindo o tamanho do túnel onde se inserem17.
Sendo uma síndrome, subsiste ainda controvérsia da correta etiologia, pois em 50% dos casos a STC parece ser idiopática2,4,18. No entanto, existem três vias metabólicas que poderão auxiliar na sua compreensão:
-Reação de Maillard. A interação química cujo resultado podemos notar no tom tostado e odor característico de alguns alimentos quando cozinhados. Quando ocorre no corpo designa-se glicação. Danos nos tendões podem ocorrer devido a substâncias designadas produtos finais de glicação avançada (do inglês AGE, advanced glycation end products) derivados de processos oxidativos no metabolismo. Estes formam-se quando uma aldose (geralmente a glicose) reage com um grupo amina (presente nos lípidos, proteínas ou ácidos nucleicos do organismo). Esta interação cria um composto designado base de Schiff, que após sofrer rearranjos moleculares produz um aumento de AGE que podem reagir com outros grupos amina, criando-se um ciclo vicioso de glicação19,39. Por norma, o corpo produz AGE a um ritmo lento e constante. Mas o fornecimento de glicose extra de forma constante aumenta a velocidade destas reações. Tendões e tecido conjuntivo têm como base estrutural uma proteína designada colagénio (que possui grupos amina). Os AGE podem aumentar as ligações cruzadas entre essas proteínas, alterar a sua estrutura (por exemplo, tornarem-se mais espessos) e afetar a sua funcionalidade19. Na pele, isto traduz-se em rugas por perda de elasticidade. No resto do corpo, significa toda uma associação com doenças metabólicas relacionadas com inflamação crónica de baixo grau (doenças cardiovasculares, cancros, envelhecimento)20,21,22. Assim, elevados níveis glicémicos causam glicação dos terminais nervosos, endurecimento destas estruturas, predispondo a maior compressão.
Via do poliol. Excessos de glicose ativam esta via metabólica. Aqui, os prejuízos às terminações nervosas podem ocorrer logo no início da metabolização da glicose, quando origina uma substância designada sorbitol. Uma vez que o sorbitol não consegue atravessar as membranas celulares, sendo quimicamente similar ao açúcar, atrai água, originando edema que reduz o fluxo sanguíneo aos terminais nervosos e dificultando o fornecimento de nutrientes e oxigénio. Quando o edema ocorre em nervos que atravessam túneis surge dor, parestesias e outros sinais de neuropatia22.
-Via do óxido nítrico. Num organismo saudável, o aminoácido L-arginina é metabolizado pela enzima óxido nítrico sintetase (NOS), que o converte no gás óxido nítrico. Quando o endotélio vascular liberta este gás, os vasos sanguíneos relaxam e o sangue flui mais livremente através deles. Num endotélio danificado (por exemplo, na inflamação crónica de baixo grau), um aminoácido muito similar à L-arginina (dimetilarginina assimétrica) liga-se à mesma enzima, produzindo peroxinitrito. O peroxinitrito resultante inibe a síntese do óxido nítrico e provoca constrição dos vasos sanguíneos, em vez da sua dilatação. Estas constrições reduzem ainda mais a perfusão de nutrientes e oxigénio às terminações nervosas22.
-Uma sinergia dos três mecanismos. O aumento dos AGE associado a uma diminuição da capacidade antioxidante do corpo são possíveis fatores responsáveis pela indução do stress oxidativo23. A superprodução de espécies reativas de oxigénio contribui para a diminuição do fluxo sanguíneo vascular, défices de condução nervosa e diminuição dos processos de regeneração nervosa. Pequenas fibras nervosas são afetadas precocemente no curso da neuropatia, incluindo em pacientes com intolerância à glicose. Níveis glicémicos persistentemente elevados danificam os nervos e as paredes dos capilares que os nutrem. Por esse motivo, diabéticos possuem mais prevalência de STC que a população geral. Estas vias, atuando em simultâneo, contribuem para o atraso na comunicação, atrofia axonal e desmielinização17.
O impacto económico causado por esta condição não se resume aos gastos com o diagnóstico e tratamento, por si só já elevados. Os indivíduos com esta síndrome podem tornar-se incapazes de desempenhar algumas tarefas laborais, ou ter que suspender a sua atividade profissional por períodos relativamente longos, o que poderá também ser uma fonte de custos para as empresas2,5. O tratamento geralmente baseia-se em métodos conservadores como massagem, exercícios adaptados, anti-inflamatórios, injeções com corticóides4,24, podendo atingir o tratamento cirúrgico para descompressão do túnel cárpico2,4,24.
Apesar das rotas metabólicas acima descritas poderem plausivelmente explicar os casos de STC idiopática, o objetivo desta pesquisa é auferir a evidência sobre esta condição do ponto de vista da associação à resistência insulínica (RI) ou síndrome metabólica (SM), de modo a tornar uma compreensão mais abrangente deste tema e possivelmente fornecer um outro ponto de vista aos profissionais de saúde.
METODOLOGIA
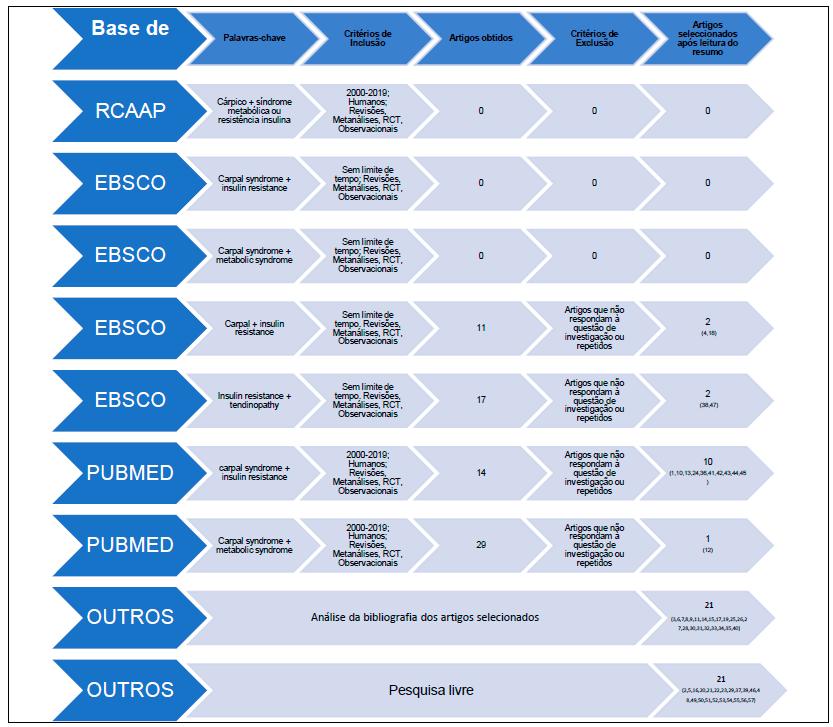
Trata-se de uma revisão bibliográfica integrativa nas bases de dados EBSCO: CINAHL Plus, Nursing & Allied Health Collection, Cochrane Central Register of Controlled Trials, Cochrane Database of Systematic Reviews (CDSR), Database of Abstracts of Reviews of Effects (DARE), MedicLatina, MEDLINE, PUBMED e RCAAP, realizada em Janeiro de 2020. A pergunta de investigação considerada foi:O que está descrito na literatura relativamente à síndrome do túnel cárpico e resistência à insulina ou síndrome metabólica?
Como critérios de inclusão consideraram-se estudos observacionais, caso-controlo, coorte, randomizados controlados, artigos de revisão e metanálises sobre STC e resistência à insulina ou síndrome metabólica, publicados entre 2000 a 2019. Foram selecionadas como palavras-chave “síndrome do túnel cárpico”, “resistência à insulina” e “síndrome metabólica” usando as conjunções “E” ou “AND”. Devido à dificuldade em obter artigos através desses cruzamentos na EBSCO, alargou-se a pesquisa para o conceito de “tendinopatia”. Como critérios de exclusão foram assumidos estudos repetidos e não pertinentes para o objetivo da revisão após a leitura do seu resumo. Para complementar a perspetiva do tema, realizaram-se pesquisas prévias informais com literatura teórica, bem como análise da bibliografia dos documentos selecionados, considerando-os caso respondessem à pergunta de investigação. O fluxograma da pesquisa encontra-se no Quadro 1.’
CONTEÚDO E DISCUSSÃO
Sabendo que DM2 é um fator de risco conhecido de STC, Novella25 e colaboradores (2001), procuraram investigar se a intolerância à glicose estava também associada a neuropatia idiopática. Incluíram 46 pacientes com STC idiopática, após excluídos os que possuíam diagnóstico de DM2 prévio ou outra condição que pudesse predispor a STC (alcoolismo, história familiar, doença de Lyme, défice de Vitamina B12 ou utilização de fármacos que pudessem causar neuropatia ou intolerância à glicose) e compararam com sujeitos da comunidade, sem a condição. Os parâmetros avaliados foram a glicemia em jejum, IMC e PTGO (prova de tolerância à glicose oral). Não foi avaliada a hemoglobina glicada (H1Ac) pois não fazia parte dos critérios de diagnóstico de DM2. Cerca de 50% dos casos apresentavam valores de intolerância à glicose, sendo que 23% foram diagnosticados já com DM2 nesse mesmo estudo. Singleton e colaboradores, no mesmo ano, aproveitaram o facto de a Associação Americana de Diabetes ter englobado a intolerância à glicose como fator de risco cardiovascular independente da DM2, para avaliar se também estaria relacionado a neuropatia (visto que uma boa percentagem de diabéticos já possuía tendinopatias no momento do diagnóstico). Assim, desenvolveram um estudo prospetivo26 de três anos que acompanhou 107 casos de STC idiopática. A esses casos foram auferidas a glicemia em jejum e de PTGO, H1Ac, vitaminas do complexo B, TSH, IMC e metais pesados na urina. Avaliaram a PTGO a 72 indivíduos e 50% desses possuíam intolerância à glicose. A hipertensão arterial era mais comum nos diabéticos ou em quem apresentava intolerância à glicose e na maioria dos casos, apesar da intolerância à glicose detetada, o valor de H1Ac encontrava-se em parâmetros normais. Os autores sugeriram que seria necessário avaliar mais longitudinalmente se a DM2 surgiria nestes pacientes com intolerância à glicose em associação com a STC e se existiam intervenções capazes de reduzir a progressão. No entanto, concordaram que o reconhecimento precoce da intolerância à glicose em pacientes com neuropatia deveria ser considerado uma oportunidade única de prevenção cardiovascular conhecida da resistência à insulina e que mudanças modestas nos valores de glicemia identificavam a intolerância à glicose como suficiente para causar STC.
Numa revisão27 de Buono do mesmo ano, discutem-se mecanismos no qual a reparação de lesão tendinosa poderá estar reduzida, abordando extensivamente o papel da obesidade, DM2 ou inflamação crónica de baixo grau no processo. Na obesidade existe um aumento de produção de citoquinas inflamatórias, sendo que macrófagos e mastócitos migram para o tecido adiposo; esta diminuição no volume circulante poderia ser responsável por respostas imunes menos eficazes nas lesões tendinosas. Em diabéticos, a hiperglicemia prejudica a funcionalidade do colagénio, aumenta a resistência à degradação enzimática, contribuindo para falhas de mecanismos de resposta aguda. Pacientes com H1Ac aumentada possuíam maior predisposição para patologias músculo-esqueléticas dos membros superiores e apresentavam maiores complicações do que pacientes com melhor controlo metabólico. A inflamação sistémica prolongada de baixo grau e diminuição da sensibilidade à insulina atuam como fator de risco para menor resposta de cicatrização; mudanças no estilo de vida e dieta podem reverter o estado inflamatório e melhorar a tendinopatia. Em pacientes com tendinopatia do ombro, por exemplo, o risco cirúrgico associava-se ao aumento do IMC em ambos os sexos. Uma vez que se verifica uma alta incidência de tendinopatia e inflamação crónica de baixo grau em obesos com menor sensibilidade à insulina ou DM2, os autores sugerem que estes fatores de risco modificáveis sejam sempre investigados para prevenir a evolução das tendinopatias.
Num estudo transversal28 de 2003, Sumner avaliou a história familiar, Hb1Ac, função renal, tiroideia, hemograma, vitamina B12, glicemia em jejum e PTGO a 73 pacientes com STC, na tentativa de verificar a hipótese de que a intolerância à glicose estava implicada nas neuropatias idiopáticas. Dos avaliados, 56% possuíam intolerância à glicose, sendo que 20% apresentavam já valores de DM2. Pacientes com intolerância à glicose (caracterizada por valores em jejum de 100-126 mg/dL ou 140-200 mg/dL duas horas após ingestão de 75g de glicose) apresentavam STC menos severa apenas com atingimento de fibras mais pequenas (bem como uma menor evolução temporal da sintomatologia), do que STC dos diabéticos que abrangia já fibras maiores. Picos glicémicos poderiam ativar mecanismos de toxicidade que afetam as fibras nervosas iniciando pelas mais pequenas. Os autores apontaram como limitações o facto de ser somente um estudo transversal apenas em pacientes de uma clínica, afirmando não poder extrapolar a todos os casos de STC idiopática por ser apenas uma hipótese e sugerem estudos futuros que possam abordar a temporalidade na avaliação da STC. No entanto, afirmam que estes achados suportam uma possível causalidade entre intolerância à glicose e STC idiopática, considerando critérios de Bradford-Hill29 como a relação dose-resposta, a força da associação, a replicação de resultados similares noutras populações e a plausibilidade biológica.
No estudo de casos-controlos30 aninhados numa coorte de 2006, Gulliford e colaboradores também suspeitavam desta associação entre hiperglicemia e a etiologia de polineuropatias, investigando se a incidência de STC, paralisia de Bell ou outras neuropatias também estavam associadas ao diagnóstico prévio de DM2. Assim, analisaram 2647 casos de pré-diabetes que evoluíram para DM2 no período de acompanhamento dessa coorte, e compararam quase 5300 controlos sem a patologia. Foram analisados e ajustados fatores de risco conhecidos de STC (obesidade, patologia da tiróide, artrite reumatóide, osteoartrite, fraturas do punho). Os participantes diagnosticados com STC apresentavam 36% mais hipóteses de serem diagnosticados com diabetes mais tarde, independentemente de outros fatores de risco para DM2. A incidência de paralisia de Bell em pré-diabéticos era quase o dobro dos controlos. Os resultados sugeriam que os danos ocorriam bem antes do indivíduo apresentar sinais de pré-diabetes. Os autores fizeram a observação inovadora de que a incidência da STC precedia o diagnóstico clínico oficial de diabetes em até 10 anos, quando a exposição à hiperglicemia à partida teria sido menos prolongada ou severa30,31, reforçando assim a associação entre a hiperglicemia (mesmo não atingindo valores de Diabetes) e a disfunção tendinosa periférica25,26,28,30,31.
No seu estudo de casos-controlos1 de 2007, Balci avaliou 107 pacientes com STC quanto à obesidade visceral, hipertrigliceridemia, hipertensão e glicemia em jejum, sendo divididos em dois grupos para comparação (com ou sem SM, conforme critério da ATP III - ver quadro 2). Foram excluídos os casos de hipotiroidismo, terapia de reposição hormonal, uso de corticoides, artrite reumatoide, osteoartrite, fraturas de punho, radiculopatias cervicais ou polineuropatias. Verificou-se que 75% dos pacientes com STC apresentavam SM. Além disso, os achados eletrofisiológicos da STC eram mais graves em pacientes com SM do que naqueles sem SM. Segundo os autores, a SM agrega fatores de risco para STC, sendo eles a obesidade, dislipidemia e resistência à insulina. Existem vários autores que referem a própria dislipidemia (marcador de SM) como fator de risco para STC idiopática, provavelmente pela inflamação e deposição associada31,32,33,34,35,36,47.
Quadro 2 Critérios diagnósticos para síndrome metabólica
| Fator de Risco | Organização Mundial de Saúde, 1999 | European Group for study Insulin Resistance (EGIR) 1999 | ATP III painel adultos, 2001 | IDF, 2005 | ATP III painel adultos, 2005 | Joint Interim Societies, 2009 |
|---|---|---|---|---|---|---|
| Resistência à insulina | DM2, RI ou IG e dois dos critérios abaixo: | RI, hiperinsulinemia e dois dos critérios abaixo: | três dos critérios abaixo: | Adiposidade central e dois dos critérios abaixo: | três dos critérios abaixo: | três dos critérios abaixo: |
| Perímetro abdominal | IMC >30 Kg/m2 Rácio cintura/anca: > 0,9 (H) > 0,85 (M) |
> 94 cm (H) > 80 cm (M) caucasianos |
> 102 cm (H) > 88 cm (M) |
> 90 cm (H) > 80 cm (M) sul-asiáticos |
> 90 cm (H) > 80 cm (M) asiáticos |
> 90 cm (H) > 80 cm (M) sul-asiáticos |
| Dislipidemia | Tg > 150 mg/dL HDL < 35 mg/dL |
Tg > 177 mg/dL HDL < 39 mg/dL |
Tg > 150 mg/dL HDL< 40mg/dL(H) ou < 50mg/dL (M) |
Tg > 150 mg/dL HDL< 40mg/dL(H) ou < 50mg/dL (M) ou medicação |
Tg > 150 mg/dL HDL< 40mg/dL ou medicação |
Tg > 150 mg/dL ou medicação |
| Hipertensão arterial | > 140/90 mmHg ou medicação | > 140/90 mmHg ou medicação | > 130/85 mmHg ou medicação | > 130/85 mmHg ou medicação | > 130/85 mmHg ou medicação | > 130/85 mmHg ou medicação |
| Glicemia jejum | HOMA-IR (RI, IG ou DM2) |
>110 mg/dL | >110 mg/dL | >110 mg/dL ou DM2 | >100 mg/dL ou medicação | >110 mg/dL ou medicação ou >140 mg/dL 2h pós PTGO57 |
Tg=triglicerídeos; IG=intolerância à glicose; RI=resistência à insulina; DM2=diabetes mellitus tipo 2
Num estudo de casos-controlos18 de 2011, Plastino avaliou 117 pacientes com STC moderada a grave, comparando com 128 controlos. Foram excluídos os casos de gravidez, predisposição familiar, trabalhos manuais repetitivos, patologia da tiróide, doenças do tecido conjuntivo, fraturas do punho, défices das vitaminas B9 e B12, exposição a toxinas e anormalidades renais. A STC foi confirmada por eletromiografia, sendo avaliados parâmetros de IMC, perímetro abdominal, insulina e glicemia em jejum, HbA1c, hemograma, funções renal e hepática, lípidos séricos incluindo triglicerídeos, tensão arterial, vitamina B12, ácido fólico, função tireóidea, HOMA-IR (para a resistência à insulina) e PTGO (intolerância se os valores se encontrassem entre os 140-200 mg/dL). Segundo a análise da PTGO, verificava-se intolerância à glicose em 60% dos casos de STC. Quanto à HOMA-IR, foi documentada resistência à insulina (RI) em 80% dos casos de STC, dos quais 45% possuíam intolerância à glicose, 14% valores compatíveis com DM2 e 20% apenas RI. Nos 20% dos casos que apenas possuíam RI, os valores de PTGO encontravam-se em parâmetros normais, mas a insulina era marcadamente elevada (a média da insulina em jejum dos casos era também mais elevada). O perímetro abdominal e IMC eram superiores nos casos comparativamente aos controlos. Os autores sugerem que a intolerância à glicose é já um fator de risco para STC, como uma manifestação de RI que precede a DM2, acompanhada de perímetro abdominal aumentado, hipertensão e dislipidemia (sinais de SM), reforçando a associação com a neuropatia periférica, principalmente quanto maior o tempo de exposição a glicemias elevadas18,28. Os autores citam outros casos-controlos, extrapolando que a RI é também um fator de risco para outras neuropatias como a paralisia do III par craniano, do VII (paralisia de Bell) ou até mesmo a blefaroptose idiopática18,30,40. Finalizam indicando que a STC idiopática está frequentemente associada a RI na forma de “pré-diabetes” e aconselham a monitorização destes parâmetros (mesmo na presença de valores glicémicos normais). Estes resultados são congruentes com a revisão31 de Papanas sobre pré-diabetes e neuropatia idiopática ser uma realidade bidirecional, mostrando que pré-diabéticos são mais propensos a apresentar neuropatia periférica e que não-diabéticos com neuropatia periférica, provavelmente são pré-diabéticos em até 65% dos casos. Nesta revisão discute-se o papel do diagnóstico, em que a maioria dos autores opta pela PTGO e outros pela glicemia em jejum (apesar da primeira fornecer dados mais sensíveis e maior associação com neuropatia que a segunda - 62% versus 39%. Aborda-se a patogénese da neuropatia, congruente com a noção de que a hiperglicemia constante ativa a via do poliol, com aumento da produção de AGE. Estes últimos promovendo o stress oxidativo e exercendo efeitos pró-inflamatórios, reduzindo o fluxo sanguíneo e levando a hipoxia (reduzindo a produção de fatores de crescimento), evidenciando que existem determinados polimorfismos genéticos que podem aumentar a predisposição. Uma outra revisão14 de Bahrmann aborda STC específica em diabéticos, mostrando que a STC é um fator de risco para manifestação posterior de DM2, pois mesmo diabéticos recém-diagnosticados manifestam um risco 1.4 vezes superior de STC que a população de referência da mesma faixa etária.
Em 2013, Onder36 e colaboradores analisaram 150 pacientes com STC, tendo sido divididos conforme apresentassem SM ou não (de acordo com critérios ATP III, após excluírem todos os pacientes com fatores de risco conhecido para STC). Dos 150 pacientes, 87% eram do sexo feminino, e 54% apresentavam SM. Sugeriram que a SM parecia ser um fator de risco para STC e, ao mesmo tempo, aumentar a gravidade da sintomatologia, correlacionado com presença de dislipidemia. Ainda em 2013, Vasconcelos desenvolveu um estudo transversal37 onde avaliou 115 pacientes com STC idiopática e 115 controlos selecionados da comunidade, agrupados por sexo, idade e IMC. Foram excluídos pacientes com fatores de risco conhecidos para STC (DM2, gravidez, artrite reumatoide, fraturas, fármacos que alterem glicemia). Após verificação da STC por eletromiografia, avaliou-se a PTGO a todos os sujeitos, e não se encontraram associações significativas na prevalência de STC entre pacientes com PTGO alterado, referindo estar apenas associada à idade e ao IMC elevado.
Por sua vez, numa revisão38 de 2015, Barniak e colaboradores associam resistência à insulina a tendinopatia, referindo que os mecanismos que medeiam estas associações possam não ser ainda bem compreendidos, mas discute-se o papel que a resistência à insulina tem na alteração do colagénio, na síntese de proteoglicanos, diminuição da irrigação vascular e presença de AGE39. Ao contrário do tecido muscular e ósseo, fortemente vascularizados, o tecido tendinoso é muito pouco irrigado, reduzindo-lhe a capacidade de regeneração após lesões. Assim, défices na resolução da fase aguda da resposta inflamatória podem levar a uma influência mais prolongada de citoquinas inflamatórias no tecido e, por outro lado alterar a funcionalidade mecânica pela maior rigidez, ocorrendo maior risco de rutura (diabéticos possuem um risco 44% superior de hospitalização por rutura tendinosa). Adicionalmente, o aumento de AGE ativa os seus recetores, potenciando as vias pró-inflamatórias e formação de mais radicais livres. A hiperglicemia tem a capacidade de reduzir o conteúdo de proteoglicanos nos tendões, podendo ocasionar mais mecanismos que levam à fibrose e aumentando a suscetibilidade a lesões. Sabe-se que os tendões de Aquiles e fáscia plantar se encontram mais espessados em diabéticos (mesmo assintomáticos). Verifica-se também uma forte correlação entre perímetro abdominal acima de 83 cm e tendinopatia, assumindo o papel da obesidade visceral e elevado IMC como fatores de risco, sendo a associação igual em tendinopatias do membro superior e inferior. Discute-se que a obesidade pode aumentar o stress oxidativo23. De facto, mesmo em atletas de topo, um aumento ligeiro acima de 83 cm no perímetro abdominal já se relaciona com um aumento de risco de lesão tendinosa. Estes achados eram acompanhados de dislipidemia (elevação do colesterol total, triglicerídeos, menor HDL e um aumento do rácio triglicerídeos/ HDL). Estes fatores não mostram ser a causa da tendinopatia, mas um marcador de SM, sendo a dislipidemia uma característica da resistência à insulina47. Assim, a cascata de eventos poderia iniciar-se bem antes do paciente apresentar outros sintomas, começando por marcadores subtis e um quadro progressivo. Os autores sugerem que este fator seja tido em consideração na prescrição dos planos multidisciplinares terapêuticos adequados das tendinopatias. Neste caso, vão mais além e sugerem que os profissionais de saúde deveriam interpretar as tendinopatias como uma condição intrinsecamente associada ao risco cardiovascular38.
Numa revisão12 de Zyluk sobre manifestações de “mão diabética”, demonstrou-se que a STC e a contratura de Dupuytren ocorrem com mais frequência em diabéticos, sendo muitas das vezes condições não valorizadas precocemente, bem como a mobilidade articular limitada ou fraqueza nas mãos.
Roh41 e colaboradores acompanharam 35 pacientes com SM e sujeitos a cirurgia do STC, comparando-os com 37 pacientes sem SM. Pacientes com STC e SM apresentavam uma recuperação funcional após cirurgia mais lenta, apesar de as melhorias na sintomatologia e funcionalidade das mãos serem semelhantes em ambos os grupos ao fim desse ano. Os mesmos autores em 201624 acompanharam 55 pacientes com STC e SM tratados com injeção de corticosteroide por 24 semanas e compararam com outros 55 pacientes sem SM, demonstrando que a presença de SM elevava a propensão de necessitar de cirurgia repetida e que tal poderia afetar a eficácia do tratamento de corticosteróides.
Numa série de casos42 de 2016, Iftikhar descreve 75 pacientes com STC relativamente a parâmetros de SM (tensão arterial, glicemia em jejum, triglicerídeos, colesterol HDL, perímetro abdominal). Dos 75 pacientes, 83% eram do sexo feminino. A SM foi encontrada em 72%, sendo que os 72% também apresentavam circunferência abdominal aumentada, 69% hipertensão arterial, 25% glicemia em jejum elevada, 70,6% triglicerídeos elevados e 72% baixos valores de HDL. Uma vez que a SM e a STC ocorrem na maioria das vezes simultaneamente, os autores sugerem que uma precoce abordagem da SM em pacientes com STC pode ser uma medida de saúde eficaz numa perspetiva custo-benefício para reduzir a morbilidade associada à SM. Numa revisão13 do mesmo ano, Rota e colaboradores discutem as neuropatias de compressão na DM2: são tão frequentes em qualquer estágio da patologia, que são consideradas uma sua característica neurofisiológica. De facto, as neuropatias podem ser a primeira anormalidade neurofisiológica a surgir, principalmente nos membros superiores, mesmo na ausência de polineuropatia generalizada. Esta incidência é sustentada por um contexto fisiopatológico já muito discutido: as alterações no metabolismo da glicose, o comprometimento funcional derivado de alterações estruturais dos nervos periféricos, mesmo no estádio pré-clínico, tornando os canais anatomicamente mais restritos propensos a maior compressão.
Em 2017, Zimmerman43 avaliou o resultado a 493 cirurgias do STC, focando fatores relacionados à SM: diabetes, hipertensão, obesidade (IMC ≥ 30) ou tratamento com estatinas. Demonstrou-se que pacientes hipertensos, obesos ou sob tratamento com estatinas apresentavam melhorias pós cirúrgicas semelhantes a pacientes sem esses fatores. Dos pacientes operados 70% eram do sexo feminino, 15% possuíam DM2, 18% obesos, 29% hipertensos e 17% sob tratamento com estatinas. Uma das limitações relatadas no estudo foi apenas se basearem em dados como presença de obesidade ou hipertensão, afirmando que não possuíam dados para identificar a proporção que possuía SM através de controlo analítico.
Num estudo transversal4 4 do mesmo ano, Foroozanfar analisou 105 diabéticos com STC que participavam num rastreio cardiovascular e demonstrou que a duração da diabetes estava associada a um aumento do risco de STC, assim como o tabagismo e o aumento do IMC. Por sua vez, Ullusoy10 acompanhou 86 punhos de 78 pacientes, de modo a avaliar recidivas após cirurgia do STC: a prevalência de STC era dez vezes superior no sexo feminino. Dos 86 punhos verificou-se a recidiva de 36% e a SM estava presente em 74% dos casos (referem outros estudos em que a presença de SM varia entre 54% a 75%). Devido a este valor estatisticamente significativo, os autores referiram que a presença de SM pode aumentar o risco de recidiva após a cirurgia. Pacientes com SM apresentam assim risco aumentado de neuropatia periférica, neuropatias de compressão e patologias na coluna que podem levar a radiculopatia. O mesmo acontece em pacientes com SM mesmo que ainda não apresentem disfunção na glicemia em jejum45.
Como olhar para a STC além dos movimentos repetitivos?
Recentemente mostrou-se que alguns nutrientes têm um papel importante nas lesões nervosas devido às suas propriedades neuroprotetoras46. Além do tratamento cirúrgico ou conservador, esses nutrientes também podem desempenhar um papel na prevenção e na recuperação. Acredita-se que os ácidos gordos ómega-3, vitaminas do complexo B, antioxidantes, minerais e alguns compostos fenólicos tenham impacto positivo no sistema nervoso. Além desses, a microbiota intestinal pode também afetar a neurogénese50. Todos estes componentes podem ser abordados numa promoção de um estilo de vida saudável que potencie a maximização nutritiva, em detrimento da maximização energética atual. Sob este ponto de vista, torna-se imperativo abordar também a alimentação, no que diz respeito a redução de hábitos que estimulem a resistência à insulina, enquanto se procura potenciar a capacidade antioxidante do organismo. A ingestão de álcool pode também desencadear stress oxidativo e, dessa forma causar neuroinflamação e comprometimento neurológico. Sabe-se que o ritmo circadiano regula vários processos fisiológicos, incluindo hábitos básicos como fome, sede, sono, parâmetros endócrinos (hormonas de stress, equilíbrio de fluidos) e temperatura corporal. A literatura tem-se concentrado nos mecanismos induzidos pela melatonina em lesões nervosas periféricas, existindo evidências do seu efeito neuroprotetor pela redução do stress oxidativo, sendo essa secreção controlada pelo ritmo circadiano. Em modelos animais com lesão do nervo ciático, a melatonina mostrou-se benéfica46. Estes conceitos podem sugerir-nos que promover bons hábitos de sono, gestão do stress e a alimentação adequada devem estar incluídos nos planos de tratamento individualizados, no mesmo patamar dos planos de exercícios e terapêutica.
LIMITAÇÕES
Este tipo de evidência surgirá maioritariamente no formato de casos-controlos ou estudos transversais, podendo sempre demonstrar as limitações características desses tipos de estudos (apenas demonstrando hipóteses, falácias ecológicas, entre outros). Observa-se uma grande variabilidade de critérios de escolha de avaliação analítica dos pacientes: enquanto uns autores escolhem apenas a PTGO e IMC como variáveis isoladas, outros autores assumem toda uma panóplia que passa também pela inclusão da Hb1Ac e a insulina em jejum, o que pode levar a uma compreensão distinta da realidade e a novos conceitos da variabilidade individual face à SM. Alterações glicémicas (como glicemia em jejum ou PTGO) estão quase sempre associadas a STC, mas em alguns casos estas podem demonstrar valores dentro dos limites de referência, ao passo que a insulina se encontra elevada. Talvez por esse motivo se discuta atualmente o papel de hiperinsulinemia como marcador da resistência à insulina, mais do que o foco único em valores glicémicos (que podem ser os últimos valores a surgir alterados na SM) conseguindo englobar um número muito maior de casos que “escapam” e que forneçam uma prevalência da resistência à insulina mais real nas síndromes, como a abordada na presente revisão48,49,50,51. Apesar das evidências reportadas serem de carácter observacional/ descritivo e das limitações associadas, não podemos deixar de reparar que parecem dirigir-se no mesmo sentido (o valor mínimo encontrado de prevalência de intolerância à glicose em STC é 50%) e a cumprir os critérios de Bradford-Hill29 (plausibilidade biológica, dose-resposta, temporalidade, consistência). Assim, os dados apontam para uma associação positiva e estreita entre a STC e intolerância à glicose. E apesar deste caminho evidenciado, a tentativa de controlar, prevenir ou reverter problemas metabólicos através de estilos de vida raramente entra no tratamento inicial. Esta perspetiva sobre a STC representa um primeiro passo para uma abordagem mais abrangente em indivíduos que apresentem sintomatologia sugestiva de tendinopatia, especialmente a STC idiopática.
CONCLUSÕES
Poderá a STC idiopática ser um sinal de bandeira vermelha indicadora de RI, e logo um indicador de estilos de vida desadequados? Pensar nestas conexões representa um primeiro passo para abordagens precoces em indivíduos que apresentam tendinopatias, especialmente idiopáticas. Propõe-se aos profissionais o estudo de uma possível resistência à insulina como suspeita de todos os trabalhadores com tendinopatias idiopáticas (demarcado pela avaliação do perímetro abdominal, o rácio cintura: anca52, o rácio Triglicerídeos/ HDL53 (um bom preditor da RI e do tamanho das partículas de LDL), glicemia em jejum, HOMA-IR, e especialmente a avaliação sérica de insulina em jejum (e associada a PTGO)48,49,50,51. Esta abordagem das tendinopatias requer um esforço de equipa entre enfermeiros do trabalho, médicos do trabalho, médicos de medicina geral e familiar, fisioterapeutas, nutricionistas, endocrinologistas, neurologistas e cirurgiões.
A essência passará por uma vigilância proativa com educações para a saúde que abordem os conceitos acima referidos. Mais do que alongamentos, massagens, anti-inflamatórios e relaxantes musculares, é preciso olhar para o indivíduo também com um sinal de alerta de resistência à insulina e promover mudanças de comportamentos precoces, sobretudo quando os danos podem ainda ser ligeiros. Sabendo que mundialmente a DM2 evoluiu de 108 milhões de pessoas em 1988 para 422 milhões em 201454; que em 2019 percebemos que apenas 12% dos americanos eram metabolicamente saudáveis55 e que em 2019 os antidiabéticos orais ganhavam o primeiro lugar com cerca de 20% dos encargos com o Sistema Nacional de Saúde Português56, é necessário não olharmos para o STC como simplesmente “um punho”, mas como um sistema que atua (repetitivamente) em sinergia com estilos de vida desadequados, resultado da exposição a mais fatores de risco para além dos mais óbvios. Talvez este seja o elefante escondido na sala e a principal preocupação da saúde pública num futuro próximo.