INTRODUÇÃO
A triagem da pele está incluída no exame físico, um dever e responsabilidade dos Enfermeiros na sua prática. Muitas das vezes apenas se valorizam certos sinais, nomeadamente “Pele Seca” ou “Feridas”, esquecendo que a pele é um órgão complexo que fornece mais sinais para além de hidratação ou infeção: é um tecido que depende de um equilíbrio metabólico para atividades biossintéticas, talvez de forma mais intensa que outros órgãos, podendo retratar determinantes da doença (como distúrbios endócrinos, nutricionais ou outros, que ocasionam alterações da sua função e morfologia)1,2. Num mundo ocidental marcado por elevadas prevalências de alterações metabólicas (por exemplo, apenas 12% dos americanos parecem ser metabolicamente saudáveis3 e o excesso de peso atinge 68% dos adultos portugueses4, torna-se essencial saber onde procurar sinais de forma precoce. A Síndrome Metabólica (SM) é um cluster de alterações, consequência de um continuum de resistência à insulina (RI) e inflamação crónica5-9. Inclui como critérios de diagnóstico uma alteração do metabolismo da glicose (hiperglicemia, hiperinsulinemia ou RI); obesidade abdominal ou índice de massa corporal (IMC) superior a 30 kg/ m2; alteração do perfil lipídico através de um aumento dos triglicerídeos e redução de colesterol HDL e hipertensão arterial6,10. Uma vez que a obesidade é um dos componentes da SM, não é surpreendente que indivíduos obesos exibam concomitantemente níveis mais elevados de glicose, insulina, RI ou marcadores inflamatórios1. A inflamação crónica e o aumento do tecido adiposo conduzem a um aumento da produção de sinalizadores inflamatórios, induzindo RI, maior síntese de glicose, triglicerídeos e lipoproteínas de baixa densidade, ao passo que a hiperinsulinemia aumenta a reabsorção renal de sódio, aumenta a atividade do sistema nervoso simpático e, em articulação com a disfunção endotelial, inibe a síntese de óxido nítrico, um vasodilatador6,10. Ao longo dos anos, procurou-se estabelecer uma definição standard quantitativa destas alterações, no entanto estes esforços levaram a várias definições de SM que geralmente variam com a escolha de dois a três dos critérios listados6,7,10 e, talvez por esse carácter multisistémico e multifatorial, ainda não é amplamente identificada na prática. A SM representa uma condição progressiva, iniciando com fatores limite e/ ou isolados, que eventualmente progridem para fatores de risco agrupados. De facto, todos os critérios de SM definidos acima representam fatores de risco independentes, associados a disfunção endotelial, aterosclerose e hipercoagulabilidade, resultando num aumento do risco de várias patologias, nomeadamente esteatose hepática não alcoólica, cardiovasculares (DCV), metabólicas (por exemplo, cerca de 50% dos indivíduos com SM evoluem para diabetes Mellitus tipo 2 (DM2) num período de oito anos) ou algumas neoplasias7,11-16, sendo designadas por vários autores por “doenças da civilização”17,18. A perceção dos fatores de risco isolados poderá representar estágios precoces de SM e, reconhecendo as suas consequências, uma deteção precoce assume extrema importância. Nas empresas, é comum encontrar trabalhadores com os múltiplos fatores de risco que caracterizam a SM, sendo que o ambiente e a organização do trabalho, atuando em mecanismos associados ao stress ou inferências no estilo de vida (por exemplo, o impacto do trabalho por turnos/ noturno, ou na exposição a uma alimentação desadequada através das cantinas, bares ou máquinas de vending) poderão influenciar o desenvolvimento de SM. Nos serviços de Saúde Ocupacional existe outro caminho ao investir na promoção da saúde e do bem-estar além da prevenção direta de doenças profissionais e acidentes de trabalho, podendo atuar em sinergia com os Cuidados de Saúde Primários. As implicações da SM levarão obrigatoriamente a mais baixas por doença, mais acidentes de trabalho e mais perda de produtividade para as Empresas. Perante tal, como poderão os profissionais de saúde utilizar competências no exame físico para suspeitar de SM ou RI em indivíduos com vários tipos de apresentações? Esta revisão objetiva agregar essas manifestações cutâneas.
METODOLOGIA
Foi realizada uma Scoping Review durante os meses de Junho e Julho de 2020 através de uma pesquisa nas bases de dados EBSCO (CINAHL, MEDLINE, Nursing & Allied Health Collection, Cochrane Central Register of Controlled Trials, Cochrane Database of Systematic Reviews, Cochrane Methodology Register, Library, Information Science & Technology Abstracts, MedicLatina), PUBMED e RCAAP. A questão de investigação considerada foi: O que está descrito na literatura relativamente a sinais dermatológicos que sugiram síndrome metabólica durante o exame físico? Como critérios de inclusão, foram selecionados estudos disponíveis em inglês, português, publicados sem limite de tempo até à data de pesquisa, com qualquer desenho metodológico (preferindo revisões), que abordassem dados que respondessem à questão de investigação, em humanos. Como critérios de exclusão, tudo o que não respondesse à questão, ou duplicados. As palavras-chave selecionadas incluíam “Manifestações cutâneas”, “Sinais na pele”, “Síndrome metabólica”, “Resistência à insulina”, Skin manifestations”, “Skin signs”, “Insulin resistance”, “Metabolic syndrome”. Após análise dos artigos selecionados, agregou-se bibliografia por eles citada, caso respondesse à pergunta de investigação, bem como pesquisa livre (motores de busca generalistas) que possa não ter surgido na pesquisa inicial.
RESULTADOS/ DISCUSSÃO
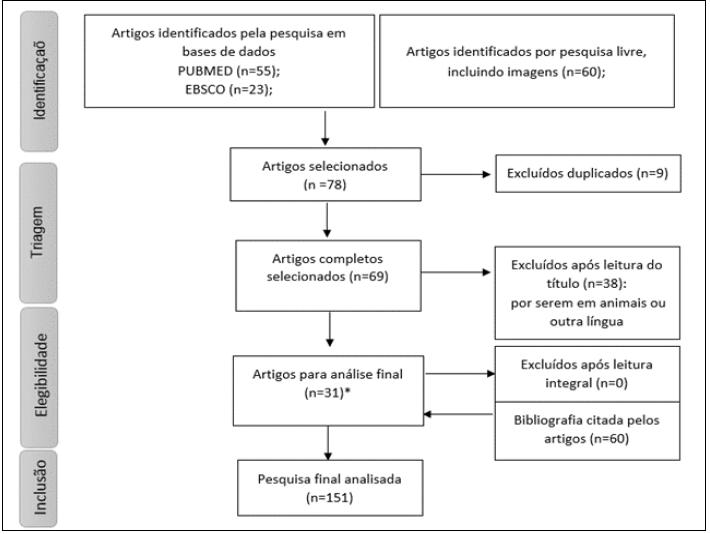
A estratégia utilizada para encontrar artigos pertinentes encontra-se no Fluxograma 1.
*( 1,5,7,8,12,13,15,19,22,23,24,25,26, 28, 29, 30,37, 38, 39, 44,53, 55, 56, 60, 61, 66, 84, 142, 153)
Fluxograma 1 Metodologia de seleção dos artigos
Foram identificados 78 artigos potencialmente relevantes. Após eliminação dos duplicados e leitura do título/ resumo, foram selecionados 31 artigos para análise. Através de referências potencialmente relevantes citadas pelos 31, agregaram-se mais 60, tendo sido complementados com pesquisa livre (motores de busca generalistas).
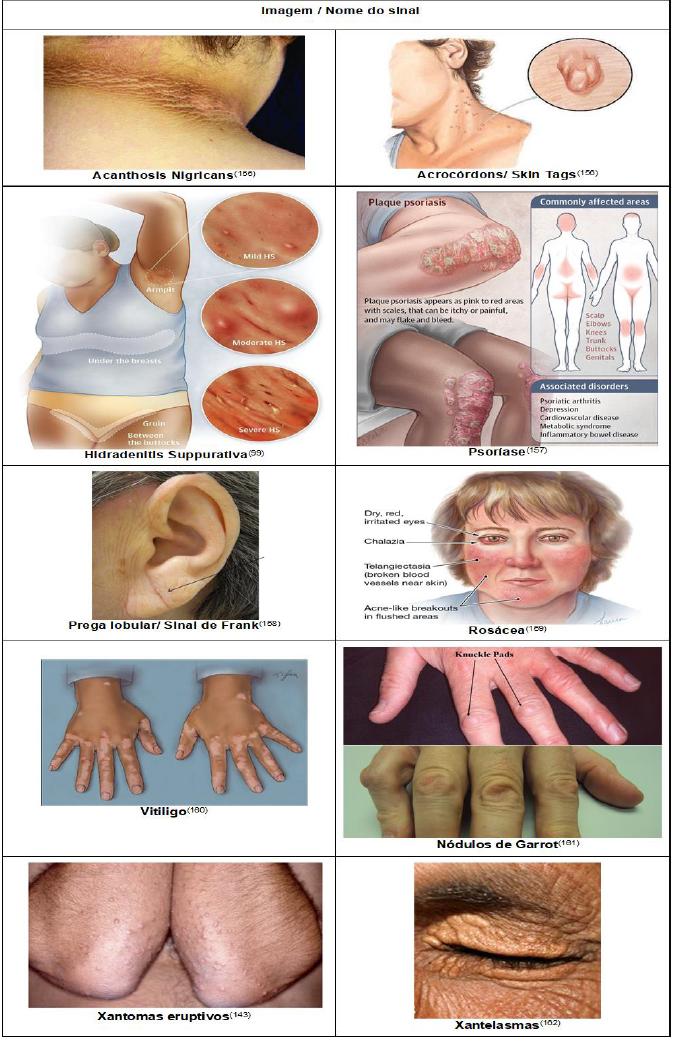
A sinalização da insulina confere papéis bem mais abrangentes que apenas o metabolismo da glicose ou lipídico, influenciando também respostas de proliferação, diferenciação e apoptose das células (incluindo as que constituem a pele)1. A relação entre a pele e a RI é de tal modo interligada, que existem inclusive hormonas, como exemplo da hormona estimuladora dos melanócitos (α-MSH) que, para além de estimular a produção de melanina, parece desempenhar um papel na sinalização da insulina e regulação da ingestão alimentar19,20. Por isso, mecanismos que afetem a sensibilidade à insulina poderão afetar o normal equilíbrio da pele1,12,13. A hiperinsulinemia (na maioria das vezes consequência da insensibilidade dos recetores à sua ação) resulta na ativação dos recetores de IGF-1 (Insulin Growth Factor-1) nos queratinócitos e fibroblastos, originando a sua proliferação (esta via será melhor explorada nos capítulos seguintes)21. Em condições de inflamação crónica, níveis elevados de moléculas pró inflamatórias podem induzir RI1 e, por sua vez, induzir disfunção microvascular, incluindo acumulação de produtos finais de glicação avançada (AGEs), acabando por prejudicar o equilíbrio da pele (menor irrigação/ nutrição)22. Esta associação é bidirecional: elevados AGEs aumentam o risco de RI em quatro vezes, estimulando reações inflamatórias e levando a maior dano celular8,23. A disfunção microcirculatória já é conhecida na obesidade, DM2, HTA e SM8,24-26 (onde se verifica maior RI, stress oxidativo, e ativação de fatores de transcrição inflamatórios, como o NFKB), existindo já disfunção microvascular mesmo em patamares (ainda) normoglicémicos8, demonstrando que não só a hiperglicemia poderá causar dano, mas também as disfunções metabólicas que a precedem8,27. Assim, manifestações cutâneas são comuns em alterações metabólicas12 e podem alertar ou indicar para a severidade da SM1,21. Segundo Stefadani, qualquer disfunção metabólica pode ocasionar disfunção cutânea (e vice-versa), ao partilharem biomarcadores, como hiperinsulinemia, stress oxidativo ou inflamatórios, nomeadamente o TNF-α (fator de necrose tumoral α) e algumas interleucinas6: já vários estudos demonstram um aumento destes marcadores em várias patologias cutâneas e na SM6,7. Encontra-se, resumidamente, descrita uma associação forte entre SM/ RI e patologias cutâneas como acanthosis nigricans, acne, psoríase; uma associação potencial com acrocórdons, alopécia androgenética, hidradenite supurativa, estomatite aftosa recorrente, hirsutismo; e de modo moderado a prega lobular diagonal, nódulos de Garrot, rosácea, líquen plano, vasculites, esclerodermia e queratose pilar1,5-7,12,15,28,29. Seguidamente discutiremos os que são mais abordados e os que apresentam maior plausibilidade biológica. De modo a facilitar a compreensão, os autores disponibilizam na Figura 1 a aparência típica de alguns dos sinais.
Acanthosis nigricans (AN)
AN é uma dermatose caracterizada por espessamento e hiperpigmentação cutânea, com lesões simétricas, aveludadas, da cor da pele ou acastanhadas, variando entre 1 mm e 1 cm, geralmente assintomáticas, que podem surgir de forma progressiva em qualquer zona do corpo, mas especialmente nas zonas de pregas cutâneas: axilas, virilhas, pescoço, fossa cubital, poplítea e região umbilical; com menor frequência nas pálpebras, planta dos pés e palma das mãos21,30,31. Histologicamente, verifica-se uma estimulação proliferativa dos queratinócitos, melanócitos e dos fibroblastos na epiderme, com consequente hiperqueratose e hiperpigmentação12,32. Existem diferentes classificações para a AN, entre elas a AN maligna (síndrome paraneoplásico, associado a adenocarcinomas do trato gastrointestinal ou genitourinário), forma benigna (forma genética rara autossómica dominante, presente à nascença ou adolescência), induzida por fármacos (como o ácido nicotínico, insulina ou corticosteróides sistémicos) ou associada a endocrinopatias (cuja nomenclatura anterior era pseudo-AN, reservada a sujeitos obesos, atribuídos à fricção e sudorese)21,31,33,34. Dentro das endocrinopatias destacam-se associações à obesidade, SM, DM2, síndrome de ovários poliquísticos (SOP), lipodistrofias, síndrome de Cushing, uso de anticoncecionais orais, hirsutismo ou doença de Addison (patologias estas que cursam com RI/mSM)12,21,34.
A primeira associação entre AN e a RI data de 197635, cujos autores relatam um mecanismo complexo, onde a RI produz aumento dos níveis circulantes de insulina (hiperinsulinemia compensatória), que estimula o aumento da proteína IGF (Insulin Growth Factor). A atividade dos recetores IGF é regulada pelas IGFBPs 1 e 2 (IGF Binding Proteins), que aumentam a semi-vida do IGF-1. Estas proteínas encontram-se diminuídas em indivíduos obesos e com hiperinsulinemia, aumentando os níveis de IGF-1 em circulação e nos tecidos-alvo1,36. Este aumento de IGF-1 circulante permite uma maior interação com os seus recetores (que também se encontram expressos nos queratinócitos e fibroblastos), conduzindo ao estímulo da proliferação21,33,37. Outros mediadores poderão ser indiretamente estimulados pela hiperinsulinemia, como os EGFR (recetor do fator de crescimento epidérmico) e os FBFR (recetor do fator de crescimento de fibroblastos) na epiderme21,32,38. Este fenómeno não se encontra relacionado no AN congénito benigno e paraneoplásico33. Indivíduos com AN apresentam valores mais elevados de insulina em jejum comparativamente a controlos normais e controlos obesos emparelhados à amostra sem AN, tanto em crianças39-45 como em adultos30,38,46-48, sugerindo a AN como um marcador de SM, resultante de RI30. Apesar de poder ocorrer em qualquer idade, a AN é mais comum na idade adulta. Os números de prevalência da AN variam muito entre estudos, contudo existe uma maior prevalência especialmente em populações obesas (podendo atingir os 74%), DM2 e distúrbios endócrinos. Pode variar consoante a etnia (é mais comum em nativo-americanos, seguido de africanos, hispânicos, caucasianos, e mais raro em asiáticos)1,30,34. Indivíduos com AN apresentam um risco maior em apresentar SM e consequentemente de desenvolver DM2 (incluindo grávidas que desenvolvam AN na gestação)30,46,49,50, sendo que 49% das crianças com AN e 86% de adultos obesos com AN parecem preencher critérios de SM12,47. De facto, os indivíduos com AN apresentam uma possibilidade 1.97 superior (OR: Odds Ratio 1.97) de também apresentar DM2, quando comparado com sujeitos adultos emparelhados para IMC, idade e número de fatores de risco para a DM2 (HTA, etnia e histórico familiar de doença)50. Relativamente ao excesso de peso, adolescentes obesos com AN apresentam uma possibilidade 2.59 vezes superior em apresentar hiperinsulinemia (OR 2.59) e RI (OR 2.68), quando comparado com adolescentes obesos sem AN45. Já em adultos obesos com AN, a possibilidade comparativa em apresentar RI pode ser até 11 vezes superior (OR), comparativamente a controlos41, reportando-se uma correlação positiva entre a severidade da AN e hiperinsulinemia, hiperglicemia, obesidade e perímetro abdominal, dislipidemia, valor de resistência à insulina HOMA-IR (Homeostasis Assessment Index), hiperuricemia e de transaminase glutâmico-oxalacética 32,37,40,41,43.
Apesar de na maioria dos casos se associar a RI, torna-se também importante diferenciar a AN associada à malignidade: se o trabalhador desenvolve AN de forma aguda, especialmente nas regiões palmar e plantar, sem história familiar de DM2 ou sem biótipo sugestivo de RI/SM (obesidade, perímetro abdominal aumentado, HTA, rácio Tg:HDL elevado)33,34,51, deve ser despistada uma neoplasia. Neste caso, substâncias segregadas pelo tumor podem ser estimulantes, como por exemplo o TNF-α (que também está associado a obesidade), similar ao EGF (fator de crescimento epidérmico)21,52. As opções terapêuticas incluem mudanças do estilo de vida (perda de peso, alimentação adequada e atividade física), farmacoterapêutica dirigida a patologias associadas, ou intervenções tópicas diretas (cremes despigmentantes ou queratolíticos, terapêutica a laser, dermoabrasão)32. Na maioria dos casos este marcador passa despercebido, pois apesar de ser reconhecido um escurecimento da pele, as primeiras opções de tratamento costumam ser os tratamentos externos1,12.
Acrocórdons (AC)
Acrocórdons correspondem a papilomas sésseis ou pedunculares normo ou hipercrómicos, de manifestação mais comum no pescoço, axilas e virilhas, frequentemente confundidos com pequenas verrugas, formados por hipercrescimento da pele, variando entre 2 a 10 mm29. Histologicamente, são caracterizados pela perda de fibras de colagénio e dilatação de capilares sanguíneos, indolores, mas que podem ser fonte de desconforto1,21,53 e, por esse motivo, na sua maioria são apenas visualizados numa vertente estética54. Estima-se que 20-25% da população-geral apresente AC, subindo para 37-46% em idades superiores a 40 anos, dos quais aproximadamente 15% apresentem mais de 8 destas lesões no corpo, e particularmente um aumento em mulheres durante a gravidez (período de maior RI)21. A sua etiologia ainda não é totalmente conhecida, mas são reportados fatores como fricção cutânea, obesidade, hiperinsulinemia (onde a proliferação dos fibroblastos e queratinócitos ocorre via ativação dos recetores IGF-1, num mecanismo semelhante ao descrito na AN)5, intimamente relacionados aos níveis de insulina em jejum21, distúrbios hormonais ou etiologia vírica concomitante (por exemplo, ao HPV)5,28,55. A sua manifestação é reportada em indivíduos com SM/RI1,56 e a condições a esta associadas, como a síndrome dos ovários poliquísticos (SOP), excesso de peso ou obesidade 1,53,54,56-58, dislipidemia1,12,28,29,54-60, proteína C reativa aumentada ou inflamação crónica56,59, HTA56,57,59, intolerância à glicose - incluindo DM2, hiperinsulinemia ou RI1,12,21,29,53,56-59, aumento de leptina53,56,59,60 e patologia tiroideia54,61. Embora os estudos que abordem a leptina não sejam consistentes53,54,59,60, alguns autores descrevem um aumento da leptina em indivíduos obesos, bem como o fato de parecer que esta tem um papel estimulador da proliferação dos queratinócitos53.
Estas associações parecem aumentar à medida que aumenta o número de AC pelo corpo. Entre os indivíduos com múltiplos AC, 33% a 74% são obesos (em dose-resposta), 28% a 81% apresentam alterações no metabolismo de glicose e 26% a 46% tem DM228,29,59, variando a percentagem de acordo com a população estudada (maioritariamente estudos de caso-controlo ou transversais). Segundo Sudy62, AC múltiplos (acima de oito) representavam um marcador de DM2 mais sensível que a AN em identificar indivíduos com hiperinsulinemia e RI, paralelamente com hiperglicemia e DM2. As prevalências podiam atingir 52% (n=110) de DM2 em indivíduos com AC comparativamente a 10% dos controlos63. O aumento do número de AC (mais de 30) era um preditor de DM2 ainda mais forte64. Em estudos que incluíam a análise da insulina59,65, indivíduos com AC apresentavam valores mais elevados de insulina em jejum, parecendo ser mais importante que a própria glicemia em jejum.
Num estudo de casos-controlos, Shaheen et al. comparou 90 indivíduos com múltiplos AC (n=30 com IMC normal, n=30 com excesso de peso, n=30 obesos), com controlos sem AC emparelhados para o peso, sexo e idade: 71% dos indivíduos com AC reunia critérios de SM, face a 0% dos controlos, reportando-se nos participantes com AC uma correlação positiva entre o número de AC e a SM independentemente do peso, mas que se tornava mais forte ao considerar o perímetro abdominal53. Os níveis séricos de leptina e HOMA-IR eram superiores nos indivíduos obesos com AC, comparativamente a controlos obesos sem AC53. Mathur66 não encontrou associação entre AC enquanto marcador para a RI, embora incluísse apenas 10 indivíduos normoponderais e não diabéticos com múltiplos AC versus controlos. Um estudo transversal56 calculou o OR ajustado (para sexo, idade, tabagismo e IMC) e demonstrou, em indivíduos com múltiplos AC, uma possibilidade 3.92 vezes superior (OR) em apresentar SM, hiperglicemia em jejum (OR 3.37), obesidade central (OR 2.98), hipertrigliceridemia (OR 2.23), HTA (OR 2.14) e redução de colesterol HDL (OR 2.08). Neste estudo, 62% dos casos de AC apresentavam SM versus 28% dos controlos. De acordo com os autores, numa subanálise dos indivíduos sem DM2, HTA ou dislipidemia, a presença de AC já implicava, no geral, níveis não-ideais nas análises sanguíneas, apesar de não atingirem relevância estatística, mas sempre numa tendência positiva: sugerindo que os AC poderiam ser marcadores precoces de fases iniciais de SM, antes de se conseguirem reunir critérios para o diagnóstico oficial56.
Relativamente à DM2 (cujo maior fator de risco é a RI), a primeira associação iniciou-se com Margolis em 1976 que reportava um aumento de AC nestes indivíduos, e atualmente parece uma das associações mais aceites5,54,67, com vários estudos posteriores a reportar uma presença paralela de DM256,62,68 ou alterações do metabolismo da glicose ou insulina como preditores56-59. Encontra-se reportado um aumento da intolerância à glicose em indivíduos com AC, com 46% a apresentar dislipidemia, 65% HTA e 71% obesidade57. São também reportadas associações entre AC e alterações do metabolismo lipídico, geralmente na forma de colesterol total elevado, aumento dos triglicerídeos e redução do colesterol HDL5,54,58,59,69. Sari59 (n=113) reportava dislipidemia em 59% dos casos com AC na forma de hipercolesterolemia, hipertrigliceridemia e baixo colesterol HDL, bem como aumento da prevalência de HTA, hiperinsulinemia, HOMA-IR, obesidade, hiperglicemia e PCR.
Rezzonico61 reportou, em indivíduos com AC, um aumento da prevalência de alterações tireoidianas na forma de nódulos ou aumento do volume relativamente a controlos (neste caso, 54,5% dos casos com AC apresentavam nódulos comparando com 17% dos controlos; 18% dos casos apresentava tiroide aumentada versus 4% dos controlos, e a RI estava presente em 82% dos casos face a 18% dos controlos), discutindo o papel da hiperinsulinemia na proliferação nos AC e tecido tiroideio61. Num estudo transversal de Platsidaki54 (n=88), avaliaram-se indivíduos numa clínica de dermatologia com AC. Embora o hipotiroidismo não apresentasse uma associação significativa com AC, verificou-se uma tendência considerada importante (à medida que aumentava o número de AC, paralelamente aumentava o número de indivíduos com hipotiroidismo; ou seja, um OR 5.4 vezes superior de apresentar AC). Aqui, o excesso de peso e obesidade representavam, respetivamente, um OR 4.9 e 2.9 vezes superior de apresentar mais AC do que indivíduos normoponderais, e os indivíduos com AN um OR 19 vezes superior de apresentar AC múltiplos (neste estudo, considerados acima de 10). Assim, os AC podem ter um significado clínico, pois ocorrem com maior frequência em pessoas com maior risco metabólico, estando associado a critérios de SM, o que significa que embora um ou dois AC não sejam incomuns, um surto repentino pode indicar algo mais. Sugere-se que em indivíduos com múltiplos AC se despiste SM: desordens de intolerância à glicose, seja na forma de RI ou de DM221, bem como das complicações associadas. Estes sinais, por serem assintomáticos, são muitas vezes ignorados, mas são de grande importância visto que a RI representa um dos mais importantes fatores de risco modificáveis.
Alopecia androgenética (AA)
Caracterizada por uma perda de folículos capilares conhecida como hereditária, por hiperandrogenismo em indivíduos geneticamente suscetíveis, pode apresentar uma distribuição difusa, ou demarcada nas regiões frontal e parietal1,6,70,71. O hiperandrogenismo reduz a fase anágena (de crescimento), e com vários ciclos do género, os folículos tornam-se progressivamente menores1. Reconhece-se que a insulina influencia o metabolismo dos androgénios e o ciclo de crescimento do folículo e a coexistência de SM poderá acelerar a AA1,71. Em mulheres, encontrou-se uma associação com a severidade da perda folicular especialmente relacionada a HTA e obesidade72. A prevalência de SM pode atingir os 53% dos casos de AA73-76, bem como diferenças significativas nos triglicerídeos74,75,77, tensões arteriais73-75,77-80, colesterol total74,77,78,81, colesterol HDL73,75, colesterol LDL74, circunferência abdominal73-75,80,81, glicemia em jejum74, insulina em jejum71,77,78,80,81 e HOMA-IR71,78,81, sugerindo que em homens com idade inferior a 35 anos poderá ser um marcador precoce de SM73,74,80,81. Numa metanálise de 2014, a AA demonstrava um risco aumentado de SM (OR 4.49), RI (OR 4.88), hiperinsulinemia (OR 1.97) e DCV (OR 1.22)77. Pela definição de SM, são exigidos normalmente dois a três critérios de uma lista definida e alguns autores não conseguem demonstrar associação com SM propriamente dita71,76,79, mas apenas com os seus critérios isolados, sugerindo que uma deteção precoce desses critérios poderá determinar o curso da SM78.
Manifestações cutâneas de carácter inflamatório
Acne é uma condição comum e facilmente identificável, apresentando-se como uma inflamação dos folículos pilossebáceos, devido a hiperqueratose e hipersecreção de sebo, incluindo lesões que variam desde comedões a pápulas, pústulas ou nódulos, considerada benigna e autolimitada em cerca de 90% dos adolescentes82. No entanto, poderá ser uma bandeira vermelha em relação à SM1,82,83. Biagi reportou que 61% dos indivíduos com SM apresentavam acne e os que apresentavam maior dano cicatricial era quem detinha valores mais elevados de triglicerídeos82.
Também se quantificou que o acne se manifestou em até 70% das mulheres com SOP (um cenário típico de RI), sendo um acne que persiste na idade adulta ou é refratário a tratamentos convencionais1. Caracteristicamente na SOP, a RI cursa com hiperinsulinemia, aumentando a concentração de ácidos gordos livres, reduzindo a globulina de ligação às hormonas sexuais (SHBG), aumentando os níveis de androgénios livres (80-85% das mulheres com hiperandrogenismo apresentam RI)1,84. Os sinais desta patologia fornecem um cenário especialmente abrangente das consequências da hiperinsulinemia a nível dérmico: hirsutismo em 40-92% dos casos, acne 50-70%, alopecia androgenética (num estudo84 35%), AN6,84-86, e em menor frequência seborreia ou virilização1.
Além do SOP, a relação entre acne e SM é também evidenciada por estudos que mostram que uma alimentação insulinotrópica, de elevada carga glicémica ou de rácio de ómega 6: ómega 3 desadequado, que poderão exercer efeito na patogénese, ao promover a sinalização da insulina/IGF-1 ou contribuir para o stress oxidativo1,87-89. De facto, o acne está ausente em populações não-ocidentalizadas, que apresentam uma sinalização inferior de insulina/ IGF-11,17,87,88. Uma vez que os recetores de insulina e IGF-1 se expressam nos queratinócitos, o seu aumento contribui como estímulo para hiperproliferação, hiperandrogenismo e maior síntese de sebo, contribuindo para a severidade do acne1,82,90,91. A personalização destes macronutrientes (especialmente com menor teor glicémico) é capaz de reduzir o tamanho das glândulas sebáceas, da inflamação e da sinalização hormonal, com efeitos positivos na patologia88,92-95. Sabe-se que o acne per se apresenta num quadro inflamatório de base82,96 e, por isso, alguns autores sugerem classificá-lo como doença crónica83; por outro lado, ao estimular a síntese de sebo, otimiza-se um meio para proliferação de patógenos (como o Propionibacterium acnes e Malassezia)1,82. Parece assim apenas desenvolver-se num meio metabólico ótimo, mostrando-se mais como um marcador sistémico do que unicamente dermatológico1,17,87 e os profissionais devem visualizá-lo como uma oportunidade para promover saúde.
De modo similar, encontra-se reportada uma associação da SM à Rosácea97: uma doença inflamatória crónica, caracterizada por um eritema facial, vasos sanguíneos mais visíveis, pápulas e pústulas. Nesta condição está documentada associação a dislipidemia, proteína C reativa, HTA, consumo de álcool e tabagismo - fatores de risco comuns a SM e DCV; estes indivíduos, especialmente se apresentarem história familiar, devem ser investigados mais detalhadamente6,28,97.
A Hidradenite Supurativa (HS), também conhecida como hidrosadenite supurativa ou acne inversa, é uma desordem cutânea oclusiva folicular, que geralmente afeta as axilas, região inguinal ou períneo98,99, e atinge mais mulheres, num rácio de 2-3:1, em até 4% da população1,7,16,98. Na prática, é percecionada como “furúnculos” dolorosos de repetição, com referência de história familiar. A etiologia acredita-se ser multifatorial, pela proliferação de queratinócitos e consequente hiperqueratinização do epitélio folicular com oclusão do canal pilossebáceo, levando à acumulação de sebo e resíduos intrafoliculares abaixo da oclusão, produzindo um infiltrado inflamatório polimórfico, com formação de túneis, preenchidos com conteúdo sebáceo e purulento16,100. Este processo inflamatório finaliza com tecido cicatricial1,99, afetando a qualidade de vida dos indivíduos, tanto ao dificultar atividades de vida diárias, como na prevalência aumentada de depressão16,99. Está descrito que indivíduos com HS apresentam normalmente mais dias totais de perda de trabalho, mais custos indiretos e menor ganho anual que indivíduos sem a patologia, influenciando por isso ganhos pessoais e produtividade das empresas101. Reconhece-se na HS um aumento da prevalência de SM, estando descrito que a maioria destes indivíduos são obesos, apresentando hiperandrogenismo e acne associados102, tendo num estudo atingido uma prevalência de 88% de obesidade e cuja associação forte era independente da idade, mesmo com patologia moderada16. Uma metanálise de 2015103 indicou que indivíduos com HS apresentavam uma possibilidade de apresentar SM 2.22 vezes superior (OR 2.22), bem como de obesidade (OR 3.45); obesidade abdominal (OR 2.97), DM2 (OR 2.85), baixo colesterol HDL (OR 2.48), hipertrigliceridemia (OR 1.67) e tabagismo (OR 4.34)103; com números similares em duas metanálises de 2019104,105, enfatizando que profissionais que abordem HS devem estar despertos para estas associações. Alguns autores evidenciam inclusive um aumento da mortalidade por todas as causas106. Discute-se que a associação derive de fatores genéticos ou ambientais comuns, numa partilha de vias inflamatórias98, sendo que atualmente se desconhece uma cura, mas existem tratamentos disponíveis que focam a manifestação inflamatória (antibióticos, corticosteróides, laser ou, em casos graves, imunossupressão)99. Do ponto de vista fisiopatológico, a própria obesidade está associada a uma condição de inflamação crónica e hiperinsulinemia, resultando num aumento da expressão de proteínas inflamatórias, hiperandrogenismo, maior fricção mecânica e alteração da microbiota da pele, podendo atuar em sinergia como mediadores e perpetuadores da HS16. Sabendo que um estilo de vida ocidentalizado que estimule a hiperproliferação dos queratinócitos é o mesmo que potencia a obesidade e SM1, alguns autores reiteram a necessidade de reduzir ao consumo tabágico e promover a perda de peso16,99,107. É importante realçar que indivíduos magros também sofrem de HS1,7, sendo as associações independentes do IMC16, uma vez que estes podem também apresentar SM. Observando a realidade por este prisma, apesar de insuficiente para traçar causalidade, consegue-se compreender que existe uma panóplia de abordagens além de antibióticos, que a HS poderá ser um marcador de um estilo de vida desadequado, que atua como mediador inflamatório, facilitando o desenvolvimento, severidade e resposta ao tratamento16. É assim recomendado avaliar parâmetros de SM em HS, independente da idade, IMC ou severidade7.
A Estomatite aftosa recorrente, vulgo aftas, representam a patologia oral mais comum, intensamente dolorosa, algumas vezes associada a stress108 e a uma hiperativação de mediadores inflamatórios como TNF-α, IL-1, e IL-628,108,109. Encontram-se nesses indivíduos valores mais elevados de insulina e resistência à insulina por HOMA-IR109, bem como uma possibilidade 1.3 vezes superior de estomatite por cada aumento de IGF-1 acima de 100 ng/ml110, sugerindo que estomatites de repetição deverão levantar suspeitas de SM109. Outros autores sugerem que se deva avaliar pré-diabetes ou DM2, uma vez que a última fornece uma OR 2.24 vezes superior de periodontite108. Assim, ao passo que um episódio de estomatite pode ocorrer naturalmente de modo isolado, a recidiva constante deste processo inflamatório deverá colocar o profissional em alerta.
Manifestações dermatológicas de doenças autoimunes
Existem possíveis interações entre alterações de mediadores inflamatórios na patogénese da SM, como o aumento da TNF-α, PCR, algumas interleucinas e a redução de adiponectinas, que se encontram também alterados em patologias autoimunes, como na psoríase ou vitiligo, e parecem desempenhar papéis de modo bidirecional6,12,15,28.
No caso da Psoríase, sabendo que alguns tratamentos também contribuem para elevar o risco de SM111, está documentada a associação entre a severidade da doença e SM, em dose-resposta6,112, tendo algumas metanálises demonstrado OR similares para SM (2.14-2.26)112,113. De facto, a Psoríase é uma doença sistémica7, que em casos severos apresenta um risco três vezes superior de SM6 e duas vezes de DM212, sendo que os biomarcadores acima descritos partilham o mesmo mecanismo inflamatório da aterosclerose6 e, por tal, indivíduos com formas moderadas ou severas apresentam as mesmas complicações que obesos: DM2, dislipidemia, HTA e doença arterial coronariana (DAC)112,114. Outros autores referem que a própria psoríase pode ser considerada uma condição pré-diabética115. Os mecanismos mais plausíveis que os autores sugerem para explicar estas alterações assumem que em indivíduos suscetíveis, valores cronicamente elevados de ácidos gordos livres aumentam a TNF-α e algumas interleucinas, induzindo a produção de glicose e reduzindo a sua captação muscular, bem como stress nas células beta pancreáticas e afetam a sensibilidade à insulina, num ciclo de inflamação crónica sistémica. A sinergia destes mecanismos induz disfunção metabólica (reportada tanto na SM como na Psoríase), assumindo uma prevalência de SM na psoríase que pode atingir os 50%6,7,28,112. Assim, indivíduos com Psoríase (e de acordo com a severidade), principalmente se apresentarem história familiar de DCV, devem ser avaliados para SM7.
O Vitiligo caracteriza-se pela perda de melanócitos, levando a despigmentação da pele, de carácter autoimune e multifatorial (numa interação entre fatores genéticos e ambientais - como exposição solar excessiva, stress e alguns produtos químicos como derivados de fenol). Alguns estudos associam vitiligo e SM ou RI12,116, argumentando que poderão estar relacionadas à sobreexpressão de algumas citoquinas pró inflamatórias, TNF-α e hiperhomocisteinemia, tipicamente encontrados nestes indivíduos15,28,116. Estas substâncias podem induzir RI, disfunção endotelial e consequente desenvolvimento de SM e aterosclerose15,28. De facto, descreve-se em portadores de vitiligo valores mais elevados do rácio LDL/HDL, insulina, peptídeo C, tensões arteriais, e menor HDL, que indivíduos sem a patologia28,117. A homocisteína, por si, afeta a síntese de melanina (reduzindo a capacidade anti-inflamatória endógena)28. Por outro lado, os melanócitos não se circunscrevem apenas à derme, mas também ao epitélio da retina, algumas células auditivas e adiposas (nestas últimas parecendo desempenhar um papel essencial no combate aos radicais livres - ROS e stress oxidativo, pelo que a sua destruição poderá ter implicações no aumento de ROS, contribuindo para a patogénese, tanto do Vitiligo como da SM116. Apesar de não se poder referir causalidade da SM nestas patologias autoimunes, um agravamento destas poderá sugerir SM.
Nódulos de Garrot
Também conhecidos como knuckle pads, coxins interfalangianos, holodermia, tylositas articuli, fibroma subcutâneo, keratosis supracapitularis, pulvillus digiti, discreta queratoderma, tumor benigno do córion, fibrocondroma ou hipoplasia congénita - representam lesões benignas de hiperqueratose, caracterizadas por pápulas ou nódulos nas zonas interfalangianas articulares proximais6,28. Num estudo, foram comparados 46 indivíduos com nódulos de Garrot com 46 indivíduos sem a condição e reportou-se 70% dos casos eram hipertensos e 94% obesidade abdominal, valores significativamente superiores aos controlos, com uma prevalência de 66% de SM nos casos comparativamente a 52% nos controlos118. As primeiras referências na literatura parecem ser relativas a associação a contratura de Dupuytren, condição esta que faz parte da lista das manifestações da “mão diabética”119-121, descrevendo-se que os nódulos e a contratura são expressões de uma mesma alteração fibromatosa119. Assumindo que na história natural da DM2 se verifica um aumento da RI prévio122,123, e que as suas características cumprem critérios de SM, faz sentido abordar alterações metabólicas em indivíduos que apresentem estas alterações cutâneas.
Prega diagonal auricular (Sinal de Frank)
O sinal de Frank representa uma linha no lobo auricular que se estende do trago até a borda posterior num ângulo próximo a 45°. Inicialmente identificada em 1973, quando Sanders Frank a associou à DAC e à SM, ao observar que 19 dos 20 pacientes que acompanhava com prega apresentavam pelo menos um dos fatores de risco conhecidos124. Desde aí, vários autores tentaram aprofundar a associação a patologias cardiovasculares: em 2015, uma revisão125 que contemplava 75 artigos, encontrou associação em 50 artigos versus 15 que não encontravam, retratando que a prega era mais prevalente no envelhecimento (assim como a DAC), parecendo ser influenciada por fatores genéticos comuns, mas variando em etnias (por exemplo, a associação é mais forte em caucasianos, negros e latino-americanos, e mais fraca em índios americanos, samoanos havaianos e chineses, sendo que a prevalência da prega nestas populações é inferior às americanas ou europeias126). Nos estudos que encontram associação (maioritariamente casos-controlo e transversais), a prevalência de prega na DAC variava entre os 45-91% nos casos, e 5-60% nos controlos, na maioria de forma independente de outros fatores de risco, como obesidade, HTA, tabagismo ou DM2125,127, sendo que alguns estudos de necropsia demonstravam que a presença bilateral estava associada a maior dano de DAC, do que unilateral, e menor ainda se ausente125,128,129. Uma metanálise130 mostrava que a sensibilidade geral do sinal rondava os 62% e a especificidade 67% (esperava-se que 62% das pessoas com DAC apresentassem a prega, e 67% das pessoas sem DAC provavelmente não a apresentariam, apesar da ausência não descartar a patologia), congruente com estudos posteriores131. É reportado, nestes indivíduos, uma possibilidade superior para DAC (OR 3.3), cujo valor preditivo positivo do sinal varia entre 42% a 96%125,131. Na prática, é sugerido que a junção da presença da prega ao algoritmo de Diamond-Forrester é mais eficaz na predição da DAC do que cada um dos métodos isoladamente132, podendo independentemente de outros fatores de risco prever DCV em 10 anos de follow-up5,133.
Uma vez que as DCV englobam a DAC e doenças cerebrovasculares, vários estudos têm também abordado essa vertente. Nazzal128 avaliou indivíduos com acidente vascular cerebral (AVC), reportando a presença da prega em 79%, mais prevalente no AVC (89) do que em acidentes isquémicos transitórios (73%). Em média, os indivíduos com prega eram mais velhos, mas as associações pareciam suficientes para assumir que a prega deveria ser adicionada à lista de preditores de DCV128. Lee134 reportou uma associação entre a prega e o declínio cognitivo em idosos com demência. Outros autores referem a prega como marcador silencioso de doença vascular, particularmente no espessamento da camada íntima-média da carótida135-139, doença vascular periférica128, ou disfunção endotelial140. Num estudo de casos-controlos, a prega estava associada a maior deposição de tecido adiposo pericárdico e espessura da íntima média da carótida como fatores de risco independentes, mesmo em indivíduos sem DAC139. Em indivíduos com pega constatou-se um aumento de biomarcadores associados a aterosclerose (Proteína C reativa, pentraxina 3), ou de stress oxidativo (malondialdeído), espelhando dano e inflamação microvascular, menor irrigação, e por tal menor produção de elastina136,141. Torna-se necessário refletir o possível fator confundidor do aumento da prevalência da DAC e prega com o envelhecimento, e que o valor preditivo da prega deveria ser restrito aos mais jovens, ao espelhar um processo de envelhecimento mais rápido, que acelera a progressão da aterosclerose e disfunção microvascular. O mecanismo pode estar relacionado com a sinalização extrema de IGF-1, como nos AC e AN, após degeneração do tecido conjuntivo que sustenta a epiderme, derivada de disfunção microvascular e isso poderia demonstrar paralelamente degeneração microvascular noutros locais (como as artérias coronarianas)5. São necessários estudos mais prolongados e robustos que aprofundem a significância como preditor, compreendendo limitações como a idade, sexo, etnias e a forma da prega (por exemplo, existe uma maior prevalência de prega de manhã após dormir). A maior prevalência em idosos também reduz a sensibilidade125, embora o sinal pareça ser mais sensível e específico para DAC em pessoas mais jovens (menos de 50 anos)125,131. No geral, apesar de não estar estabelecido um mecanismo de causa-efeito, e embora não seja um sinal da camada superficial mas das estruturas base que sustentam a epiderme, o facto de ser reconhecível a olho-nú torna-a potencialmente significante5 e indivíduos com prega poderiam beneficiar de uma avaliação precoce de SM, especialmente se concomitantemente apresentarem mais fatores de risco.
Tumores malignos cutâneos
Poderão também ser um sinal de SM6. Numa coorte com acompanhamento de 12 anos, o melanoma estava associado a HTA (ambos os sexos); homens com melanoma apresentavam maior IMC, e mulheres com melanoma apresentavam valores glicémicos superiores aos controlos. Mulheres com carcinoma das células escamosas (não-melanoma), apresentam tendencialmente maiores valores glicémicos e de triglicerídeos6,142. Estes valores sugerem que poderão apresentar mecanismos de patogénese similares relacionados ao metabolismo da glicose ou lipídico.
Xantomas eruptivos e Xantelasmas
Apesar de se apresentarem em locais diferentes, ambos partilham a associação a alterações do metabolismo lipídico. Os Xantomas eruptivos são pápulas amareladas, geralmente na região dos cotovelos, glúteos ou região posterior das coxas, com halo eritematoso, surgindo geralmente após períodos de dislipidemia (principalmente hipertrigliceridemia severa, muitas das vezes apresentando plasma lipémico), ou como consequência de um maior descontrolo glicémico, associados a obesidade, SM, DM2 ou síndrome de quilomicronemia5,143,144. O mecanismo parece estar relacionado com a atividade da lipase (cuja RI também a reduz), resultando na incapacidade em eliminar eficazmente o excesso de quilomicra e de lipoproteínas de baixa densidade, levando a estes sinais histologicamente demarcados por macrófagos repletos de lípidos, que se acumulam na pele. De facto, xantomas eruptivos podem ser o primeiro sinal clínico de dislipidemia severa e por tal uma forma única de conseguir um tratamento precoce143.
Os Xantelasmas representam também acumulação de lípidos, mas limitado às zonas palpebrais, considerados benignos, mas também sugerindo dislipidemia6, associados a esteatose hepática não-alcoólica (implicada na RI)5,145, baixo colesterol HDL, elevado colesterol total, LDL ou apolipoproteína B (maior risco aterogénico)5,146,147 e consequentemente de DCV128,148, especialmente em idades jovens149. Um estudo reportou uma prevalência de 50% de perfil lipídico anormal em portadores de xantelasma e que a sua presença em indivíduos normolipidémicos parecia relacionar-se fortemente com uma maior (suscetibilidade de) peroxidação lipídica (fortemente implicada no colesterol LDL oxidado, mais aterogénico) e, por isso, apresentar também um maior risco de aterosclerose150. São também sugeridos, noutros estudos, polimorfismos genéticos e alterações no metabolismo das lipoproteínas149,151,152, que cursem com valores aumentados de apolipoproteína B nesses indivíduos151. Segundo os autores, a presença de xantelasmas não deve ser considerada benigna e a deposição lipídica (mesmo em indivíduos normolipidémicos) pode estar relacionada com um pior metabolismo das lipoproteínas e aumento do potencial aterogénico149,151,152. Ao acompanhar 1700 indivíduos de meia-idade por 25 anos, identificou-se o xantelasma como fator associado a mortalidade por DCV145. Estes sinais sugerem a avaliação dos critérios de SM nestes indivíduos (hipertrigliceridemia, dislipidemia, RI, DM2 ou DCV)28,143,147, como atuação precoce.
Agregando a maioria dos sinais incluídos nesta revisão, relembramos uma série de casos de uma clínica, onde indivíduos apresentavam à admissão “acne keloidalis nucae”, uma patologia inflamatória muito similar a HS, mas limitada ao pescoço, iniciando por uma foliculite e culminando em pápulas que nunca desapareciam na totalidade, exigindo exérese. Todos apresentavam obesidade abdominal, HTA, dislipidemia, AN bem demarcada no pescoço e axilas com múltiplos acrocórdons, histórico de DM2 nos pais, e apesar de dois se apresentarem normoglicémicos, um dos casos detetou ao momento do tratamento uma glicemia em jejum de 290 mg/dL e pós-prandial de 467 mg/dL. À quarta admissão, os autores rapidamente associaram a queixa a SM153. O mesmo acontece noutros casos, por exemplo, em xantomas eruptivos, onde são diagnosticadas no momento dislipidemia severa e outras alterações que cumprem critérios de SM143.
IMPLICAÇÕES PARA A PRÁTICA E LIMITAÇÕES
As limitações das evidências nesta revisão descritas cruzam-se essencialmente pela metodologia pouco robusta dos estudos: relatos ou séries de casos, transversais ou retrospetivos (maioritariamente casos controlos): pela sua natureza sujeitos a vieses e confundidores, como estilos de vida desadequados, tratamentos ou mesmo a seleção de participantes. Deste modo, não é possível estabelecer claramente um mecanismo de causa/ efeito entre SM e disfunções que afetam a morfologia e função da pele. Mas o conhecimento, biologicamente plausível, de que ambas ocorrem no mesmo momento ou se precedem, mesmo em estágios precoces de alterações metabólicas8,27,56,154, pode criar uma justificativa para investigar melhor os critérios de SM em alguns indivíduos (e principalmente quando agregam essas manifestações cutâneas a biotipos conhecidos de SM). Por outro lado, existem vários estudos que não encontram associação com SM (de acordo com as várias classificações, que incluem dois a três critérios), mas com os seus critérios isolados, sugerindo que a SM/ RI não surge de modo agudo, mas num continuum de alterações metabólicas, que ocorre num largo espectro de acordo com a suscetibilidade e resposta individual, sendo possível detetá-la antes de se reunir os critérios que a classifiquem. Tendo em vista que a RI se desenvolve antes do aparecimento das patologias associadas, a sua identificação e tratamento precoce exercem um papel preventivo primário ideal. A Semiologia é muitas vezes um “sinal” esquecido, e poderá ditar o curso da SM, se detetada pelo profissional que é capaz de olhar, ver e perceber o que está distante e atuar atempadamente.
CONCLUSÃO
Manifestações cutâneas aparentemente inócuas e benignas podem estar associadas à SM e sugerem um estudo mais aprofundado. Considerando o exposto, torna-se fulcral o reforço desta informação aos profissionais de saúde, e mais investigação para a deteção precoce de alterações metabólicas. O incentivo a mudanças de estilo de vida que visem abordar a síndrome metabólica é fundamental. Assim, de forma económica aos serviços e não invasiva, o enfermeiro pode aprimorar o seu olho clínico e poder desta forma prevenir a doença, ajudando a equipa a detetar precocemente manifestações metabólicas, simplesmente olhando para a pele de quem cuida. De facto, estes sinais são passíveis de identificação por qualquer profissional, podendo ser uma mais-valia nos serviços de Saúde Ocupacional, que se encontram na vanguarda do acompanhamento de adultos, e cujo curso da doença poderá ser controlado ou mesmo revertido, com diagnóstico e intervenção precoces. Existe assim um caminho a percorrer aos serviços de saúde ocupacional, que engloba mais do que prevenir doenças profissionais ou acidentes de trabalho, englobando o trabalhador em toda a sua definição de saúde (agregando a Medicina/ Enfermagem Preventiva à Curativa) e atuando em sinergia com os Cuidados de Saúde Primários, o que acabará por influenciar positivamente a produtividade das empresas (ao prevenir ausências por doença, ou até mesmo em reduzir os acidentes de trabalho).