Introdução
O acidente vascular cerebral isquémico (AVCI) mantém-se uma causa importante de mortalidade e morbilidade em Portugal.1 A abordagem na fase aguda sofreu evolução na última década com o estabelecimento da eficácia da terapêutica endovascular (TE) na oclusão de grande vaso cerebral (OGVC).2 O diagnóstico de OGVC implica estudo arteriográfico cerebral por tomografia computorizada (ACTC) ou ressonância magnética. A maioria dos centros recorre à ACTC como método de diagnóstico. Entre as limitações da ACTC encontramos a necessidade de uso de radiocontraste (RC). A TE implica o recurso a angiografia cerebral por subtração digital em tempo real e partilha a mesma limitação.3,4) Entre os riscos do uso de RC, encontramos a lesão renal aguda. A nefropatia induzida por contraste (NIC) consiste na disfunção renal ocorrida nas 48 horas após a administração de RC, na ausência de outra causa.5,6 O uso de RC noutras patologias, nomeadamente cardiovasculares, está associado a desfechos adversos como progressão para insuficiência renal crónica, necessidade de terapêuticas dialíticas, e ocorrência de óbito.7 Estudos prévios reportam baixa incidência de NIC naqueles doentes submetidos a ACTC, incluindo estudo de perfusão, na fase de diagnóstico.8 Naqueles submetidos a angiografia de subtração digital diagnóstica o nível de casos de NIC é escasso.9 Contudo, o impacto da exposição a RC suplementar decorrente da TE não está definido. Assim, este estudo visa, em primeiro lugar, investigar a evolução da função renal naqueles doentes submetidos a TE e conhecer o impacto da doença renal preexistente; e, em segundo lugar, caracterizar os casos de NIC neste contexto.
Material e Métodos
Obtivemos a aprovação da Comissão de Ética da instituição. Elaborámos um estudo retrospetivo que incidiu sobre as admissões ocorridas na Unidade de Doenças Cerebrovasculares do Hospital Central do Funchal desde março de 2017 a fevereiro de 2020. Consultámos os processos clínicos das admissões nesta unidade por AVCI. Incluímos todos os doentes com idade superior ou igual a 18 anos, com o diagnóstico de OGVC identificada através de ACTC com critério para a realização de TE. Empregámos critérios de exclusão que nos invalidassem o uso da definição de NIC, nomeadamente: doentes em programa dialítico crónico, doentes transplantados renais e doentes provenientes do meio hospitalar admitidos primariamente por outra patologia. Obtivemos a informação demográfica, dados sobre as comorbilidades e características clínicas do AVCI. O RC utilizado consistiu em iopromida 769 mg/ml (iodo 370 mg/mL). O fármaco trombolítico endovenoso aplicado foi a alteplase conforme protocolo reconhecido.2 A TE aplicada dependeu da decisão do neurorradiologista de intervenção. Registámos os tempos de TE. A instituição implementa como profilaxia da NIC, independentemente do grau de disfunção renal, um suplemento de hidratação de 2.000 ml nas 24 horas após administração de RC. Apurámos os ajustes no volume efetuado, bem como, o recurso a fármacos considerados nefroprotetores (soluções contendo bicarbonato de sódio ou acetilcisteína) conforme o juízo do médico assistente. Registámos o valor de creatinina plasmática (CrP) à admissão, às 48 horas e ao 5º a 7º dia. Utilizámos a equação do estudo Modification of Diet in Renal Disease para estimar a taxa de filtração glomerular (TFGe) e aferir o estádio de doença renal basal.10 Calculámos as variações na CrP (ΔCrP). Considerámos a ocorrência de NIC quando a ΔCrP às 48 horas ≥ 0,3 mg/dL ou ≥ 50,0% do valor basal e não se verificou outra causa.6 Pesquisámos a necessidade de técnicas dialíticas nestes casos. Apurámos os desfechos clínicos relacionados com o AVCI, nomeadamente o insucesso na reperfusão (assumido como modified Treatment In Cerebral Infarction Score [mTICI] de 2a ou inferior), modified Rankin Scale (mRS) e variação do National Institute of Health Stroke Scale (ΔNIHSS), e ocorrência de óbito intra-hospitalar por qualquer causa.11-13 Efetuámos uma comparação entre aqueles doentes com TFGe < 60 mL/min/1,73 m2 à admissão com os restantes. Expressámos as variáveis categóricas em frequência absoluta e relativa (em percentagem). Calculámos a média ± desvio padrão para as variáveis contínuas. Na comparação dos grupos, as distribuições das variáveis contínuas foram avaliadas com o teste t de Student ou de Welch consoante a igualdade de variâncias. Para as variáveis categóricas, utilizou-se o teste do X2 de Pearson. A análise univariada e multivariada de fatores associados a ocorrência de NIC seria realizada através de regressão. Os dados foram obtidos com recurso da aplicação de processo clínico eletrónico SEIS-RAM. Posteriormente foram agregados e tratados estatisticamente com recurso ao IBM SPSS® versão 19.0. Adotámos o limiar de significado estatístico de valor p<0,05.
Resultados
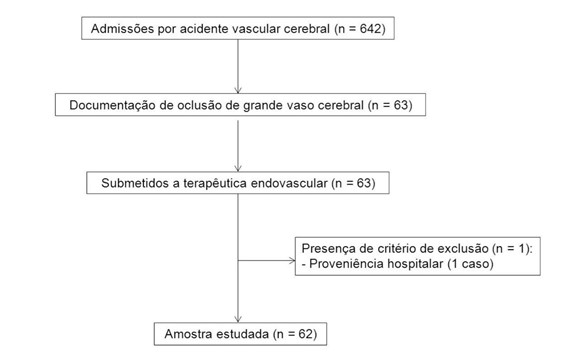
Com os critérios propostos, obtivemos uma amostra composta por 62 doentes com OGVC submetidos a TE (Fig. 1). Trinta e dois doentes (51,6%) pertenciam ao sexo masculino. A idade foi 69,6 ± 10,9 (média ± desvio-padrão) anos. O NIHSS à admissão foi 15,0 ± 5,9. Dezasseis doentes (25,8%) apresentavam TFGe < 60 mL/min/1,73 m2. A trombólise endovenosa foi realizada em 39 casos (62,9%). Os doentes foram expostos a 26,0 ± 0,4 g de iodo em contraste endovenoso e a 47,8 ± 1,7 g de iodo em contraste intra-arterial. Nenhum caso cumpriu critérios para NIC. A variação do NIHSS média foi de -2,4 ± 9,1. Um mRS ≤ 2 ocorreu em 16 casos (25,8%). Ocorreu óbito hospitalar por qualquer causa em 12 casos (19,4%). A Tabela 1 descreve as características da amostra. A Tabela 2 compara os doentes com TFGe < 60 mL/min/1,73 m2 à admissão com os restantes. Os doentes do grupo com TFGe < 60 mL/min/1,73 m2 eram mais velhos (75,8 ± 7,4 versus 67,4 ± 11,2 p=0,007) e apresentavam maior proporção de casos de hipertensão arterial (100,0% versus 71,7% p=0,017) e dislipidemia (75,0% versus 39,1% p=0,013). Não verificámos diferenças na evolução da disfunção renal (ΔCrP nas primeiras 48 horas: -0,17 ± 0,13 versus -0,11 ± 0,11 p=0,067), na evolução neurológica (mRS ≤ 2: 31,3% versus 23,9% p=0,563; ΔNIHSS: -0,94 ± 9,6 versus -2,9 ± 9,0 p=0,479) ou na mortalidade (18,8% versus 19,6% p=0,943). Dada a inexistência de casos de NIC, a exploração de fatores associados não foi realizada.
Discussão
Neste trabalho, estudámos uma amostra de doentes com OGVC submetidos a TE, expostos a RC na fase diagnóstica e terapêutica. Complementámos a avaliação da CrP admissão e às 48 horas com uma terceira determinação ao 5º-7º dia. Não se verificou diferenças nos desfechos em estudo, tanto na evolução da função renal quanto na evolução neurológica ou na ocorrência de óbito intra-hospitalar no grupo dos doentes com disfunção renal preexistente. Na nossa amostra, não foram identificados casos de NIC. No estudo de Sarma et al três casos (1,5%) entre os 194 submetidos a TE apresentaram NIC.14) Hu et al identificaram 16 casos (8,7%) de NIC entre 184 doentes submetidos a TE.15 Diprose et al reportaram a NIC em 11 casos (3,3%) entre 333 doentes.16 Yoo et al diagnosticaram 59 casos de NIC em 601 intervencionados (9,8%).17 As diferenças encontradas podem refletir diferenças no case-mix de cada estudo. Diprose et al reportaram a associação entre NIC a presença de diabetes mellitus e disfunção com TFGe < 30 mL/min/1,73 m2. A nossa amostra não continha doentes com esse grau de disfunção renal. Hu et al identifica o tempo de duração do procedimento endovascular como preditor de ocorrência de NIC. No nosso trabalho, o tempo médio de procedimento foi consideravelmente menor. No trabalho de Yoo et al somou-se a associação com a exposição a doses maiores de RC e o insucesso na reperfusão. Nos nossos casos, a dose de RC administrada foi em média menor e verificou-se menor taxa de insucesso da TE. Há que considerar o contributo do RC utilizado, dos procedimentos endovasculares implementados, das medidas de profilaxia de NIC ou no uso de fármacos nefrotóxicos na terapêutica à admissão. Não identificámos casos com TFGe < 30 mL/min/1,73 m2 pré-procedimento na nossa amostra. Noutros estudos, também eram pouco frequentes, nomeadamente Diprose et al (2,1%), Hu et al (0,5%) e Yoo et al (6,1%). A este grau de compromisso renal, poderão estar associadas comorbilidades, nomeadamente eventos cardiovasculares e cerebrovasculares prévios. O inerente compromisso funcional prévio poderá condicionar o acesso à TE (por exemplo, mRS < 3 como critério de elegibilidade para TE). Com esta limitação, o impacto do RC na função renal deste subgrupo é ainda incerto merecendo novos estudos nesta área. Contemplamos ainda como limitações ao nosso trabalho a natureza retrospetiva e unicêntrica do estudo e o recurso a uma amostra de conveniência de dimensão limitada.
Conclusão
Na nossa amostra de doentes com AVCI devido a OGVC submetidos a TE com TFGe > 30 mL/min/1,73 m2, a função renal não deteriorou significativamente, não se tendo verificado casos de NIC. Também não houve pior desfecho em termos nefrológicos ou neurológicos quando a função renal estimada prévia ao procedimento era normal em comparação com aqueles que apresentavam uma função renal moderadamente comprometida (TFGe > 30 e < 60 mL/min/1,73 m2).
Tabela 1: Descrição dos doentes da amostra.
| Parâmetro | Valor* |
|---|---|
| Sexo masculino | 32 (51,5%) |
| Idade (anos) | 69,6 ± 10,9 |
| Hipertensão arterial | 49 (79,0%) |
| Fibrilhação auricular | 21 (33,9%) |
| Diabetes mellitus | 15 (24,2%) |
| Dislipidemia | 30 (48,4%) |
| Tabagismo | 4 (6,5%) |
| Valvulopatia mitral | 6 (9,7%) |
| AVCI prévio | 7 (11,3%) |
| Cardiopatia isquémica | 9 (14,5%) |
| NIHSS à admissão | 15,0 ± 5,9 |
| Trombólise endovenosa | 39 (62,9%) |
| Tempo de procedimento endovascular (minutos) | 79,6 ± 58,0 |
| Contraste endovenoso (g de iodo) | 26,0 ± 0,4 |
| Contraste intra-arterial (g de iodo) | 47 ± 1,7 |
| Total de fluido endovenoso às 24h (ml) | 1398 ± 478 |
| Acetilcisteína | 11 (17,7%) |
| Bicarbonato | 1 (1,6%) |
| FASRAA | 12 (19,4%) |
| Antibióticos nefrotóxicos | 0 (0,0%) |
| Anti-inflamatórios não esteroides | 2 (3,2%) |
| TFGe | 75,2 ± 22,3 |
| DRC estadio I | 14 (22,6%) |
| DRC estadio II | 32 (51,6%) |
| DRC estadio III | 16 (25,8%) |
| DRC estadio IV | 0 (0,0%) |
| CrP à admissão (mg/dL) | 0,98 ± 0,23 |
| CrP às 48 horas (mg/dL) | 0,86 ± 0,21 |
| Δ CrP | -0,12 ± 0,12 |
| CrP ao 5º-7º dia (mg/dL) | 0,87% ± 0,22 |
| NIC | 0 (0,0%) |
| Recurso a hemodiálise | 0 (0,0%) |
| Insucesso na reperfusão | 13 (20,9%) |
| Δ NIHSS | -2,4 ± 9,1 |
| mRS ≤ 2 | 16 (25,8%) |
| Óbito intrahospitalar | 12 (19,4%) |
| Óbito por complicação neurológica | 9 (14,5%) |
*Variáveis categóricas expressas em frequência absoluta e relativa (em percentagem) e contínuas em média ± desvio-padrão; AVCI - acidente vascular cerebral isquémico; CrP - creatinina plasmática; DRC - doença renal crónica; FASRAA - fármacos atuantes no sistema renina-angiotensina-aldosterona; mRS - Modified Rankin Scale; NIC - Nefropatia induzida pelo constrate; NIHSS - National Institutes of Health Stroke Scale; TFGe - Taxa de filtração glomerular estimada.
Tabela 2: Comparação entre grupos.
| TFGe ≥ 60 mL/min/1,73 m2 | TFGe < 60 mL/min/1,73 m2 | ||
|---|---|---|---|
| Parâmetro | 46 casos (74,2%)* | 16 casos (25,8%)* | p † |
| Sexo masculino | 26 (56,5%) | 6 (37,5%) | 0,190 |
| Idade (anos) | 67,4 ± 11,2 | 75,8 ± 7,4 | 0,007 |
| Hipertensão arterial | 33 (71,7%) | 16 (100,0%) | 0,017 |
| Fibrilhação auricular | 15 (32,5%) | 6 (37,5%) | 0,722 |
| Diabetes mellitus | 9 (19,5%) | 6 (37,5%) | 0,149 |
| Dislipidemia | 18 (39,1%) | 12 (75,0%) | 0,013 |
| Tabagismo | 3 (6,5%) | 1 (6,3%) | 0,970 |
| Valvulopatia mitral | 5 (10,9%) | 1 (6,3%) | 0,590 |
| AVCI prévio | 6 (13,0%) | 1 (6,3%) | 0,460 |
| Cardiopatia isquémica | 7 (15,2%) | 2 (12,5%) | 0,790 |
| NIHSS à admissão | 15,7 ± 5,8 | 13,3 ± 6,0 | 0,160 |
| Trombólise endovenosa | 26 (56,6%) | 13 (81,3%) | 0,078 |
| Tempo de procedimento endovascular (minutos) | 81,3 ± 55,4 | 74,8 ± 66,5 | 0,725 |
| Contraste endovenoso (g de iodo) | 25,9 ± 0,4 | 26,1 ± 0,5 | 0,221 |
| Contraste intra-arterial (g de iodo) | 47,6 ± 1,2 | 48,2 ± 2,8 | 0,240 |
| Total de fluido endovenoso até às 24 horas (mL) | 1363 ± 452 | 1500 ± 574 | 0,328 |
| Acetilcisteína | 8 (17,4%) | 3 (18,8%) | 0,902 |
| Bicarbonato | 0 (0,0%) | 1 (6,3%) | 0,087 |
| FASRAA | 7 (15,2%) | 5 (31,3%) | 0,162 |
| Antibióticos nefrotóxicos | 0 (0,0%) | 0 (0,0%) | - |
| Anti-inflamatórios não esteroides | 2 (4,3%) | 0 (0,0%) | 0,397 |
| TFGe | 83,7 ± 19,1 | 50,7 ± 8,6 | 0,000 |
| CrP à admissão | 0,88 ± 0,16 | 1,26 ± 0,19 | 0,000 |
| CrP às 48 horas | 0,78 ± 0,16 | 1,09 ± 0,15 | 0,000 |
| Δ CrP | -0,11 ± 0,011 | -0,17 ± 0,13 | 0,067 |
| CrP ao 5º-7º dia | 0,82 ± 0,19 | 1,02 ± 0,24 | 0,003 |
| NIC | 0 (0,0%) | 0 (0,0%) | - |
| Recurso a hemodiálise | 0 (0,0%) | 0 (0,0%) | - |
| Δ NIHSS | -2,9 ± 9,0 | -0,9 ± 9,6 | 0,461 |
| mRS ≤ 2 | 9 (19,6%) | 3 (18,8%) | 0,563 |
| Óbito intrahospitalar | 9 (19,6%) | 3 (18,8%) | 0,943 |
| Óbito por complicação neurológica | 7 (15,2%) | 2 (12,5%) | 0,793 |
*Variáveis categóricas expressas em frequência absoluta e relativa (em percentagem) e contínuas em média ± desvio-padrão; †distribuições das variáveis contínuas foram avaliadas com o teste t de Student ou de Welch consoante a igualdade de variâncias, e as categóricas, com o teste do X2 de Pearson; AVCI - acidente vascular cerebral isquémico; CrP - creatinina plasmática; DRC - doença renal crónica; FASRAA - fármacos atuantes no sistema renina-angiotensina-aldosterona; mRS - Modified Rankin Scale; NIHSS - National Institutes of Health Stroke Scale; TFGe - Taxa de filtração glomerular estimada.