Introdução
As infeções da pele e dos tecidos moles (IPTM) são das infeções bacterianas mais comummente diagnosticadas1 e representam causas frequentes de referenciação ao serviço de urgência ou de admissão em internamento hospitalar. A incidência crescente tem sido predominantemente atribuída ao envelhecimento populacional, respetivas comorbilidades e aumento do número de doentes críticos.1,2
A literatura apresenta uma grande diversidade de recomendações na orientação das IPTM.3-6 Tal pode dever-se a alterações dinâmicas como o envelhecimento populacional, o aumento da proporção de doentes obesos, o surgimento de novos antibióticos, entre outras.7
As infeções da pele e dos tecidos moles são entidades clínicas com apresentação, etiologia e severidade muito variáveis.8 O diagnóstico destas entidades é predominantemente clínico. O diagnóstico microbiológico das IPTM é obtido em < 50% dos doentes hospitalizados.7) Segundo a literatura, as hemoculturas (HC) positivam em < 5% das infeções não necrotizantes.9 As HC devem ser valorizadas se ocorrer isolamento de Staphylococcus aureus ou bactérias Gram negativo, e a valorização de Staphylococcus coagulase negativos implica a positividade de duas HC colhidas em dois locais distintos.10 Exames culturais de aspirados ou biópsia tecidular são geralmente desnecessários.1,11
O tratamento das infeções da pele e dos tecidos moles é empírico. As infeções da comunidade estão frequentemente associadas a organismos Gram positivo. Os doentes com infeções nosocomiais ou pós-cirúrgicas apresentam maior propensão para organismos Gram negativo.8 O tratamento da infeção é determinado pelo tipo de infeção, localização, severidade, purulência, caráter necrotizante, tempo de instalação e comorbilidades do doente.2,11 Contrariamente a outros países como os Estado Unidos da América, em que as estirpes de MRSA (methicillin-resistant Staphylococcus aureus) emergiram na comunidade (CA-MRSA - community-associated MRSA) e se encontram em expansão, a maioria das estirpes de MRSA em Portugal são adquiridas a nível hospitalar.12,13 Assim, de momento, CA-MRSA não apresenta expressividade em Portugal, não sendo uma preocupação em termos de abordagem terapêutica nas IPTM da comunidade.
Em 1966 foi usado pela primeira vez o termo “Antimicrobial Stewardship” (AMS) por John E. MacGowan Jr e Dale N. Gerding com o objetivo de incidir no uso racional de antimicrobianos. Em Portugal, a equivalência à AMS é o PAPA, o Programa de Apoio à Prescrição Antibiótica criado e implementado em novembro de 2013 pela Direção Geral de Saúde (DGS).14 O PAPA inclui um conjunto de intervenções para promover o uso ótimo do antibiótico, e está demonstrada a sua relevância no melhor prognóstico do doente, menos efeitos adversos e redução da resistência aos antimicrobianos.15-17 Com a incidência crescente de IPTM, o uso apropriado e adequado do antibiótico é de extrema importância no prognóstico do doente e na redução dos dias de internamento, na recorrência aos cuidados de saúde e consequentemente nos custos associados18; esta é uma área onde o PAPA pode intervir, tanto a nível hospitalar como em ambulatório.
Material e métodos
O objetivo do trabalho foi determinar qual a prática clínica, abordagem terapêutica, fatores de risco e mortalidade dos doentes internados com infeções da pele e dos tecidos moles no Hospital de Braga. Desenvolveu-se um estudo observacional retrospetivo com inclusão de todos os doentes internados, independentemente da especialidade, entre janeiro de 2017 e dezembro de 2018 com diagnóstico primário ou secundário de infeção da pele e dos tecidos moles (codificação ICD-10: L00-L08, A46 e M726). Foram excluídos todos os doentes com idade inferior a 18 anos, feridas do pé diabético, feridas neoplásicas, úlceras de pressão e úlceras vasculares infetadas.
Foi realizada colheita de informação relativa à admissão hospitalar, antibioterapia empírica instituída e sua duração, timing de controlo de foco, requisição de exames microbiológicos e isolamentos verificados. Relativamente aos fatores de risco para infeções cutâneas, foram incluídos antecedentes de patologia cardiovascular, hepatopatia, doença renal crónica, diabetes mellitus, imunossupressão, etilismo, obesidade, doença arterial e venosa periféricas e história de traumatismo prévio. O estudo foi aprovado pela Comissão de Proteção de Dados e Comissão de Ética.
A análise estatística foi realizada com recurso ao SPSS Statistics ® (24ª versão). Todos os valores-P são two-tailed, com valor-P de 0,05 indicando significância estatística.
Resultados
Diagnósticos
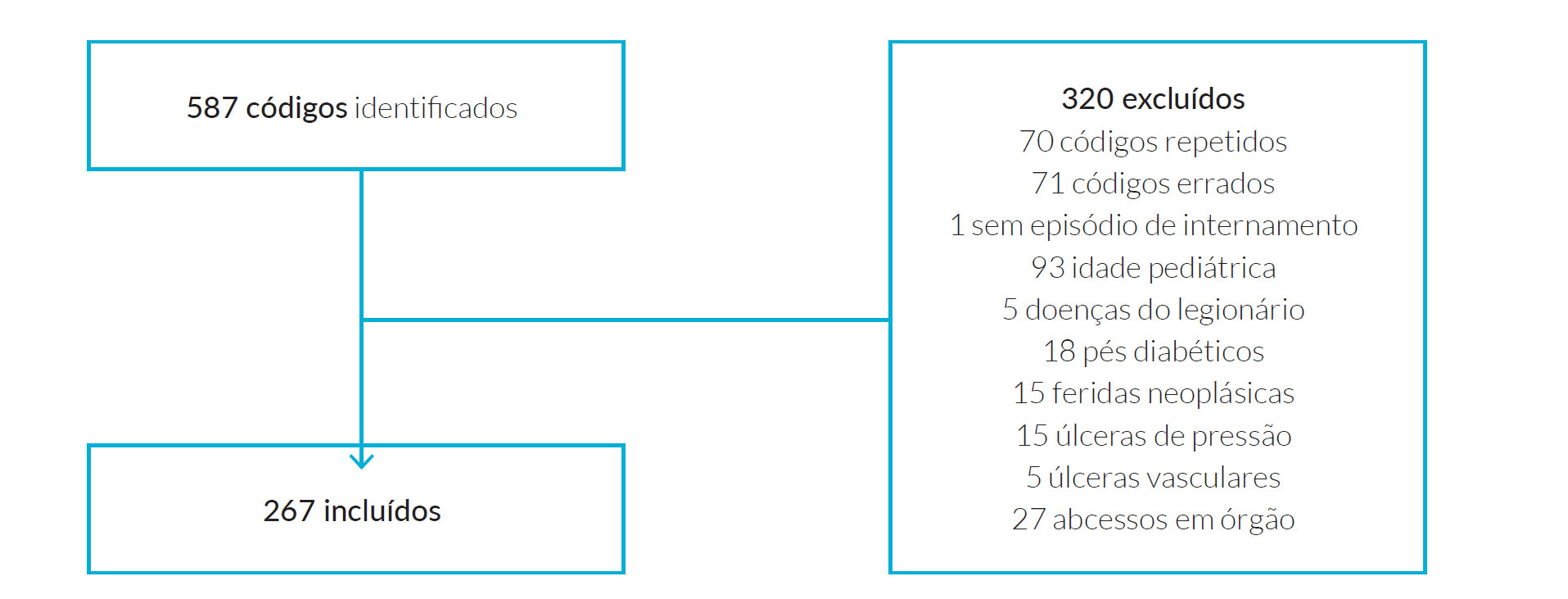
No período de 2 anos abrangido, foram codificadas 587 IPTM. Destas, 267 preenchiam os critérios de inclusão no estudo. Foram excluídos 320 códigos pelos seguintes motivos: código repetido (n=70), código errado (n=71), sem episódio de internamento (n=1), idade pediátrica (n=93), doença do legionário (n=5), pé diabético (n=18), ferida neoplásica (n=15), úlcera de pressão (n=15), úlcera vascular (n=5), abcesso em órgão (n=27) (Fig. 1).
Dos 267 diagnósticos de IPTM considerados, a maioria (n=247) diz respeito a infeções não necrotizantes (46 erisipelas, 137 celulites, 64 abcessos). Identificaram-se 11 infeções necrotizantes (5 fasceítes necrotizantes, 3 gangrenas de Fournier, 3 infeções necrotizantes não especificadas) e 9 infeções da ferida cirúrgica superficial (Tabela 1).
Tabela 1: Tipos de infeção.
| Tipo de infeção | n = 267 |
|---|---|
| Erisipela, n (%) | 46 (17,2) |
| Celulite, n (%) | 137 (51,3) |
| Abcesso, n (%) | 64 (24,0) |
| Fasceíte necrotizante, n (%) | 5 (1,9) |
| Gangrena de Fournier, n (%) | 3 (1,1) |
| Outras infeções necrotizantes, n (%) | 3 (1,1) |
| Infeção da ferida cirúrgica superficial, n (%) | 9 (3,4) |
Caracterização demográfica da população
Foram incluídos 258 pacientes. A idade média da população foi de 66,5 anos, com 57% dos doentes com ≥ 65 anos. Verificou-se uma distribuição equilibrada de sexo, com ligeiro predomínio do sexo feminino (50,4%). As comorbilidades dos doentes estão apresentadas na Tabela 2. Verificou-se que a comorbilidade mais frequente foi a doença cardiovascular (36,8%), seguindo-se a diabetes mellitus (27,1%), o excesso de peso (19,8%), a doença renal crónica (18,6%) e a doença vascular periférica (17,4%).
Tabela 2: Características demográficas e comorbilidades da população.
| Características | n = 258 |
|---|---|
| Sexo feminino, n (%) | 130 (50,4) |
| Idade média (anos), média (±DP) | 66,5 (17,7) |
| ≥ 65 anos, n (%) | 147 (57,0) |
| Excesso de peso, n (%) | 51 (19,8) |
| Diabetes mellitus, n (%) | 70 (27,1) |
| Doença cardiovascular, n (%) | 95 (36,8) |
| Doença hepática, n (%) | 25 (9,7) |
| Doença renal crónica, n (%) | 48 (18,6) |
| Doença vascular periférica, n (%) | 45 (17,4) |
| Alcoolismo, n (%) | 28 (10,9) |
| Imunossupressão, n (%) | 20 (7,8) |
| Traumatismo prévio, n (%) | 39 (15,1) |
DP - desvio padrão
Correlação infeção e comorbilidades
A correlação entre os fatores de risco e os tipos de infeções cutâneas apenas demonstrou significância estatística entre: erisipela e diabetes mellitus, erisipela e doença cardiovascular, erisipela e trauma, celulite e doença renal crónica (estádio superior a 3), celulite e doença vascular periférica, infeções abcedadas e doença cardiovascular, infeções abcedadas e doença vascular periférica e infeções necrotizantes e etilismo (Tabela 3).
Tabela 3: Correlação infeção e comorbilidades.
| Fatores de risco | Patologia cardiovascular | Hepatopatia | DRC | DM | Imunossupressão | Etilismo | Obesidade/ Excesso de peso | Doença vascular periférica | Trauma | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tipo de infeção | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P | n | Valor-P |
| Erisipela | 29 | <0,001 | 4 | 0,713 | 38 | 0,736 | 20 | 0,014 | 4 | 0,739 | 3 | 0,230 | 12 | 0,299 | 8 | 0,957 | 2 | 0,030 |
| Celulite | 51 | 0,416 | 15 | 0,529 | 33 | 0,017 | 33 | 0,544 | 11 | 0,617 | 18 | 0,235 | 29 | 0,531 | 35 | < 0,001 | 22 | 0,359 |
| Abcesso | 10 | 0,002 | 4 | 0,326 | 7 | 0,093 | 12 | 0,379 | 6 | 0,408 | 4 | 0,233 | 6 | 0,102 | 3 | 0,003 | 10 | 0,618 |
| Infeções necrotizantes | 1 | 0,202 | 2 | 0,298 | 1 | 0,465 | 3 | 0,949 | 0 | 0,357 | 3 | 0,040 | 4 | 0,241 | 0 | 0,134 | 1 | 0,688 |
| Ferida cirúrgica | 3 | 0,308 | 2 | 0,753 | 2 | 0,484 | 2 | 0,413 | 0 | 0,239 | 2 | 0,915 | 1 | 0,179 | 1 | 0,217 | 4 | 0,228 |
DRC - doença renal crónica; DM - diabetes mellitus
Isolamentos microbiológicos
Neste período foram colhidas 177 amostras: zaragatoa (n=14); pus (n=67); HC (n=95) e biópsia cutânea (n=1). Verificou-se isolamento de 1 ou mais agentes em 96 culturas: 42 em abcessos; 29 em celulites; 8 em erisipelas; 10 em infeções necrotizantes e 7 em feridas cirúrgicas. A sensibilidade das colheitas variou em função do diagnóstico subjacente (Tabela 4). De um modo geral as zaragatoas cutâneas positivaram em 79%; os aspirados purulentos positivaram em 90%, as HC positivaram em 24% e biópsias tecidulares em 100% (n=1). As HC apresentaram a maior rentabilidade diagnóstica nas infeções necrotizantes (66% positividade).
Tabela 4: Rentabilidade das colheitas microbiológicas.
| Colheitas MB | Zaragatoa | Aspirados purulentos | Hemoculturas | Biópsia tecidular | ||||
|---|---|---|---|---|---|---|---|---|
| Tipo de infeção | n | Positividade (n; %) | n | Positividade (n; %) | n | Positividade (n; %) | n | Positividade (n; %) |
| Erisipela | 3 | 3; 100% | 2 | 2; 100% | 19 | 3; 16% | 0 | 0; 0% |
| Celulite | 10 | 7; 70% | 7 | 4; 57% | 62 | 15; 24% | 0 | 0; 0% |
| Abcesso | 0 | 0; 0% | 41 | 38; 93% | 19 | 3; 16% | 1 | 1; 100% |
| Infeções necrotizantes | 0 | 0; 0% | 10 | 9; 90% | 3 | 2; 66% | 0 | 0; 0% |
| Ferida cirúrgica | 1 | 1; 100% | 7 | 7; 100% | 2 | 1; 50% | 0 | 0; 0% |
| Todos | 14 | 11; 79% | 67 | 60; 90% | 95 | 23; 24% | 1 | 1; 100% |
MB - microbiológicas. NOTA: Rentabilidade e sensibilidade do teste são conceitos distintos
Foi isolado agente microbiológico na maioria das infeções necrotizantes (100% das fasceítes necrotizantes, 100% das gangrenas de Fournier e 66,7% das outras infeções necrotizantes), assim como em 77,8% das feridas cirúrgicas superficiais. No que diz respeito às infeções superficiais, foi isolado agente em 65,6% dos abcessos, 21,1% das celulites e 17,4% das erisipelas. Os agentes mais frequentes em todos os tipos de infeção foram as bactérias Gram positivo, conforme se pode verificar na Tabela 5. Staphylococcus aureus representaram uma parte importante desses isolados, tendo sido isolados tantos Staphylococcus aureus resistentes à meticilina (MRSA) como sensíveis à meticilina (MSSA) nas fasceítes necrotizantes (20% cada) e nas feridas cirúrgicas (12,5% cada). Verificou-se que em 70% das infeções necrotizantes as amostras revelaram mais que um agente.
Tabela 5: Isolamentos microbiológicos.
| Tipo de infeção | Infeções com isolamentos microbiológicos (%) | Microrganismos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Total (n) | Gram positivos | Gram negativos | Anaeróbios (%) | ||||||||
| (% total) | MSSA (%) | MRSA (%) | (% total) | K. pneumoniae(%) | P. Aeruginosa (%) | P. mirabilis (%) | E. coli (%) | ||||
| Erisipela | 17,4 | 13 | 76,9 | 20,0 | 10 | 23,1 | 0 | 33,3 | 0 | 66,7 | 0 |
| Celulite | 21,2 | 37 | 74,3 | 23,1 | 3,8 | 20 | 14,3 | 42,9 | 14,3 | 28,6 | 5,7 |
| Abcesso | 65,6 | 59 | 55,9 | 36,4 | 6,1 | 23,7 | 28,6 | 7,1 | 21,4 | 35,7 | 20,3 |
| Fasceíte necrotizante | 100 | 7 | 71,4 | 20,0 | 20,0 | 28,6 | 50 | 0 | 0 | 50 | 0 |
| Gangrena de Fournier | 100 | 7 | 71,4 | 0 | 0 | 28,6 | 0 | 0 | 50 | 50 | 0 |
| Outras infeções necrotizantes | 66,7 | 5 | 60 | 33,3 | 0 | 40 | 0 | 0 | 0 | 50 | 0 |
| Ferida cirúrgica | 77,8 | 12 | 66,7 | 12,5 | 12,5 | 16,7 | 50 | 0 | 0 | 50 | 16,7 |
MSSA - methicillin-susceptible Staphylococcus aureus; MRSA - methicillin-resistant Staphylococcus aureus; K. pneumoniae - Klebsiella pneumoniae; P. aeruginosa - Pseudomonas aeruginosa; P. mirabilis - Proteus mirabilis; E. coli - Escherichia coli
Tratamento
Os antibióticos mais utilizados nas infeções superficiais (erisipela, celulite e abcesso) foram as penicilinas (71,7%, 64,2% e 68,8% respetivamente), com recurso preferencial a flucloxacilina, penicilina G e amoxicilina (Tabela 6). Relativamente à antibioterapia de largo espectro, 31,7% dos diagnósticos de erisipela e celulite (n=58) foram medicados com piperacilina/ tazobactam, meropenem ou vancomicina. Destes, 37 (63,8%) apresentavam exposição antibiótica prévia nos últimos 3 meses; 13 (22,4%) apresentavam isolamento de MRSA, CRE (Enterobacteriaceae resistentes aos carbapenemos) ou PAMR (Pseudomonas aeruginosa multirresistente) em zaragatoa de rastreio e 5 (8,6%) estavam institucionalizados; os restantes não apresentavam justificação clínica para a prescrição desses antibióticos.
Tabela 6: Antibioterapia instituída.
| Tipo de infeção | Antibioterapia (% infeções) | Alt eração (%) | Duração média (dias) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Penicilinas | Cefalosporinas | Clindamicina | Carbapenemos | Fluoroquinolonas | Macrólidos | Aminoglicosídeos | Vancomicina | Linezolido | Metr onid azol | Rifampicina | |||
| Erisipela | 71,7 | 32,6 | 10,9 | 13,0 | 2,2 | 0 | 0 | 19,6 | 2,2 | 0 | 0 | 26 | 9 |
| Celulite | 64,2 | 35,1 | 21,9 | 16,8 | 9,5 | 1,5 | 2,2 | 14,6 | 2,9 | 4,4 | 0 | 25 | 9 |
| Abcesso | 68,8 | 18,8 | 25 | 12,5 | 12,5 | 0 | 6,3 | 6,3 | 4,7 | 17,2 | 0 | 27 | 9 |
| Fasceíte necrotizante | 60 | 0 | 40 | 20 | 0 | 0 | 0 | 40 | 20 | 60 | 0 | 40 | 19 |
| Gangrena de Fournier | 33,3 | 33,3 | 66,7 | 33,3 | 33,3 | 0 | 0 | 0 | 0 | 33,3 | 0 | 33 | 10 |
| Outras infeções necrotizantes | 66,7 | 33,3 | 0 | 33,3 | 0 | 0 | 33,3 | 66,7 | 0 | 100 | 0 | 67 | 17 |
| Ferida cirúrgica | 44,4 | 11,1 | 0 | 11,1 | 0 | 0 | 0 | 55,6 | 22,2 | 33,3 | 11 | 11 | 13 |
MSSA - methicillin-susceptible Staphylococcus aureus;MRSA - methicillin-resistant Staphylococcus aureus; K. pneumoniae - Klebsiella pneumoniae; P. aeruginosa - Pseudomonas aeruginosa; P. mirabilis - Proteus mirabilis; E. coli - Escherichia coli
Na fasceíte necrotizante (que não a gangrena de Fournier) e nas outras infeções necrotizantes prevaleceu a classe das penicilinas (60% e 66,7% respetivamente; na maioria dos casos de espectro alargado - piperacilina/ tazobactam), e a associação com o metronidazol (60% e 100%). Também a vancomicina teve um papel importante nas infeções necrotizantes (66,7%). Na gangrena de Fournier, foi preferida a associação com clindamicina (66,7%). De notar que nas infeções necrotizantes foram utilizadas sempre associações antibióticas. Na ferida cirúrgica destaca-se a vancomicina (55,6%), o principal agente com cobertura para MRSA, seguindo-se a linezolida.
O tempo médio de antibioterapia oscilou entre 9-19 dias, com maior duração nas infeções profundas, sobretudo na fasceíte necrotizante. Verificou-se uma maior percentagem de alteração da terapêutica antibiótica nas infeções necrotizantes (66,7%). O tempo médio para controlo de foco foi de 40,8 horas
Prognóstico
A taxa de mortalidade global foi de 9,7% (n=25). Os abcessos registaram a menor taxa de mortalidade por infeção (4,7%), seguindo-se as celulites (8,8%), as feridas cirúrgicas superficiais (11,1%) e as erisipelas (13,0%). A maior taxa de mortalidade verificou-se nas infeções necrotizantes (27,3%).
Discussão e conclusão
A população deste estudo apresentou uma idade média ligeiramente superior à descrita noutros estudos (57% com ≥ 65 anos)19-22 e as infeções mais frequentes foram celulites e abcessos, conforme descrito em series prévias.19 Tendo em conta a grande diversidade de IPTM, e a ausência de uma nomenclatura de classificação globalmente aceite, optou-se por enaltecer a categorização em necrotizante ou não necrotizante, uma vez que apresenta grande impacto na abordagem e prognóstico, assim como a condição clínica do doente, conforme recomendado por orientações internacionais.4
A idade avançada, doença cardiovascular, doença hepática, doença renal, diabetes mellitus, imunossupressão, obesidade, doença arterial periférica ou drenagem linfática comprometida e trauma são fatores de risco estabelecidos para as infeções da pele e dos tecidos moles.23 Neste estudo retrospetivo verificou-se associação entre alguns destes fatores de risco e determinados tipos de infeção cutânea; os resultados obtidos foram provavelmente condicionados pela amostra reduzida de doentes e eventuais vieses na codificação dos fatores de risco inerentes.
Contrariamente ao descrito na literatura, o isolamento de agente (não necessariamente etiológico) ocorreu em > 50% das amostras (n=96; 54%). Em 30% das amostras positivas (n=29) verificou-se uma flora polimicrobiana; 15 destas ocorreram em abcessos, feridas cirúrgicas e infeções necrotizantes, assumindo-se provável contaminação nas restantes. As zaragatoas devem ser evitadas, dada a dificuldade em interpretar os isolamentos microbiológicos devido ao isolamento de agentes colonizadores da pele.24
As infeções necrotizantes profundas, sendo as que apresentam mais risco de vida, implicam geralmente intervenção cirúrgica com drenagem e desbridamento.4 Por este motivo, há maior facilidade de colheita de produtos microbiológicos no local da infeção, o que justifica o facto de se ter identificado agente na grande maioria destas infeções. Neste grupo, verificou-se uma grande percentagem de infeções polimicrobianas, conforme descrito na literatura.25
Já nas infeções mais superficiais, como a celulite e a erisipela, geralmente não há produtos para cultura, pelo que o agente fica por determinar na maioria dos casos. Nos casos em que se identifica o agente, prevalecem os agentes Gram positivo, os principais constituintes da flora comensal da pele, conforme descrito noutras séries.26,27
O diagnóstico de IPTM é clínico. As orientações internacionais sugerem vários esquemas antibióticos empíricos para tratamento, dependendo do tipo, local e severidade da infeção, o que se refletiu na diversidade de esquemas utilizado4:
Nas infeções superficiais, como erisipela, celulite ou abcesso, conforme expectável, os antibióticos preferenciais foram as penicilinas. Contudo, verificou-se o uso de antibioterapia de largo espectro inadequada (como carbapenemos, por exemplo) numa percentagem considerável dos casos;
Nas infeções profundas necrotizantes, as penicilinas mantiveram o seu papel, sobretudo a piperacilina/ tazobactam, verificando-se também o recurso a cefalosporinas, carbapenemos, fluoroquinolonas, aminoglicosídeos e associação com metronidazol. A associação com clindamicina pelo seu efeito antitoxina foi também notável. O recurso a estes agentes está de acordo com as recomendações internacionais.(4,28 De notar que a percentagem de utilização de cada um destes agentes tem um valor relativo, tendo em conta o número reduzido de cada uma destas infeções;
Na infeção da ferida cirúrgica superficial, o essencial é a intervenção cirúrgica atempada, com recurso a antibioterapia apenas nos casos em que se verifica atingimento sistémico ou de órgão alvo, ou em imunodeprimidos. (4) Sendo uma infeção hospitalar, com maior risco de MRSA, compreende-se a sobrerrepresentação da vancomicina e da linezolida. Contudo, a cobertura empírica para MRSA poderia ter sido minimizada e mais adequada com o rastreio nasal de MRSA prévio, o que não se verificou em todos os casos e não foi alvo de avaliação no presente estudo.
A maior percentagem de alteração antibiótica e a maior duração do tratamento nas infeções necrotizantes pode ser explicada pelo facto de serem infeções graves, com maior risco de vida, e geralmente polimicrobianas, com maior necessidade de ajuste terapêutico para garantir o controlo adequado da infeção. A corroborar isto está a maior mortalidade verificada nestas infeções, que foi superior à descrita em séries prévias.29 O tempo médio para controlo de foco superou as recomendações que sugerem uma intervenção cirúrgica o mais precoce possível, idealmente nas primeiras 12 horas.4
A escolha do antibiótico adequado é baseada em múltiplos fatores que conjugam o doente, o(s) agente(s) bacteriano(s) e os antibióticos, requerendo uma colaboração multidisciplinar. O antibiótico apropriado é escolhido com base no local de infeção, na etiologia mais provável e no histórico do doente relativamente a agentes multirresistentes. A dose deve ser adequada às características farmacocinéticas e farmacodinâmicas do antibiótico. Nas infeções de pele e tecidos moles os programas de otimização do uso de antibiótico demonstraram melhoria no prognóstico do doente, internamentos mais curtos e menos efeitos adversos.30 Uma equipa multidisciplinar é essencial para melhorar a qualidade dos cuidados de saúde prestados ao doente. Este trabalho evidenciou alguns pontos de atuação futura de forma a melhorar a escolha do antibiótico empírico, o tempo para controlo de foco e a taxa de mortalidade. Assim, é importante amplificar a atuação do PAPA neste grupo de doentes.