Introdução
A dermatite atópica é uma das doenças inflamatórias crónicas dermatológicas mais comuns e pode ter um grande impacto na qualidade de vida dos doentes afetados e seus familiares. Estudos de prevalência global sugerem que a dermatite atópica é prevalente em todo o mundo, em países de baixo, médio e alto rendimento, e pesquisas recentes mostram que a prevalência da dermatite atópica está a aumentar.1
A dermatite atópica surge precocemente na infância na maioria dos casos. Cerca de 65% das crianças com dermatite atópica são afetadas aos 18 meses de idade, sendo que alguns destes casos ficam resolvidos na primeira infância e, na idade adulta, este número sobe para 60%.2 Embora a prevalência seja mais baixa em adultos, é nestes que a dermatite atópica geralmente se apresenta de forma mais grave e crónica.3
A dermatite atópica carateriza-se por uma pele seca e descamativa, associada a prurido, e tende a exacerbar de forma intermitente devido a vários fatores internos e externos.4 O sintoma mais premente é o prurido, podendo conduzir a lesões cutâneas com risco de infeção secundária. O impacto na qualidade de vida pode ser considerável, especialmente nos casos graves, podendo levar a abstinência escolar ou laboral, bem como a perturbação do sono e perturbações emocionais, não só da pessoa afetada, mas também da sua família.5,6 A dermatite atópica afeta, portanto, as atividades diárias e a qualidade de vida do doente e dos que o rodeiam. É uma patologia que consome uma parte significativa do tempo e do financiamento, tanto nos cuidados de saúde primários como nos secundários.7
É uma doença multifatorial, com fatores genéticos e ambientais, contribuindo para diferentes extensões da doença em diferentes indivíduos e populações.8 É uma doença crónica e, portanto, para uma gestão eficaz da mesma é necessário reconhecer e reduzir os fatores desencadeantes (como certos alergénios ou substâncias irritantes) e insistir na aplicação frequentemente de emolientes.9 Durante uma exacerbação da dermatite atópica, a base do tratamento consiste na aplicação diária de corticoides tópicos de força variada, dependendo da gravidade da exacerbação e do local afetado,4,10 sendo estes geralmente prescritos por curtos períodos de tempo. Existem outros tratamentos tópicos para além dos corticoides, tais como os inibidores tópicos da calcineurina, mas nenhum foi considerado superior ao corticoide.11 Se esta terapêutica se revelar ineficaz, pode ser necessário escalar para uma terapêutica sistémica que inclui não só corticoides e anti-histamínicos, mas também imunossupressores, fármacos biológicos e ainda a fototerapia.4
A dermatite atópica geralmente ocorre em indivíduos com história familiar de atopia, incluindo asma e rinite alérgica. Estas doenças partilham uma patogénese comum e surgem frequentemente associadas no mesmo indivíduo, sendo que cerca de 30% das pessoas com dermatite atópica desenvolvem asma e 35% desenvolvem rinite alérgica.12
Os leucotrienos são uma classe de mediadores inflamatórios derivados do ácido araquidónico através da via da 5-lipoxigenase13 e os basófilos, mastócitos e eosinófilos têm um papel preponderante na sua produção. O uso de antagonistas dos recetores de leucotrienos (LTRAs) como fármacos anti-inflamatórios no tratamento bem-sucedido da asma foi amplamente confirmado na literatura,14,15 estando o montelucaste aprovado como terapêutica preventiva a longo prazo para crianças com asma.16 Ao longo dos anos tem surgido alguma evidência quanto ao envolvimento dos leucotrienos na fisiopatologia da dermatite atópica, havendo a possibilidade de os LTRAs desempenharem um papel no seu tratamento, nomeadamente como steroid-sparing agents.17-19 Estudos mostraram que doentes com dermatite atópica grave apresentam mais basófilos circulantes ativados, com uma maior capacidade de libertação de leucotrienos,20 e concentrações urinárias de leucotrienos superiores,17 em comparação com indivíduos saudáveis, sugerindo uma associação dos leucotrienos com a patogénese da dermatite atópica.
O montelucaste é um LTRA, administrado por via oral e aprovado em Portugal para o tratamento da asma. Devido à associação comum de dermatite atópica com asma e rinite alérgica, foi relatada uma melhoria dos sintomas da dermatite atópica em indivíduos a receber montelucaste para controlo das manifestações respiratórias.21 Neste contexto, têm sido relatados vários casos do uso de montelucaste no tratamento da dermatite atópica.22-25
A dermatite atópica é uma patologia que faz parte do dia-a-dia do médico de família, que se depara frequentemente com opções terapêuticas limitadas. Muitas pessoas com dermatite atópica consideram que os tratamentos tópicos atualmente disponíveis são de aplicação morosa e inconveniente, muitas vezes sem melhoria evidente, e os agentes orais disponíveis estão restritos para uso durante um curto período de tempo ou têm importantes preocupações de segurança. Assim, o objetivo deste estudo é realizar uma revisão baseada na evidência acerca da eficácia do uso off-label do montelucaste na melhoria sintomática da dermatite atópica.
Metodologia
Foi realizada uma pesquisa de meta-análises (MA), revisões sistemáticas (RS), ensaios clínicos aleatorizados e controlados (ECAC), normas de orientação clínica (NOC) e guidelines baseadas na evidência, publicados até 30 de junho de 2022, nas línguas portuguesa e inglesa, indexados nas bases de dados da National Guideline Clearinghouse, National Institute for Health and Care Excellence (NICE) Guidelines Finder, Canadian Medical Association Practice Guidelines Infobase, The Cochrane Library, Database of Abstracts of Reviews of Effectiveness (DARE), Bandolier, Evidence Based Medicine Online e MEDLINE, utilizando os termos “atopic dermatitis” e “montelukast”. Os critérios utilizados para a inclusão dos artigos consistiram em: população-alvo constituída por adultos e crianças com diagnóstico de dermatite atópica, em que a intervenção fosse a utilização de montelucaste, comparado com placebo ou tratamento convencional (definido como aplicação de emolientes, corticoterapia tópica e/ou uso de anti-histamínico) e com outcome relacionado com a melhoria sintomática. Foram excluídos ensaios clínicos incluídos em RS ou MA selecionadas, artigos duplicados, artigos de revisão clássica de tema, artigos discordantes do objetivo da revisão, artigos de opinião e artigos em que o tratamento incluía terapêutica com corticoterapia sistémica.
Utilizou-se a escala Strength of Recommendation Taxonomy (SORT), da American Academy of Family Physicians, para avaliação dos níveis de evidência (NE) e atribuição de forças de recomendação (FR).26
A seleção dos artigos para revisão foi realizada pelas autoras com uma taxa de concordância final de 100%. A leitura integral foi executada e a avaliação da qualidade e NE dos artigos incluídos discutida por todas as autoras.
Resultados
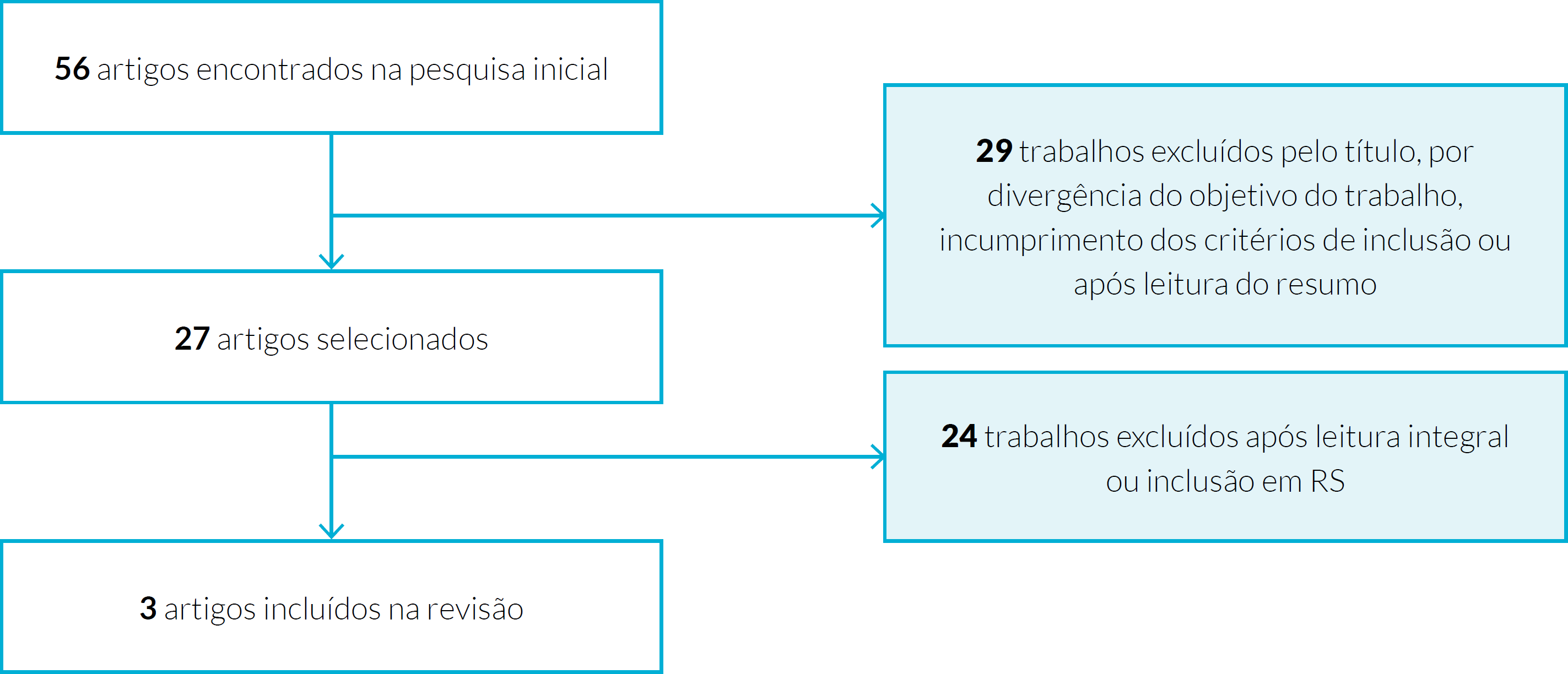
Do total de 56 artigos encontrados nas diferentes bases de dados incluídas. Após a leitura do título, resumo ou artigo integral foram excluídos 53 artigos. Um diagrama de fluxo seguindo as diretrizes PRISMA27 ilustra todos os procedimentos realizados para obtenção da literatura, bem como o número resultante de artigos selecionados (Fig. 1). Foram incluídos no estudo três artigos: duas revisões sistemáticas (Tabela 1) e um ECAC (Tabela 2). Relativamente às revisões sistemáticas foram apenas analisados os estudos que cumpriram os critérios de inclusão da presente revisão.
A revisão sistemática realizada por Chin WK e Lee SWH,28 que tinha como objetivo avaliar o possível papel do montelucaste na dermatite atópica, tanto a nível de eficácia como de segurança, incluiu onze RCTs realizados em nove países diferentes, dos quais três cumpriam os critérios de inclusão definidos pelas investigadoras (Tabela 1). Jeon29 desenhou um estudo duplamente cego, com desenho cruzado, onde os intervenientes foram randomizados e alocados no grupo placebo ou no grupo de intervenção. Foram avaliados o índice SCORAD (SCORing of Atopic Dermatitis) e os níveis urinários de LTE4 (leucotrieno E4) e EDN (eosinophil-derived neurotoxin) às 0, 2, 6, 10, 12, 16 e 20 semanas. Não foram encontradas diferenças estatisticamente significativas a nível do índice SCORAD. Os níveis urinários de LTE4 reduziram no grupo tratado com montelucaste, mas esta redução não foi estatisticamente significativa. Já no nível urinário de EDN, o montelucaste não provocou qualquer efeito. No ECAC de Pei,30 um estudo com desenho cruzado, os participantes foram aleatoriamente distribuídos pelos dois grupos (intervenção e placebo). Os investigadores avaliaram a gravidade da doença através dos seis sinais de dermatite atópica (eritema, edema, exsudação, escoriação, liquenificação e xerose), através da aplicação de um score de avaliação da extensão da doença (em termos de superfície corporal) e pela utilização do CDLQI (Children's Dermatology Life Quality Index), um questionário subjetivo de avaliação do impacto da dermatite atópica na vida diária, e demonstraram uma redução estatisticamente significativa na gravidade da doença com a utilização do montelucaste, mas sem efeitos significativos na sua extensão ou no impacto da doença na qualidade de vida dos intervenientes. No estudo de Yanase,31 um ECAC duplamente cego e de desenho cruzado, foi utilizada a escala ADASI (Atopic Dermatitis Area and Severity Index) para avaliar a gravidade da doença, que inclui avaliação do eritema, induração, escoriação, liquenificação, descamação/xerose e erosão. Houve uma diferença estatisticamente significativa no score, com melhoria na descamação/xerose (p=0,003), liquenificação (p=0,009), induração (p=0,016), eritema (p=0,024) e erosões (p=0,027) no grupo de intervenção. Nos três ECAC foi permitida a utilização de emolientes, anti-histamínico e corticoide tópico, independentemente de os intervenientes estarem alocados ao grupo de intervenção ou ao grupo controlo. A esta revisão sistemática foi atribuído um Nível de Evidência 2.
A revisão sistemática realizada por Ferguson L, et al32 incluiu cinco ECAC, dos quais quatro cumpriam os critérios de inclusão definidos previamente (Tabela 1). No ECAC de Friedmann,33 um estudo duplamente cego, os participantes foram aleatorizados em dois grupos: grupo placebo ou grupo de intervenção. Os investigadores avaliaram a resposta ao tratamento através de uma escala subjetiva de 7 pontos (aplicada quer aos investigadores quer aos intervenientes). Adicionalmente foram utilizadas a escala SASSAD (Six-Area, Six-Sign Atopic Dermatitis), a escala VAS (Visual Analogic Scale) para a gravidade do prurido e para a perturbação do sono, e foi ainda realizada uma avaliação da proporção de pele afetada pela dermatite atópica. Os investigadores concluíram não haver diferenças significativas entre os grupos de tratamento em nenhum dos parâmetros utilizados para avaliar a resposta ao tratamento. Os eventos adversos foram de natureza leve, exceto um caso de septicémia no grupo de intervenção, que provavelmente não esteve relacionado com o tratamento com montelucaste. Rahman34 apresentou também um ECAC, sem ocultação, onde os intervenientes foram alocados ao grupo controlo ou ao grupo de intervenção. Os investigadores utilizaram o índice SCORAD e concluíram que existiu uma melhoria estatisticamente significativa do mesmo no grupo de intervenção, sendo o prurido o parâmetro mais influenciado. Contrariamente a este resultado, o montelucaste pareceu desprovido de efeito quanto à xerose cutânea. Um outro ECAC, duplamente cego, desenvolvido por Veien35 distribuiu os participantes entre o grupo controlo e o grupo de intervenção e utilizou a escala EASI (Eczema Area and Severity Index) e a escala VAS para o prurido às 0, 1, 2 e 4 semanas de tratamento para avaliar a resposta à intervenção, não tendo sido observadas diferenças entre os dois grupos. Num estudo de Nettis,36 um ECAC duplamente cego, foi avaliada a eficácia e a tolerabilidade do montelucaste através da aplicação do índice SCORAD e pela avaliação subjetiva do prurido e da perturbação do sono. Os investigadores concluíram haver uma redução significativa na atividade da doença no grupo de intervenção. No entanto, a nível do prurido e da perturbação do sono não foram constatadas diferenças estatisticamente significativas. Nos ECAC em que o grupo controlo consistiu na administração de placebo foi permitida apenas a utilização de emolientes (Veien35 e Nettis36) ou então a utilização da combinação de emolientes, anti-histamínico e corticoide tópico (Friedmann33), independentemente dos intervenientes estarem alocados ao grupo de intervenção ou ao grupo controlo. A esta revisão sistemática foi atribuído um Nível de Evidência 2.
Por último, o ECAC de Craig TJ, et al37 comparou a administração de 10 mg diários de montelucaste com placebo durante 8 semanas, numa população com diagnóstico de dermatite atópica (Tabela 2). No total foram incluídos 60 adultos e crianças com dermatite atópica moderada a grave, tendo sido alocados aleatoriamente num dos grupos do estudo. Em ambos os grupos foi iniciada uma terapêutica de base que incluía emoliente e anti-histamínico, nomeadamente a hidroxizina, tendo sido proibido o uso de qualquer outra medicação. Para avaliação dos sintomas dos intervenientes foi utilizado o índice SCORAD, uma escala de avaliação global da doença e um score que avaliou a gravidade da erupção cutânea. Este estudo concluiu não haver diferenças estatisticamente significativas entre os dois grupos em nenhum dos parâmetros avaliados (NE 1).
Tabela 1: Revisões sistemáticas.
| REFERÊNCIA | AMOSTRA | INTERVENÇÃO | OUTCOMES | RESULTADOS | NE | |
| Revisão sistemática Chin WK, Lee SWH.28 2018 | Jeon YH, Min TK, Yang HJ, Pyun BY.29 2016 | Crianças 2-6 anos (n=54) diagnosticadas com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: montelucaste 4 mg/dia (< 6 anos) ou 5 mg/dia (≥ 6 anos) Grupo controlo: placebo Duração: 20 semanas | • Avaliar a eficácia do montelucaste em crianças com DA. | • Sem diferenças estatisticamente significativas entre os dois grupos. • Sem relato de efeitos adversos em ambos os grupos. | 2 |
| Pei AY, Chan HH, Leung TF.30 2001 | Crianças 6-16 anos (n=15) diagnosticadas com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: montelucaste 5 mg/dia Grupo controlo: placebo Duração: 12 semanas | • Avaliar a eficácia do montelucaste na DA. | • Melhoria estatisticamente significativa da gravidade da DA nos doentes em tratamento com montelucaste em comparação com placebo (p<0,05). • Sem diferenças estatisticamente significativas no score que avaliou a extensão da doença entre os grupos. • O CDLQI permaneceu semelhante ao longo do estudo, não só entre os diferentes grupos, mas também dentro do mesmo grupo. • Todos os intervenientes toleraram bem o fármaco e o placebo durante o período de estudo. | ||
| Yanase DJ, David-Bajar K.31 2001 | Adultos (n=8) diagnosticados com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: montelucaste 10 mg/dia Grupo controlo: placebo Duração: 8 semanas | • Avaliar a eficácia do montelucaste na melhoria sintomática da DA. | • Diferenças significativas no score ADASI entre o montelucaste e o placebo (p=0,014). | ||
| Revisão sistemática Ferguson L, Futamura M, Vakirlis E, Kojima R, Sasaki H, Roberts A, et al.32 2018 | Friedmann PS, Palmer R, Tan E, Ogboli M, Barclay G, Hotchkiss K, et al.33 2007 | Adultos e crianças ≥ 16 anos (n=60) diagnosticados com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: montelucaste 10 mg/dia Grupo controlo: placebo Duração: 8 semanas | • Avaliar a eficácia do montelucaste no tratamento da DA. | • Não houve diferenças significativas entre os grupos. • Os eventos adversos foram de natureza leve, exceto um caso de septicémia no grupo de intervenção. | 2 |
| Rahman ML, Choudhury AM, Islam MM.34 2006 | Adultos e crianças ≥ 6 anos (n=31) diagnosticados com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: montelucaste 5 mg/dia (6-14 anos) ou 10 mg/dia (> 14 anos) Grupo controlo: anti-histamínico e hidrocortisona tópica 1% Duração: 4 semanas | • Avaliar a eficácia e segurança do montelucaste na DA. | • Melhoria estatisticamente significativa no índice SCORAD (p=0,003) no grupo de intervenção. • Sem diferenças a nível da xerose. • Não foram observados efeitos adversos com o montelucaste. | ||
| Veien NK, Busch-Sorensen M, Stausbol-Gron B.35 2005 | Adultos e crianças ≥ 16 anos (n=59) diagnosticados com DA pelos critérios de Hanifin e Rajka | Grupo de intervenção: Montelucaste 10 mg/dia Grupo controlo: placebo Duração: 4 semanas | • Avaliar a eficácia do montelucaste no tratamento da DA. | • Não foram observadas diferenças entre o grupo de intervenção e o grupo placebo. • Não foram observados efeitos colaterais em nenhum dos grupos. | ||
| Nettis E, Pannofino A, Fanelli M, Ferrannini A, Tursi A.36 2002 | Adultos (n=20) diagnosticados com DA | Grupo de intervenção: montelucaste 10 mg/dia Grupo controlo: placebo Duração: 6 semanas | • Avaliar a eficácia e a tolerabilidade do montelucaste no tratamento da DA. | • Redução significativa na atividade da doença no grupo de intervenção em comparação com o grupo placebo (p<0,02). • Sem diferenças a nível do prurido ou da perturbação do sono. • Nenhum efeito adverso foi observado pelos investigadores ou relatado pelos intervenientes. | ||
NE - nível de evidência; DA - dermatite atópica; CDLQI - Children's Dermatology Life Quality Index; ADASI - Atopic Dermatitis Area and Severity Index; SCORAD - SCORing of Atopic Dermatitis.
Tabela 2: Ensaio clínico aleatorizado e controlado.
| REFERÊNCIA | AMOSTRA | INTERVENÇÃO | OUTCOMES | RESULTADOS | NE |
| ECAC Craig TJ, Correale C, Chinchilli V, Lehman E, Mende C, Longernecker A, et al.37 EUA 2002 | Adultos e crianças (n=60) diagnosticados com DA | Grupo de intervenção: montelucaste 10 mg/dia Grupo controlo: placebo Duração: 8 semanas | • Avaliar a eficácia do montelucaste nos sintomas da dermatite atópica. | • Sem diferenças estatisticamente significativas entre os dois grupos. | 1 |
ECAC - ensaio clínico aleatorizado e controlado; NE - nível de evidência; DA - dermatite atópica.
Discussão
Os estudos incluídos neste trabalho são heterogéneos nos seus resultados. Enquanto uns concluem que o montelucaste é uma mais-valia no tratamento da dermatite atópica, outros mostraram não haver benefício na sua utilização. Várias razões estão na origem destas observações. Primeiro, não existe até à data um método gold standard para avaliação da gravidade da dermatite atópica. Sem um instrumento padronizado de avaliação, a interpretação e comparação dos resultados entre os estudos torna-se extremamente difícil. Por exemplo, enquanto alguns estudos utilizaram o índice SCORAD para avaliação do outcome primário, outros usaram as ferramentas de pontuação SASSAD e EASI. Há um reconhecimento da falta de uniformidade na avaliação da gravidade da doença, havendo atualmente esforços para padronizar essa avaliação.38 Em segundo lugar, a maioria dos estudos apresentava uma amostra relativamente pequena, com o maior estudo a incluir apenas 60 indivíduos. Os estudos que apresentaram resultados favoráveis ao tratamento da dermatite atópica com montelucaste tinham amostras pequenas em comparação com os estudos com resultados negativos. Além disso, a eficácia do montelucaste foi demonstrada apenas para um sintoma específico e não para todo o espectro da doença. Por exemplo, no estudo de Pei,30 os autores descobriram que, apesar de uma melhoria na gravidade da doença, não houve diferenças significativas na sua extensão nem na qualidade de vida dos intervenientes entre os grupos de intervenção e placebo. Da mesma forma, Rahman34 demonstrou que o montelucaste foi capaz de ajudar a aliviar o prurido, mas mostrou-se desprovido de atividade relativamente à xerose. Os resultados inconsistentes podem dever-se também aos diferentes graus de gravidade da dermatite atópica incluídos nos estudos. Isto pode ter levado a que estudos com participantes com uma doença mais grave tivessem menor probabilidade de obter resultados favoráveis em comparação com os ensaios que incluíram apenas indivíduos com dermatite atópica leve a moderada.
Conclui-se, assim, que a evidência atual é de qualidade moderada, inconsistente e de difícil generalização. Os resultados desta revisão sugerem que, apesar de um perfil de segurança favorável, há evidências limitadas quanto à sua eficácia para sugerir o uso off-label de montelucaste no tratamento da dermatite atópica, independentemente da sua gravidade, e, portanto, não deve ser recomendado (Força de Recomendação B). São necessários novos estudos, multicêntricos, com amostras maiores e com desenhos de estudo bem definidos, que sejam uniformes na avaliação dos outcomes e que incluam um período de follow-up mais prolongado, de forma a obter resultados válidos e confiáveis acerca dos efeitos da intervenção. Assim, torna-se relevante esclarecer a real eficácia do montelucaste, a duração ideal da terapêutica, os efeitos adversos exatos do fármaco e os benefícios a longo prazo. Até lá, os tratamentos mais convencionais com base na hidratação cutânea e no controlo das infeções secundárias mantêm-se como os principais pilares no tratamento da dermatite atópica.