Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Corrosão e Protecção de Materiais
versão impressa ISSN 0870-1164
Corros. Prot. Mater. vol.33 no.1-2 Lisboa mar. 2014
ARTIGO
Biocorrosão – da integridade do biofilme à integridade do material
Biocorrosion – from biofilms integrity to integrity of materials
A. C. Albuquerque(1,2) (*), C. Andrade(3) e B. Neves(2,4)
1 Laboratório de Biocorrosão e Acidulação Biogênica, Gerência de Biotecnologia, Centro de Pesquisa e Desenvolvimento (CENPES), PETROBRAS, Av. da Republica, nº 65, Centro – CEP:20031-912 – Rio de Janeiro-RJ, Brasil.
2 Programa de Pós-Graduação em Bioquímica, Instituto de Química (IQ), UFRJ, CEP:21941-915, Rio de Janeiro, Brasil.
3 Laboratório de Eletroquímica e Corrosão da Gerência de Tecnologia de Materiais, Equipamentos e Corrosão, Centro de Pesquisa e Desenvolvimento (CENPES), PETROBRAS, CEP:20031-912, Rio de Janeiro, Brasil, e-mail: cynthia.andrade@petrobras.com.br
4 Laboratório de Microbiologia Molecular e Proteômica, Departamento de Bioquímica, Instituto de Química (IQ), UFRJ, CEP:21941-915, Rio de Janeiro, Brasil, e-mail: bcneves@iq.ufrj.br
(*) A quem a correspondência deve ser dirigida, e-mail: ana.carla@petrobras.com.br
RESUMO
A integridade de um material metálico, submetido a determinadas condições físico-químicas que favoreçam o crescimento de microrganismos, pode ser comprometida pela presença de biofilmes em sua superfície. Os métodos mais comuns aplicados para controle da biocorrosão e formação de biofilmes são: boas práticas de limpeza, uso de revestimentos metálicos e não-metálicos, proteção catódica e tratamentos com biocidas. Existe uma busca crescente por moléculas eficientes e menos tóxicas (green molecules) para controle de biofilmes na indústria do petróleo. Neste trabalho serão apresentados alguns exemplos de green molecules como enzimas, extratos vegetais, bacteriófagos, biosurfactantes e bactérias isoladas de organismos marinhos. A desagregação de biofilme pode ser a chave para o controle dos efeitos nocivos causados pelos microrganismos indesejáveis na indústria do petróleo.
Palavras-chave: Biofilmes, Moléculas Verdes, Biocorrosão, Integridade de Materiais
ABSTRACT
The integrity of a metallic mat erial, subjected to physicochemical conditions which promote the growth of microorganisms, may be affected by the presence of biofilms on its sur face. Methods commonly applied for control of biocorrosion and biofilms formation are: good cleaning practices, use of metallic and nonmetallic coatings, cathodic protection and microbial control by biocide treatments. There is a growing search for efficient and less toxic molecules (green molecules) for control of biofilms in the petroleum industry. In this work will be presented some examples of green molecules such as enz ymes, plant extracts, bacteriophages, biosurfactants and bacteria isolated from marine
Keywords: Biofilms, Green Molecules, Biocorrosion, Materials Integrity.
1. BIOFILMES – MATRIZ POLIMÉRICA
Microrganismos não vivem naturalmente como culturas puras de células dispersas, mas tendem a acumular-se em interfaces formando agregados polimicrobianos, como filmes, lodos e biofilmes [1]. Na maioria dos biofilmes, os microrganismos correspondem a cerca de 10 % da massa seca, enquanto a matriz extracelular pode corresponder a mais de 90 %. A matriz é o material extracelular, produzido principalmente pelos próprios microrganismos, em que as células do biofilme são imersas. Esta matriz polimérica é conhecida como Extracellular Polymeric Substance (EPS) [2]. O EPS é constituído por polissacarídeos, proteínas, exoenzimas, ácidos nucleicos e lípidos que permitem imobilizar as células do biofilme, mantendo o biofilme coesivo. Algumas estruturas bacterianas como flagelos, pili e fímbrias também estabilizam a matriz polimérica. No interior desta matriz polimérica ocorrem interações moleculares diversas e uma intensa comunicação célula/célula, denominada Quorum Sensing (QS) [3]. A integridade dos biofilmes é mantida também através de interações como forças de Van der Waals, forças eletrostáticas e interações hidrofóbicas. Uma função importante da matriz polimérica é proteger o consórcio microbiano da ação de agentes físicos e químicos. No biofilme, as células são suficientemente imobilizadas para permitir interações sinergísticas, como a utilização de substratos, mas não se encontram aprisionadas, podendo mover-se e sair do consórcio [2].
A arquitetura tridimensional dos biofilmes é influenciada por diversos fatores como condições hidrodinâmicas, concentração de nutrientes, comunicação intercelular e capacidade de produção de EPS [4]. Escherichia coli, Bacillus subtilis e Pseudomonas aeruginosa têm sido reportadas como microrganismos formadores de biofilmes, sendo modelos extensivamente estudados.
A adesão de bactérias a superfícies metálicas pode dar início à formação de biofilmes, dentro dos quais os processos metabólicos afetam significativamente a corrosão da superfície [5]. Nos biofilmes, os microrganismos formam comunidades sinérgicas que realizam processos sincronizados, que células individuais não realizam. Dessa forma, para o controle dos biofilmes em questão, é imprescindível o conhecimento da diversidade microbiana presente nas amostras de determinado ambiente. O estudo da comunicação intercelular, intra- ou interespecífica, é fundamental para que se conheçam quais os microrganismos que estarão conversando. Esta "conversa" deve ser avaliada pela caracterização dos sinalizadores bioquímicos envolvidos, pelo monitoramento dos perfis de expressão gênica e pela visualização da mor fologia microscópica. Por exemplo, microrganismos aeróbios e anaeróbios existem em biofilmes que naturalmente ocorrem em ambientes oxigenados [6].
O início da formação de um biofilme é marcado pela deposição de matéria orgânica sobre a superfície que será colonizada, sendo essa fase um pré-requisito para a posterior adesão microbiana, como ilustra a Fig. 1. Fatores como a natureza e a concentração dos nutrientes disponíveis, como por exemplo, partículas de proteínas, lípidios, fosfolípidos, carbohidratos, sais minerais e vitaminas regulam a formação do biofilme [7]. A fase da vida vegetativa em que os microrganismos se encontram, a presença de apêndices celulares e as substâncias poliméricas produzidas têm papel importante na velocidade da adesão. Além disso, a rugosidade do material pode ser um fator favorável para aumentar a aderência [8].
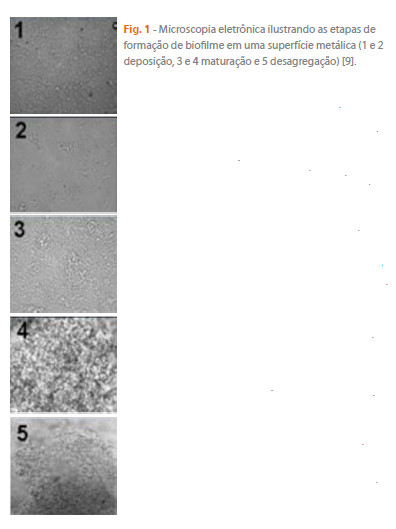
Clark et al. [10] relataram a formação de biofilme por Desulfovibrio vulgaris, observando-se uma matriz de exopolímeros relativamente pouco espessa que apresenta filamentos protéicos essenciais à formação do biofilme. Segundo os autores, estes filamentos parecem ser flagelos. Estudos realizados por Zhang et al. [11] simularam a formação de biofilme por Desulfovibrio vulgaris com o objetivo de examinar os padrões de expressão diferencial entre populações planctônicas e biofilmes maduros para este microrganismo em superfície metálica. Em biofilmes bacterianos aeróbios (e.g. espécies de Pseudomonas e Escherichia coli) os resultados demonstraram a expressão de genes que codificam uma proteína relacionada com o motor flagelar, proteínas envolvidas na motilidade celular, bem como genes envolvidos na biossíntese de exopolissacarídeos. Estas evidências moleculares corroboram os dados morfológicos que associam flagelos à formação e manutenção dos biofilmes.
2. MICRORGANISMOS NA INDÚSTRIA DO PETRÓLEO
A importância dos microrganismos para a indústria de óleo e gás tem sido reconhecida e a cada ano que passa, a preocupação com os impactos causados por eles são mais evidentes. O primeiro relato foi na década de 30 pelos cientistas Von Wolzogen Kuhr e Van der Klugt que observaram a causa da aceleração da corrosão anaeróbia externa sobre dutos não protegidos em solos úmidos com a ação das bactérias redutoras de sulfato (BRS). Estas observações iniciais foram a base para que as indústrias de petróleo procurassem por métodos de detecção, quantificação e controle desses microrganismos em seus sistemas [12].
A Fig. 2 apresenta o biofilme encontrado numa amostra de água produzida no campo da Bacia de Campos.
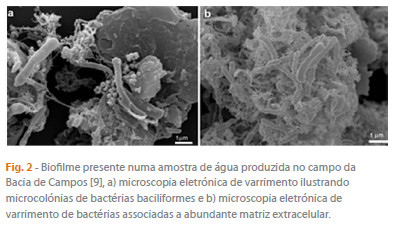
Na indústria do Petróleo, especialmente nos sistemas de transporte de óleo cru, observam-se falhas frequentes. Estudos demonstraram que microrganismos anaeróbios, facultativos e aeróbios participaram, sob a forma de biofilme, no processo corrosivo naqueles sistemas [12].
Os microrganismos usualmente encontrados nos sistemas de óleo podem ser bactérias, fungos e/ou algas [12]. A predominância de um ou outro microrganismo dependerá do sistema operacional, das condições ambientais e da natureza e do tipo de microrganismos presentes. Em geral, maior ênfase é dada às bactérias, uma vez que a formação de um consórcio bacteriano facilita a interação e o crescimento de outros grupos de microrganismos e sua permanência nos diferentes sistemas sob a forma de biofilmes.
Alguns exemplos de bactérias presentes nos sistemas de transporte de óleo são: bactérias oxidantes de enxofre, bactérias precipitantes de ferro, Bacillus spp, Archaea, bactérias produtoras de ácido, bactérias produtoras de EPS e bactérias redutoras de sulfato (BRS), sendo esta última a mais conhecida e estudada nos processos de biocorrosão [12].
A bactéria redutora de sulfato (BRS) foi apontada por Zobell, em um projeto do American Petroleum Institute (API), na década de 40, como participante da diagênese do óleo. Em 1963, Kuznetsova et al. reportaram a redução de sulfatos in situ dEcorrente da injeção de água doce, contendo sulfato, e com BRS presente em pool com outros microrganismos,gerando graves consequências relativas ao souring. Na década de 70, Davis demonstrou a sua participação no ciclo de maturação de óleo, em presença de microrganismos aeróbios ou facultativos, consumidores de hidrocarbonetos (alcanos leves), nos contatos óleo/água dos reservatórios. Evidências laboratoriais permitiram confirmar as suspeitas relativas à metabolização direta de cadeias de hidrocarbonetos parafínicos por espécies isoladas de BRS. Em outra revisão da literatura discutiu-se as muitas interações entre as BRS e as atividades relativas à produção de petróleo. A produção de polissacarídeos extracelulares por Desulfovibrio tem sido observada em culturas formadoras de biofilmes [13].
As BRS são as principais responsáveis pelos problemas de geração biogênica de H2S e pelos processos de corrosão microbiológica (MIC) em superfícies metálicas da indústria do petróleo [13].
As BRS podem ser encontradas na forma planctônica ou séssil (aderidas a uma superfície). A ação das BRS pode levar a processos de corrosão microbiológica. Dois mecanismos têm sido propostos para a corrosão de superfícies metálicas por BRS: o mecanismo indireto é um processo de ataque químico pelo H2S enquanto no mecanismo direto as BRS estimulam a corrosão pela retirada do hidrogênio catódico ou do filme de hidrogênio do metal exposto à àgua [14]. O mecanismo de corrosão direta é normalmente atribuído a espécies de Desulfovibrio [14].
É difícil estimar os custos relacionados com processos corrosivos atribuídos à atividade dos microrganismos (BRS e outras bactérias). Centenas de milhões de dólares são gastos pelas companhias de petróleo, anualmente, para minimizar efeitos econômicos e ambientais atribuídos à corrosão, incluindo a corrosão microbiológica [15]. No caso da corrosão microbiológica ou geração biogênica de H2S os custos englobam produtos químicos como biocidas e sequestrantes de H2S, problemas no enquadramento da carga, etc.
A atividade microbiana de bactérias redutoras de sulfato (BRS) em consórcio com outras bactérias facultativas ou anaeróbias pode causar consequências graves para a indústria do petróleo, que estão normalmente associadas à geração de altas concentrações de H2S. O impacto destes altos teores de H2S nas Unidades Operacionais envolve além de questões de segurança operacional, meio ambiente e saúde ocupacional (SMS), o comprometimento da integridade dos materiais metálicos. As Figs. 3 e 4 apresentam casos reais da ocorrência de problemas provocados pelo processo de biocorrosão e geração biogênica de H2S na cadeia produtiva do óleo.


Foram analisadas amostras de dois campos de petróleo da bacia de Campos visando a obtenção da diversidade microbiana presente através de bibliotecas de genes 16S rrnA. A sequência de clones determinou cerca de 78,2 % de Grammaproteobacteria, a maioria identificada como sendo da família Pseudomonadaceae. Contudo clones de Betaproteobacteria (10,9 %), da família Comamonadaceae, Burkholderia e Oxalobacteraceae , Alphaproteobacteria (9 %), frequentemente encontrada em oceanos, e Firmicutes (1,9 %) também foram encontrados [17]. Outro genero, as Ferro-bactérias (Gallionella), utilizam o ferro dos equipamentos industriais para produção de hidróxido de ferro, podendo causar também a oxidação e depósito de formas insolúveis de ferro. As bactérias redutoras de sulfato (Desulfovirio sp) estão relacionadas com os problemas de bicorrosão na industria do petróleo.
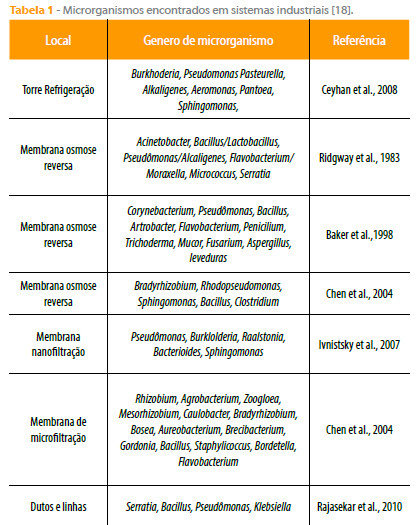
A Tabela 1 ilustra os principais microrganismos encontrados em sistemas da indústria do petróleo.
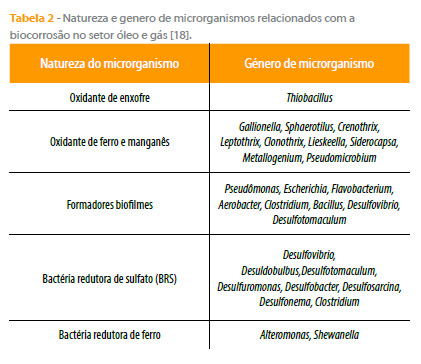
A Tabela 2 apresenta microrganismos envolvidos no processo de biocorrosão da indústria do petróleo.
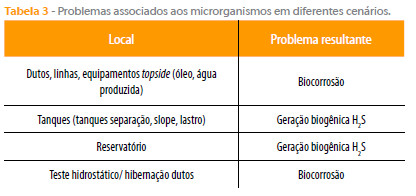
3. LOCAIS MAIS SUSCETÍVEIS ÀS BRS NA INDÚSTRIA DO PETRÓLEO
Os microrganismos encontrados nos sistemas de petróleo são capazes de sobreviver sob condições extremas de temperatura, pressão e salinidade possuindo a capacidade de se reativarem ao encontrar condições favoráveis para seu crescimento.
As principais fontes de contaminação de BRS na indústria de óleo são:
presença de BRS em reservatórios, bactérias indígenas. Ao receberem água do mar, recebem fonte de sulfato, podendo ocorrer também alteração de temperatura (resfriamento de algumas zonas). Quando ocorre geração de H2S no reservatório recebe o nome de souring e se este óleo e água produzida contendo H2S chega à super fície, pode trazer problemas de corrosão microbiológica ou mesmo potencializar a geração do H2S, devido à condição favorável para o metabolismo de bactérias;
Contaminação durante a perfuração dos poços, com uso de fluidos de perfuração ricos em fonte de carbono;
Injeção de água (mar, produzida ou de aquífero) para recuperação secundária de petróleo;
Durante teste hidrostático de dutos (mar, rio ou aquífero).
Os fatores envolvidos na atividade microbiana são:
Presença de água,
Temperatura apropriada;
Salinidade baixa-moderada (35-100) g/L;
Fonte de sulfato (solúvel e insolúvel);
Fonte de carbono (lactato, acetado, ácidos voláteis, de cadeia curta, associação com microrganismos produtores de biosurfactantes que acessam o óleo);
Baixa velocidade de fluxo, pontos de estagnação.
A Tabela 3 ilustra os locais e a natureza do problema gerado pelos microorganismos no setor de óleo e gás.
4. CONTROLE DA BIOCORROSÃO
Os métodos mais frequentemente aplicados para controle da biocorrosão e formação de biofilme são:
Boas práticas de limpeza (incluindo alguns procedimentos, como uso de Pig).
Revestimentos;
Proteção catódica;
Uso de biocidas [19].
Biocidas vêm sendo usados em sistemas de injeção de água para recuperação de petróleo, dutos, tanques, torres de refrigeração, etc.
Em caso de dutos, recomenda-se a combinação de biocida com a passagem de pig de limpeza, que é uma ferramenta que promove a remoção de resíduos na superfície interna do duto [20].
Para a escolha do produto biocida é imprescindível que sejam realizados ensaios de desempenho do pr oduto frente aos microrganismos de interesse. Após esta etapa é necessário a avaliação da toxicidade do produto. O uso em campo está condicionado à liberação pelo Organismo ambiental competente. Existe uma busca crescente por moléculas eficientes e menos tóxicas (green molecules).
Conforme mencionado anteriormente, os biofilmes constituem uma barreira para a ação de produtos químicos, o que dificulta este tipo de tratamento. Dessa forma, novas tecnologias vêm sendo estudadas com o intuito de permitir melhor controle do processo de biocorrosão e de geração biogênica de H2S causada pela presença dos biofilmes.
5. PERSPECTIVAS FUTURAS – GREEN MOLECULES
5.1 Enzimas (Biofilmes e Sinais de QS)
Algumas estratégias enzimáticas podem ser utilizadas para evitar o processo de biocorrosão, a primeira estratégia é a aplicação de enzimas como agentes biocidas, que impeçam a instalação do consórcio microbiano formador do biofilme. A segunda baseia-se no uso de enzimas para a degradação do biofilme, e consequente dispersão dos microrganismos, impedindo o surgimento das condições necessárias para a biocorrosão e a terceira é através da utilização de enzimas que degradam os sinais de comunicação celular que regulam a formação do biofilme.
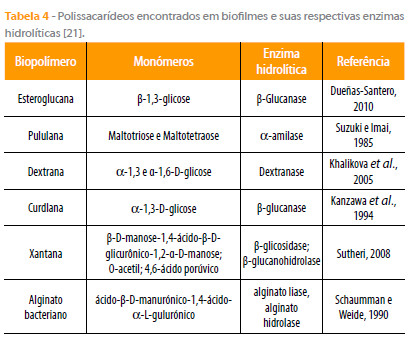
O uso de lisozimas (EC 3.2.1.17) pode ser citado como anti-bactericida e de quitinases como anti-fúngicos. A lisozima hidrolisa o esqueleto glicosídico da matriz peptidioglicana presente na parede celular de bactérias gram-positivas, a quitinase compreende as enzimas endoquitinase (EC 3.2.1.14), quitina 1,4-ß-quitobiosidase (EC 3.2.1.29), ß-N-acetilglucosaminidase (EC 3.2.1.52), e glucana-1,3-ß-glucosidases (EC 3.2.1.58). Essas enzimas atuam de forma sinérgica na degradação da quitina, polissacarídeo presente na parede celular de fungos e leveduras. A presença de polissacarídeos na constituição do biofilme permite o uso de enzimas hidrolíticas que atuarão desagregando a matriz polimérica [21].
A Tabela 4 mostra as enzimas responsáveis pela degradação de biopolímeros encontrados em biofilmes.
O quorum sensing (QS) é também considerado um fator importante para a sobrevivência dos microrganismos em biofilmes. É um sistema eficiente de comunicação, pois as moléculas denominadas autoindutoras, fluem livremente através das membranas e entre as células sinalizando sua densidade e as condições ambientais. Algumas substâncias que atuam no QS já são conhecidas, dentre elas, destacam-se compostos da classe das N-acil-L-homoserina lactonas (AHLs) encontradas em bactérias Gram-negativas [22]. Bactérias Gram-positivas utilizam peptídeos ou peptídeos modificados após a tradução como moléculas autoindutoras [23]. O sistema QS, juntamente com outros fatores fisiológicos, possui um controle genético que atua em condições de alta densidade populacional. Por essa razão, o sistema QS é mais efetivo em densidade microbiana elevada, bem como, em um biofilme devidamente estabelecido. O sistema QS pode ter impacto direto nas propriedades da comunidade que liberam o sinal, e tem a finalidade de garantir a estabilidade da comunidade e a continuação das funcionalidades relacionadas ao nicho ecológico em questão [24].
Enzimas que degradam os sinais de quorum sensing foram descritas por Dobretsov e colaboradores. Neste trabalho foi dada ênfase à degradação de sinais AHL. Lactonases, acilases e oxirredutases são enzimas capazes de degradarem AHL.
5.2 Extratos vegetais
Muitos trabalhos envolvendo a ação antibiótica de extratos vegetais ou de princípio ativo encontrados em plantas são descritos na literatura com alto desempenho para aplicação na área médica. Trabalhos publicados sobre uso de extratos para controle de BRS não têm sido relatados. No entanto, moléculas bioativas oriundas de plantas têm sido submetidas a avaliações de eficiência frente aos microrganismos da indústria do petróleo (moléculas em processo de depósito de patente).
Moléculas biodegradáveis (menor toxicidade) e processos físicos também têm sido estudados para uso industrial [25]. Um dos grandes desafios dos processos físicos é a adaptação da técnica devido à natureza da matriz, em geral as amostras são oleosas e de salinidade média-alta.
5.3 Bacteriófagos
Bacteriófagos ou fagos são vírus que infectam hospedeiros pertencentes aos domínios Archaea e Eubacteria, com natureza geral similar a de outros vírus. Os fagos são constituídos por ácido nucléico envolto por uma capa protéica (capsídeo), podendo ou não possuir envelope lipoproteico. A utilização de fagos como agentes antimicrobianos pode ser muito vantajosa pela sua alta especificidade, precisão e potência em comparação ao uso de biocidas, possuindo a capacidade de infectar bactérias de forma seletiva. Fagos ainda possuem capacidade de se replicar no sítio de infecção estando, portanto disponíveis em abundância no local desejado. A interação com bactérias requer um receptor específico, permitindo a sua entrada e multiplicação. Os fagos podem ser encontrados praticamente em qualquer lugar, podendo ser isolados do solo, da água, do fundo do oceano, assim como do corpo de animais, pois se propagam em bactérias que são simbióticas ou patogênicas aos organismos mais evoluídos. Evidências da capacidade de degradar polissacarídeos bacterianos por enzimas polissacarídeo depolimerase (EPD) presentes em bacteriófagos foram registrados à mais de 50 anos. Bacteriófagos também são capazes, pela ação de depolimerases, de degradar a matriz polissacarídica em biofilmes, infectar as células e causar desestruturação extensa do biofilme [26].
5.4. Biossurfactantes
Biossurfactantes podem apresentar propriedades antibacterianas e antifúngicas. São também importantes para regulação do processo de formação e desagragação do biofilme. Raminolipídeos, que são biosurfactantes, são encontrados na matriz polimérica da Pseudomonas aeruginosa. Estudos demonstraram que este biossurfactante apresentou interação com a superfície, influenciando a formação do biofilme [2].
5.5. Uso de bactérias
Bactérias com propriedades antimicrobianas têm sido isoladas de organismos marinhos invertebrados, pois se observou que nesses organismos não ocorre deposição de biofilme em sua superfície [27]. Outros exemplos de organismos são esponjas e corais [27]. Há ainda a necessidade de avanços de pesquisa nesta área, podendo ser apontada como uma tecnologia promissora.
6. CONCLUSÕES
A desagregação de biofilmes e controle de sua formação é um desafio que pesquisadores de diferentes áreas, incluindo a médica, a indústria alimentícia e a indústria de óleo e gás, vêm estudando ao longo dos anos
O processo de desagregação de biofilme deve ser visto como uma estratégia interessante quando se pretende manter a integridade de um material metálico. O controle dos biofilmes nos ambientes industriais pode ser a chave para o combate aos efeitos nocivos causados pelos microrganismos indesejáveis, garantindo a integridade do material e a prevenção contra a produção de metabólitos tóxicos e corrosivos.
Fato que impulsiona as pesquisas que visam o desenvolvimento de estratégias de controle de biofilmes é a crescente taxa de resistência dos microrganismos às estratégias classicamente usadas. Por exemplo, a resistência das bactérias aos antibióticos/biocidas e a dificuldade de tratamento de microrganismos aderidos, com a presença do EPS, que atua como uma camada protetora contra agentes externos.
Finalmente, a nova tendência do consumo baseado na consciência ambiental tem levado à busca de novas alternativas tecnológicas, que sejam economicamente viáveis, que funcionem de forma eficiente e que reduzam de forma significativa os riscos ao ambiente e à manipulação dos agentes em questão. A utilização de moléculas verdes (green molecules) no controle de biofilmes é uma alternativa inovadora, que segue a tendência da Química Verde (Green Chemistry), inaugurada por John Warner [28]. Este conceito explora as oportunidades presentes em processos naturais, como, por exemplo, os mecanismos de comunicação célulacélula (Quorum Sensing), a infecção por bacteriófagos, a atividade enzimática e os biocidas naturais como alvos e/ou ferramentas para a inovação tecnológica no controle de biofilmes em sistemas industriais.
REFERÊNCIAS
[1] J. Wingender, T. Neu and H. C. Flemming. Microbial Extracellular Polymeric Substances: Characterization, Structure and Function. Springer, Germany, p.1–19 (1999). [ Links ]
[2] H. C. Flemming and J. Wingender, Nature Reviews, 8, 623-633 (2010). [ Links ]
[3] T. R. De KIevit, Environ. Microbiol., 11, 279 (2009). [ Links ]
[4] P. Stoodley, R. Cargo, C. J. Rupp, S. Wilson and I. Klapper, J. Ind. Microbiol. Biot., 29, 361–367 (2003). [ Links ]
[5] B. Little, P. Wagner and F Mansfeld, Electrochim. Acta, 37, 2185–2194 (1992). [ Links ]
[6] F. C. M. Magalhães, M. O. Penna e C. A. Andrade (Proposições para a Melhoria da Qualidade da Água e Controle do Processo Corrosivo em Sistemas de Injeção de Água do Mar) in Relatório Técnico SEAMB 11/99, Petrobras, Rio de Janeiro, Brasil (1999). [ Links ]
[7] I. Capdeville and K. M. Nguyen, Water Sci. Technol., 22, 149-170 (1990). [ Links ]
[8] I. Apilánez, A. Gutiérrez, and M. Díaz, Bioresource Technol., 66, 225- 230 (1998). [ Links ]
[9] A. C. C. Albuquerque, V. V. C. Mota e D. A. Teixeira (Análise On Line de Bactérias e Biofilmes por Espectrometria de Infravermelho com Transformada de Fourrier/ FT-IR) in Comunicação Técnica BTA 001/2010, Petrobras, Rio de Janeiro, Brasil (2010). [ Links ]
[10] M. Clark, R. E. Edelmann, M. L. Duleyl, J. D. Wal and M. W. Fields, Environ. Microbiol., 9, 2844–2854 (2007). [ Links ]
[11] W. Zhang, D. E. Culley, L. Nie and J.C.M. Scholten, Appl. Microbiol. Biot., 76, 447–457 (2007). [ Links ]
[12] F. C. M. Magalhães, M. O. Penna e C. A. Andrade (Manual de Especificação de Qualidade da Água de Injeção – Fatores Associados à Ação de Microrganismos) in Relatório Técnico SEBIO 10/98, Petrobras, Rio de Janeiro, Brasil (1998). [ Links ]
[13] F. C. M. Magalhães, M. O. Penna, E. D. Silva, H. B. Oliveira e J. R. Nascimento (Diagnóstico da Qualidade da Água Produzida para Reinjeção – Previsão e Controle do Souring e da Corrosão Influenciada por Microrganismo em Pampo) in Relatório Técnico SEBIO 02/96, Petrobras, Rio de Janeiro, Brasil (1996). [ Links ]
[14] H. T. Dinh, J. Kuever, M. Mussmann, A. W. Hassel, M. Stratmann and F. Widdel, Nature 427, 829–832 (2004). [ Links ]
[15] F. C. M. Magalhães; M. O. Penna, E. D. Silva, H. B. Oliveira and J. R. Nascimento (Técnicas Microbiológicas Aplicadas ao Diagnóstico de Processo Corrosivo Influenciado por Microrganismo - CIM) in Relatório Técnico SEBIO 14/98, Petrobras, Rio de Janeiro, Brasil (1998). [ Links ]
[16] C. A. Andrade, E. R. Fedel, N. D. Freitas, F. C. M. Magalhães, M. C. M. Bezerra e M. O. Penna (Controle da Corrosão Interna do Oleoduto PCH-1/PCH-2) in Relatório Técnico SEMEC, Petrobras, Rio de Janeiro, Brasil (1999). [ Links ]
[17] E. Korenblum, D. B. Souza, M. O Penna and L. Seldin, International Journal of Microbiology, 28, 2355-2363 (2012). [ Links ]
[18] H. Annuk and A. P. Moran (Microbial biofilm-related polysaccharides in biofouling and corrosion) in Microbial Glycobiology, (A. Moran, O. Holst, P. Brennan and M. Von Itzstein, ed.), Academic Press, London, UK (2009). [ Links ]
[19] H. A. Videla, Int. Biodeter. Biodegr., 49, 23-28 (2002). [ Links ]
[20] B. Cottis, M. Graham, R. Lindsay, S.Lyon, T. Richardson, D. Scantlebury and H. Stott, Corrosion Evaluation, 2, 1169–1190 (2010). [ Links ]
[21] M. C. C. Albuquerque, A. C. C. Albuquerque, M. P. Sousa, A. G. T. Volpon, G. V. Sebastian, J. C. Q. Neto e A. M. Castro, Boletim Técnico Petrobras, Vol. 5, N. 2 (2012). [ Links ]
[22] U. M. Pinto, E. S. Viana, M. L. Martin and M. C. D. Vanetti, Food Control, 18, 1322-1327(2007). [ Links ]
[23] O. P. Kuipers, P. G. G. A. Ruyter, M. Kleerebezem and W. M. Vos, J. Biotechnol., 64, 15-21 (1998). [ Links ]
[24] S. Kjelleberg and S. Molin, Curr. Opin. Microbiol., 5, 254-258 (2002). [ Links ]
[25] C. N. Street and A. Gibbs, Corros. Sci., 52, 113-117 (2010). [ Links ]
[26] A. C. C. Albuquerque, C. A. Andrade, G. V. Setasbian, R. R. Valerio, and V. V. C. Mota (Bionanotecnologia Aplicada à Corrosão Microbiana) in Procedimentos do Congresso Internacional de Corrosão INTERCORR 014, Maio, Salvador, Brasil (2012). [ Links ]
[27] S. Dobretsov, R. M. M. Abed and M. Teplitski, Biofouling, 29, 423– 441 (2013). [ Links ]
[28] P. T. Anastass and J. C. Warner. Green Chemistry: Theory and Practice. Oxford University Press, UK (1998). [ Links ]
Artigo submetido em Setembro de 2013 e aceite em Dezembro de 2013













