Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.2 Lisboa abr. 2013
Trichoderma no controlo in vitro de fungos presentes em diásporos de Gochnatia polymorpha
Trichoderma in vitro control of fungi present in diaspores of Gochnatia polymorpha
Daniele Franco Martins Machado e Antonio Carlos Ferreira da Silva
* Departamento de Biologia, Centro de Ciências Naturais e Exatas, Universidade Federal de Santa Maria (UFSM), Avenida Roraima, n. 1000, CEP 97119-970, Santa Maria, Rio Grande do Sul, Brasil. E-mail: danifmartins@gmail.com, author for correspondence, acfsilva2@uol.com.br
RESUMO
Este trabalho teve como objetivo avaliar o efeito de isolados e produtos biológicos de Trichoderma spp. no controlo in vitro de fungos presentes nos diásporos de Gochnatia polymorpha. Foram avaliados, pela técnica de confrontação direta, os isolados TSM1, TSM2, 2B2 e 2B22 e os produtos Trichodermil® e Agrotrich® no antagonismo a fungos dos gêneros Bipolaris, Alternaria, Cladosporium e Phoma, isolados dos diásporos. O efeito de trichoderma na contaminação fúngica dos diásporos foi avaliado pela técnica do papel celofane utilizando-se como meio de cultura ágar-água + BD (batata dextrose). Também se estudou o efeito na germinação das sementes. O isolado 2B22 e o produto Agrotrich® são os mais eficientes no antagonismo aos fungos testados e todos os trichodermas avaliados são eficientes no controlo in vitro da contaminação fúngica dos diásporos. A adição de BD ao meio ágar impede a germinação das sementes, impossibilitando avaliar o efeito dos metabólitos de trichoderma nesse processo.
Palavras-chave: Bioagente, cambará, espécie florestal, interação planta-microrganismo
ABSTRACT
The effect of isolates and biological products of Trichoderma spp. in vitro in control of fungi present in diaspores of Gochnatia polymorpha was evaluated in this study. The use of direct confrontation technique, the TSM1, TSM2, 2B2 and 2B22 isolated and the Trichodermil® and Agrotrich® products were also studied in antagonism of fungi belonging to Bipolaris, Alternaria, Cladosporium and Phoma genera, which were isolated from diaspores. We have studied the effect of fungal contamination in trichoderma diaspores using the technique of cellophane and water-agar + BD (potato dextrose) as culture media. We also studied the effect on seed germination. The 2B22 isolated and the Agrotrich® product are the most effective in the antagonism of the fungi tested, and all evaluated trichodermas are effective in vitro control of the fungi diaspores contamination. The addition of BD to agar medium precludes the germination of seeds. This makes impossible to evaluate the effect of metabolites from trichoderma in this process.
Keywords: Bioagent, cambaraforest, species, plant-microorganism interaction
Introdução
A interação entre plantas e microrganismos é uma alternativa sustentável, pesquisada e aplicada em diversas culturas agrícolas (Altomare et al.,1999). Esta técnica vem sendo amplamente utilizada em pesquisas de instituições de ensino e centros de pesquisa, sendo que alguns microrganismos têm sido relatados no controlo biológico de fitopatógenos, na promoção da germinação de sementes e no crescimento vegetal de diferentes culturas, com sucesso comprovado e outros com potencial de uso (Melo, 1998; Hoyos-Carvajal, et al., 2009).
Dentre os antagonistas utilizados no biocontrolo de fungos fitopatogênicos, cerca de 90% têm sido realizados com diferentes isolados pertencentes ao gênero Trichoderma (Benítez et al., 2004; Kunieda-Alonso et al., 2005). Diferentes isolados têm levado a aumentos significativos na percentagem e na precocidade de germinação (Melo, 1996), além do aumento no crescimento de plantas e na produtividade de culturas inoculadas com esse bioagente, como milho, feijão, arroz, ervilha, grão-de-bico, pepino, berinjela, pimentão, rabanete, tomate, alface, cenoura, cravo, crisântemo, algodão, entre outras (Almança, 2005; Gravel et al., 2007; Harman et al., 2004b; Hoyos-Carvajal et al., 2009; Jyotsna et al., 2008; Luz, 2001; Resende et al., 2004; Yedidia et al., 2001).
Espécies do gênero Trichoderma, conhecidas popularmente por trichoderma, compreendem fungos de vida livre, que se reproduzem assexuadamente, presentes com mais frequência em solos de regiões de clima temperado e tropical. Muitas linhagens não possuem ciclo sexual conhecido (Harman et al., 2004a), sendo classificadas na sub-divisão Deuteromycotina e são caracterizadas pela produção de conídios ou por fragmentação do talo micelial (Kruger e Bacchi, 1995).
Os isolados de trichoderma são utilizados no controlo biológico de fitopatógenos e na promoção de crescimento vegetal devido a sua versatilidade de ação, como parasitismo, antibiose e competição; além de atuarem como indutores de resistência a plantas contra doenças e produzirem hormônios (hormonas) de crescimento. Essas características tornam-nos os fungos mais pesquisados em condições de laboratório, estufa e a campo (Altomare et al., 1999; Delgado et al., 2007; Carvalho-Filho et al., 2008; Harman, 2000; Hoyos-Carvajal et al., 2009; Louzada et al., 2009; Resende et al., 2004). Além disso, há dezenas de produtos à base de trichoderma disponíveis no mercado para comercialização (Lopes, 2009).
No Brasil, para a produção e o cultivo de mudas florestais, várias dificuldades são encontradas. Entre estas dificuldades está o pequeno número de árvores matrizes disponíveis em populações naturais, que se encontram extremamente fragmentadas, o que resulta na falta de sementes com qualidade adequada, por terem baixo poder germinativo e alto índice de fungos associados às sementes. Acresce a estas dificuldades o facto de algumas espécies apresentarem crescimento lento (Caldas, 2006; Carneiro, 1987; Silva e Higa, 2006). Esses, dentre outros fatores, acabam prejudicando o cultivo das mudas e fazem com que estas sejam comercializadas com baixa qualidade e alto custo.
Gochnatia polymorpha (Less.) Cabrera é uma espécie arbórea pertencente a família Asteraceae, com ocorrência natural no nordeste da Argentina, norte e leste do Paraguai e alguns estados brasileiros, como os da região Sul, onde é conhecida popularmente por cambará. A espécie destaca-se pela sua importância econômica e ambiental. A madeira é utilizada na construção civil, obras imersas, carvão e lenha. Apresenta características ornamentais e medicinais, sendo as folhas e cascas utilizadas no preparo de chás para afecções bronco-pulmonares e as flores são melíferas. Também é recomendada para arborização urbana, recuperação de ecossistemas degradados e conservação do solo, sendo indicada como planta fixadora de barrancas de rios e reposição de mata ciliar (Backes e Irgang, 2002; Carvalho, 1994; 2003; Glufke, 1999; Souza-Junior et al., 2005; Lorenzi, 1998; Piña-Rodrigues et al., 2007; Stefanello et al., 2006).
G. polymorpha produz anualmente grande quantidade de frutos do tipo cipsela, caracterizados pela ocorrência de uma semente presa à sua parede por um só ponto. Os frutos são a unidade de dispersão da espécie, denominada diásporo, sendo a sua principal forma de dispersão, a anemocoria. Contudo, apesar da grande produção anual de frutos, o poder germinativo das sementes é baixo, e o crescimento das mudas é lento a moderado (Carvalho, 2003).
O mercado consumidor de sementes e mudas florestais tem aumentado consideravelmente nos últimos 20 anos, devido ao crescente interesse econômico, e mais recentemente, pela preocupação conservacionista em recuperar áreas intensamente devastadas (Figliolia et al., 2007). No entanto, esse processo tem sido dificultado pelos problemas enfrentados na produção de mudas, sendo que o desenvolvimento de técnicas silviculturais, como a interação entre plantas e microrganismos, é uma alternativa sustentável para controlar biologicamente os fungos presentes nas sementes/diásporos e estimular a germinação e o crescimento vegetal. No entanto, para a maioria das espécies florestais, esta é uma alternativa muito carente (Caldas, 2006).
Embora em vários estudos se tenha observado a ação positiva de isolados de trichoderma, existem poucos relatos de pesquisas envolvendo a interação desses bioagentes e espécies arbóreas (Donoso et al., 2008), sendo que os resultados desta interação poderão otimizar a produção de mudas para os mais diversos interesses, através do controlo biológico de fungos associados aos diásporos e da promoção da germinação das sementes.
Isolados de Trichoderma spp. têm sido estudados por produzirem uma série de enzimas extracelulares (Menezes e Souza, 1995). Estão neste caso as que degradam celulose e quitina, que são utilizadas no antagonismo contra fungos patogênicos, por degradarem paredes de células fúngicas (Harman et al., 2004a) e por serem ativos na produção de metabólitos com atividade microbiana (Melo, 1991). Estes metabólitos produzidos podem ser voláteis e não-voláteis (Bastos, 1991), sendo a técnica do papel celofane utilizada para selecionar agentes biocontroladores de fungos patogênicos, produtores de metabólitos não-voláteis (Ethur et al., 2005; Silva, 1997).
Neste estudo, a técnica do papel celofane é apresentada como uma técnica nova para avaliar o efeito de metabólitos produzidos por agentes biocontroladores no controlo do desenvolvimento de fungos contaminantes associados às sementes, já que não foram encontrados registros da sua utilização para este fim. Assim, este trabalho teve como objetivo avaliar o antagonismo e o efeito de isolados e produtos biológicos à base de Trichoderma spp. no controlo, in vitro, dos fungos presentes nos diásporos de G. polymorpha pela técnica modificada do papel celofane.
Material e Métodos
Foram coletados ramos com infrutescências de G. polymorpha em janeiro de 2011, em uma população natural, no Distrito Boca do Monte, Santa Maria – RS, Brasil (29° 41 43,311S 53° 48 41,041O). As infrutescências secaram quatro dias a temperatura ambiente e após foi realizada a extração manual dos frutos (diásporos). Uma exsicata foi incorporada ao herbário do Departamento de Biologia do Centro de Ciências Naturais e Exatas da Universidade Federal de Santa Maria, sob o número de registro SMDB – 13.139.
As experiências foram realizadas no Laboratório de Interação Planta-Microrganismos/CCNE/UFSM. Foram utilizados dois isolados de Trichoderma viride, TSM1 e TSM2, dois isolados de Trichoderma harzianum, 2B2 e 2B22, que estavam armazenados no mesmo laboratório, além de dois produtos comerciais à base de trichoderma, Agrotrich® e Trichodermil®, que foram adquiridos junto dos respectivos fabricantes.
O teor de água dos diásporos foi determinado pelo método de estufa a alta temperatura (Brasil, 2009). Utilizaram-se quatro amostras de 1 g de diásporos, colocados em estufa à temperatura de 105ºC, com oscilações de ± 3ºC, durante um período de 24 horas. Os resultados foram expressos em percentagem com base no peso úmido.
Antagonismo in vitro de trichoderma a fungos isolados dos diásporos de G. polymorpha
Com a técnica in vitro de confrontação direta foi observada a ação dos isolados de trichoderma no antagonismo aos fungos Bipolaris sp., Alternaria sp., Cladosporium sp. e Phoma sp., isolados previamente dos diásporos de G. polymorpha, mais quatro tratamentos testemunha, contendo somente os fungos contaminantes.
Para isso, um disco de meio de cultura BDA (batata, dextrose e ágar), de 16 mm, contendo micélio e esporos dos fungos contaminantes foi transferido para placas de Petri (9 cm de diâmetro), que continham meio de cultura BDA, a 1 cm da borda. O material foi incubado durante 48 horas, a 25°C com fotoperíodo de 12 horas. Decorrido esse período, um disco de BDA, de 16 mm de diâmetro, com estruturas dos antagonistas foi transferido para as placas em posição oposta ao disco de micélio do patógeno. As placas foram mantidas em câmara climática do tipo Biosystem Organized Development (BOD) durante oito dias a 25°C, com fotoperíodo de 12 horas.
A avaliação foi realizada no oitavo dia, após a introdução dos antagonistas, baseada no critério de Bell et al. (1982), que adota uma escala de notas variando de 1 a 5. Critérios de avaliação: 1- antagonista cresce por toda a placa de Petri; 2- antagonista cresce e atinge uma parte do patógeno, cresce sobre 2/3 da placa; 3- antagonista e o patógeno crescem até a metade da placa, nenhum organismo domina o outro; 4- patógeno cresce e atinge uma parte do antagonista, cresce sobre 2/3 da placa; 5- o patógeno cresce por toda a placa.
Também foi realizada uma avaliação aos 11 dias após a introdução do antagonista, a fim de se observar aqueles isolados que não apresentaram bom desempenho (notas entre 1 e 1,5) em oito dias. Foram avaliados 28 tratamentos dispostos no delineamento inteiramente casualizado, com quatro repetições por tratamento.
Trichoderma no controlo da contaminação dos diásporos e na germinação in vitro das sementes de G. polymorpha
Este ensaio foi realizado utilizando-se a técnica in vitro do papel celofane, de Ethur et al. (2005), modificada neste trabalho, para ser empregada na avaliação do controlo da contaminação fúngica dos diásporos de G. polymorpha por isolados de trichoderma. Também foi avaliada a percentagem de germinação in vitro das sementes. Foram utilizados quatro isolados de trichoderma, sendo TSM1 e TSM2 de T. viride; 2B2 e 2B22 de T. harzianum, e os dois produtos comerciais, Trichodermil® e Agrotrich®, além dos tratamentos controlo, sem isolados de trichoderma.
O meio de cultura utilizado foi uma mistura de meio de cultura ágar-água e meio de cultura BD, sendo 70% ágar-água e 30% BD (batata e dextrose – 200 g de batata, 20 g de dextrose, 1000 mL de água destilada). Utilizou-se ágar 0,7% e pH ajustado a 5,8 + 0,2 em placas de Petri (9 cm de diâmetro). O meio de cultura foi coberto, assepticamente, com um disco de papel celofane semipermeável, esterilizado (120°C/40 minutos) e, para cima do papel celofane, no centro das placas, foram transferidos discos de 16 mm de meio de cultura à base de aveia (40 g de aveia, 20 g de ágar e 1000 mL de água destilada) contendo micélios e esporos dos isolados de trichoderma. As placas dos tratamentos controlo foram cobertas com o disco de papel celofane, mas não receberam o disco de micélio e esporos dos isolados. As placas foram vedadas com filme de PVC e as culturas mantidas em câmara climática do tipo BOD a 25°C e fotoperíodo de 12 horas por cinco dias.
Decorrido o período de incubação, em condições assépticas, as placas de Petri foram abertas e foi retirado o papel celofane juntamente com os discos de micélios e esporos, permanecendo no meio de cultura apenas os metabólitos não-voláteis liberados pelos isolados, onde foram semeados os diásporos de G. polymorpha (Figura 1), que previamente passaram por um processo de desinfestação, que consistiu na imersão por 15 minutos em solução de hipoclorito de sódio (NaClO) 2% acrescido de duas gotas de detergente líquido e três lavagens em água destilada e autoclavada.
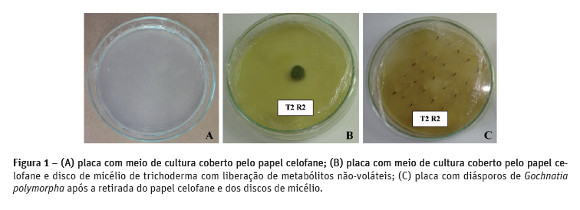
Além dos tratamentos com os isolados de trichoderma, foram avaliados quatro tratamentos controlo, sendo que em dois deles utilizou-se meio de cultura ágar-água sem BD (Quadro 1). As culturas foram mantidas a 25°C com fotoperíodo de 16 horas. As avaliações constaram da contagem dos diásporos contaminados por fungos durante sete dias e da contagem das sementes germinadas por 25 dias, contados 24 horas após a instalação do experimento.

Foram avaliados dez tratamentos dispostos no delineamento inteiramente casualizado, com oito repetições por tratamento; cada parcela experimental constituída por 25 diásporos, totalizando 200 por tratamento. Os dados em percentagem foram submetidos ao teste de Kruskal-Wallis pelo programa Action 2.2.
Resultados e Discussão
Os diásporos de G. polymorpha apresentaram teor de água de 7,23%. Resultados semelhantes foram encontrados por outros autores em espécies relacionadas. Teores entre 9 e 13% foram encontrados em diásporos de arnica (Lychnophora pinaster Mart.) (Melo et al., 2007) e 15% em camomila (Matricaria recutita L.) (Nóbrega et al., 1995), espécies pertencentes à mesma família de G. polymorpha.
Wielewicki et al., (2006), realizaram uma análise em dados de pesquisa do teor de água de sementes de 27 espécies florestais nativas do sul do Brasil e estabeleceram que 21 das espécies estudadas apresentaram comportamento ortodoxo, ou seja, as sementes são tolerantes à perda de 90 a 95% de água durante o desenvolvimento e à dessecação (Castro et al., 2004); e teor de água médio entre 6,6 e 19,8%. Nesse sentido, os resultados encontrados no presente estudo permitem sugerir que os diásporos de G. polymorpha são ortodoxos e o grau de umidade obtido está de acordo com a média encontrada em espécies relacionadas.
Antagonismo in vitro de trichoderma a fungos isolados dos diásporos de G. polymorpha
No pareamento de culturas, avaliou-se a ação dos isolados antagonistas, após oito e 11 dias da incorporação destes. Os seis tratamentos com trichoderma demonstraram resultados variados no confronto in vitro com os fungos testados (Quadro 2).
Aos oito dias do teste, o isolado 2B22 e o produto Agrotrich® apresentaram ótimo desempenho no confronto aos quatro patógenos testados, obtendo notas entre 1 e 1,5 (Figura 2). Os isolados TSM1 e TSM2 também apresentaram ótimo desempenho no confronto com Alternaria sp., Cladosporium sp. e Phoma sp., com nota 1 em todos os tratamentos, mas não com Bipolaris sp., que obtiveram notas de 2 e 2,5, respectivamente. O isolado 2B2, aos oito dias, só obteve bom desempenho no confronto com Alternaria sp. e Cladosporium sp., com notas 1 para cada fungo contaminante.
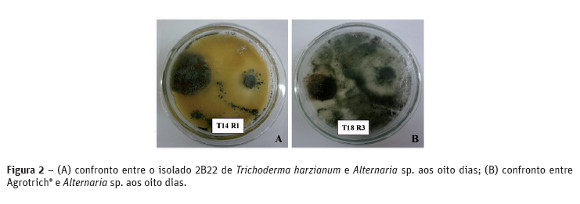
Na segunda avaliação, realizada após 11 dias da incorporação do antagonista, observou-se que os isolados TSM1, TSM2 e 2B2 melhoraram seus desempenhos no confronto com Bipolaris sp., obtendo notas de 1,5; 1 e 1, respectivamente. O isolado 2B2, mesmo aos 11 dias, não foi tão eficiente no confronto com Phoma sp., obtendo uma nota média de 1,75. O produto comercial Trichodermil® obteve bom desempenho (nota 1,5) aos 11 dias do teste no confronto com Alternaria sp.
Os isolados de trichoderma demonstraram que possuem outras habilidades como agentes de biocontrolo além da antibiose. A antibiose é definida como a interação na qual um ou mais metabólitos produzidos por um organismo têm efeito danoso sobre o outro (Stadnik e Bettiol, 2000), no entanto, segundo Bettiol (1991), uma característica recomendável, é que o antagonista aja através de mais de um mecanismo, combinando antibiose, parasitismo, competição e estímulo à defesa do hospedeiro.
No presente estudo, possivelmente ocorreu antibiose, hiperparasitismo e competição. De acordo com Melo (1998), no ponto de encontro entre os dois micélios possivelmente ocorre antibiose e parasitismo, uma vez que trichoderma pode detectar e localizar hifas de fungos suscetíveis, crescendo em sua direção. Além disso, segundo Howell (2003), espécies de trichoderma são hábeis na supressão do crescimento de vários fungos em meios de cultura contendo ágar, como observado no tratamento de segmentos de raízes de feijoeiro infectadas com Macrophomina phaseolina e com T. virens, onde se observou que quando os segmentos foram plaqueados em meio com ágar, apenas T. virens cresceu a partir das raízes.
Os organismos competem entre si para obter nutrientes, água, luz, espaço, fatores de crescimento, oxigênio, entre outros, sendo a competição um dos clássicos mecanismos de biocontrolo (Melo, 1996). Assim, o potencial hiperparasítico de trichoderma está relacionado com a competição por espaço e com atividades metabólicas que lhes permitem serem eficientes no hiperparasitismo das estruturas de outros fungos (Harman, 2000). Contudo, os mecanismos de ação são características de cepas específicas, o que possivelmente explica as diferenças observadas no desempenho dos isolados.
Trichoderma no controlo da contaminação dos diásporos e na germinação in vitro das sementes de G. polymorpha
A técnica do papel celofane é utilizada na seleção de microrganismos antagonistas produtores de compostos antifúngicos, como substâncias antibióticas ou metabólitos (Reis et al., 1995). A liberação de metabólitos não-voláteis e inibição no crescimento de fitopatógenos foram observadas por Silva (1997), que utilizou esse método e constatou que isolados de T. viride e T. harzianum foram efetivos quanto à inibição do crescimento micelial de Sclerotinia sclerotiorum, um fungo causador de doenças. Ethur et al. (2005), também utilizaram essa técnica com o objetivo de selecionar agentes biocontroladores para esse mesmo patógeno.
O papel celofane, semi-permeável, permite a nutrição e crescimento do antagonista, além da difusão de metabólitos para o meio de cultura (Ethur, 2002), onde são inseridos discos contendo estruturas do patógeno. Neste experimento a técnica foi modificada, ao invés de se transferir para o meio de cultura discos do patógeno, transferiram-se os diásporos de G. polymorpha, a fim de se avaliar o efeito de metabólitos liberados por isolados de trichoderma no controlo de fungos presentes e na promoção de germinação das sementes.
Verificou-se que houve a liberação de metabólitos não-voláteis pelos isolados, através da coloração característica observada no meio de cultura (Figura 3) e das diferenças obtidas nas médias de contaminações dos diásporos nos diferentes tratamentos (Quadro 3).

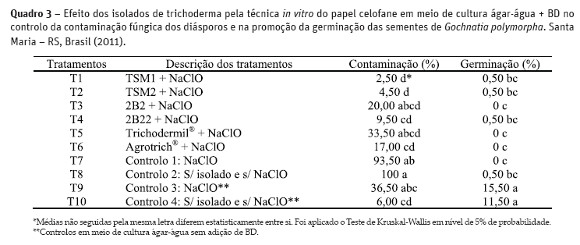
Observa-se no Quadro 3 que todos os tratamentos com trichoderma (T1 ao T6) inibiram o crescimento de fungos contaminantes, reduzindo as médias de contaminação quando comparadas às médias dos controlos 1 e 2 (T7 e T8). Embora os tratamentos com trichoderma não tenham diferido estatisticamente entre si, aqueles que apresentaram as menores médias de contaminação foram TSM1 e TSM2 de T. viride (2,5 e 4,5%, respectivamente), 2B22 de T. harzianum (9,5%) e o produto comercial Agrotrich® (17%). Os tratamentos controlo 1 e 2 obtiveram uma média de contaminação de 93,5 e 100%, respectivamente, demonstrando que na ausência dos antagonistas a contaminação foi alta.
Os controlos 3 e 4 obtiveram uma média baixa de contaminação (36,50 e 6%, respectivamente). Nestes controlos utilizou-se meio de cultura água-água sem a adição de BD e a inclusão desses, neste experimento, visou observar o comportamento dos diásporos em relação à promoção da germinação das sementes, assunto que será abordado adiante.
A diferença observada nas médias de contaminação, entre os isolados, também foi observada por Ethur (2002), porém no estudo da autora, os índices variados entre os isolados foi em relação à inibição micelial do patógeno S. sclerotiorum. Hilgemberg et al. (2007), também observaram essa variação entre os antagonistas Trichoderma spp. e Trichotecium roseum, ao crescimento micelial de fungos de solo, S. sclerotiorum, Sclerotium rolfsii, Rhizoctonia solani e Fusarium sp. Essa variabilidade na ação dos antagonistas pode estar relacionada à produção dos metabólitos. Segundo Harman (2000), muitas espécies estudadas produzem metabólitos secundários tóxicos, como antibióticos e enzimas líticas capazes de inibir e destruir propágulos de fungos fitopatogênicos. De acordo com este autor, duas linhagens de T. harzianum (T39 e NCIM1185) produzem uma protease que é capaz de degradar enzimas sintetizadas pelo patógeno Botrytis cinerea, demonstrando especificidade entre alguns isolados e o patógeno.
Neste ensaio também foi avaliado o número de sementes germinadas, a fim de se observar o efeito do trichoderma na promoção da germinação in vitro das sementes de G. polymorpha. Segundo Baugh e Escobar (2007), a ação de trichoderma como estimulador do processo germinativo e do crescimento vegetal é complexa e realizada por interações com fatores bioquímicos e produção de diversas enzimas e compostos benéficos. Entretanto, no presente estudo, não foi possível avaliar o efeito dos isolados testados sobre esse processo, pois a adição de BD ao meio de cultura possivelmente impediu a germinação das sementes, conforme observado nos resultados do Quadro 3, onde se verifica maior média apenas para os controlos 3 e 4 (15,5 e 11,5%, respectivamente), em que se utilizou meio de cultura ágar-água sem a adição de BD.
Mesmo não sendo possível avaliar o efeito dos isolados de trichoderma testados na promoção da germinação das sementes, a utilização da técnica do papel celofane modificada permitiu visualizar que os isolados apresentaram a propriedade do controlo biológico de fungos fitopatogênicos presentes nos diásporos de G. polymorpha, uma vez que, conforme Vechiato (2010), espécies dos gêneros Bipolaris, Alternaria, Cladosporium e Phoma são consideradas potencialmente patogênicas às espécies florestais, podendo, desta forma, prejudicar a germinação das sementes. Considerando esse resultado e aqueles obtidos na técnica de confrontação direta, onde todos os isolados de trichoderma, em especial o 2B22 e o produto Agrotrich®, foram eficientes no antagonismo aos quatro fungos testados, o estudo presente deixa possibilidades para a realização de outras pesquisas envolvendo a interação entre trichoderma e G. polymorpha, além de outras espécies florestais.
Conclusões
Os resultados obtidos no estudo efetuado permitem concluir que:
• O isolado 2B22 de T. harzianum e o produto comercial Agrotrich® são os mais eficientes no teste de pareamento de cultura no antagonismo a Bipolaris sp., Alternaria sp., Cladosporium sp. e Phoma sp.
• Os isolados TSM1 e TSM2 de T. viride, com exceção de Bipolaris sp., também são eficientes no antagonismo aos referidos fungos. Já o isolado 2B2 de T. harzianum apresenta eficiência somente no antagonismo a Alternaria sp. e Cladosporium sp.
• Todos os isolados de trichoderma e os dois produtos comerciais testados são eficientes no controlo da contaminação fúngica dos diásporos de Gochnatia polymorpha pela técnica in vitro modificada do papel celofane.
Agradecimentos
À CAPES [Coordenação de Aperfeiçoamento de Pessoal de Nível Superior] pelo concedimento da bolsa de mestrado à primeira autora e à professora Dra. Thais Scotti Canto-Dorow pela identificação botânica da espécie e pela contribuição nas coletas.
Referências Bibliográficas
Almança, M.A.K. (2005) - Trichoderma sp. no controle de doenças e na promoção do crescimento de plantas de arroz. Dissertação de Mestrado. Porto Alegre, Universidade Federal do Rio Grande do Sul, 81 p. [ Links ]
Altomare C.; Norvell, W.A.; Bjorkman, T. e Harman, G.E. (1999) - Solubilization of phosphates and micronutrients by the plant-growth-promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22. Applied and Environmental Microbiology, 65, 7: 2926-2933. [ Links ]
Backes, P. e Irgang, B.E. (2002) - Árvores do Sul: guia de identificação e interesse ecológico. Pallotti, Instituto Souza Cruz, p. 70. [ Links ]
Bastos, C.N. (1991) - Possibilidade do controle biológico da vassoura-de-bruxa (Crinipellis perniciosa) do cacaueiro. In: Bettiol, W. (Ed.) - Controle biológico de doenças de plantas. Jaguariúna, Embrapa-CNPDA, p.333-344. [ Links ]
Baugh, C.L. e Escobar, C.L.B. (2007) - The genus Bacillus and genus Trichoderma for agricultural bio-augmentation. Rice Farm Magazine, Feb. [ Links ]
Bell, D.K.; Wells, H.D. e Markham, C.R. (1982) - Invitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology, 72, 4: 379-382. [ Links ]
Benítez, T.; Rincón, A.M.; Limón, M.C. e Codón, A.C. (2004) - Biocontrol mechanisms of Trichoderma strains. International Microbiology, 7, 4: 249-260. [ Links ]
Bettiol, W. (1991) - Componentes do controle biológico de doenças de plantas. In: Bettiol, W. (Ed.) - Controle biológico de doenças de plantas. Jaguariúna, Embrapa-CNPDA, p.1-5. (Boletim Técnico 5). [ Links ]
Brasil, Ministério da Agricultura, Pecuária e Abastecimento (2009) - Regras para análise de sementes. Brasília, Ministério da Agricultura, Pecuária e Abastecimento. [ Links ]
Caldas, L.S. (2006) - Pomares de sementes de espécies nativas as funções das redes de sementes. In: Higa, A.R. e Silva, L.D. (Ed.) - Pomar de sementes de espécies florestais nativas. Curitiba, Fundação de Pesquisas Florestais do Paraná (FUPEF), p. 227–241. [ Links ]
Carneiro J.S. (1987) - Testes de sanidade de sementes de essências florestais. In: Soave, J. e Wetzel, M.M.V. da S. Patologia de sementes. Campinas, Fundação Cargill, p. 386-394. [ Links ]
Carvalho-Filho, M.R.; Mello, S.C.M. de; Santos, R.P. dos; e Menêzes, J.E. (2008) - Avaliação de isolados de Trichoderma na promoção de crescimento, produção de ácido indolacético in vitro e colonização endofítica de mudas de eucalipto. Brasília, Embrapa Recursos Genéticos e Biotecnologia, 15 p. (Boletim de Pesquisa e Desenvolvimento 226). [ Links ]
Carvalho, P.E.R. (1994) - Espécies florestais brasileiras: recomendações silviculturais, potencialidades e uso da madeira. Colombo-PR e Brasília, Embrapa-CNPF e Embrapa-SPI, 640 p. [ Links ]
Carvalho, P.E.R. (2003) - Espécies arbóreas brasileiras. v. 1. Brasília e Colombo-PR, Embrapa Informação Tecnológica e Embrapa Florestas, 1039 p. [ Links ]
Castro, R.D.; Bradford, K.J. e Hilhorst, H.W.M. (2004) – Desenvolvimento de sementes e conteúdo de água. In: Ferreira, A.G. e Borghetti, F. (Ed.) - Germinação: do básico ao aplicado. Porto Alegre, Artmed, p. 51-67. [ Links ]
Delgado, G.V.; Martins, I.; Menêzes, J.E.; Macedo, M.A. e Mello, S.C.M. (2007) - Inibição do crescimento de Sclerotinia sclerotiorum por Trichoderma spp. in vitro. Brasília, Embrapa Recursos Genéticos e Biotecnologia, 12 p. (Boletim de Pesquisa e Desenvolvimento 214). [ Links ]
Donoso, E.; Lobos, G.A. e Rojas, N. (2008) - Efecto de Trichoderma harzianum y compost sobre el crecimiento de plántulas de Pinus radiata em viveiro. Bosque (Valdivia), 29, 1: 52-57. [ Links ]
Ethur, L.Z. (2002) - Avaliação de fungos como antagonistas para o biocontrole de Sclerotinia sclerotiorum (Lib.) de Bary em pepineiro cultivado em estufa. Dissertação de Mestrado. Santa Maria, Brasil, Universidade Federal de Santa Maria, 155 p. [ Links ]
Ethur, L.Z.; Blume, E.; Muniz, M.; Silva, A.C.F. da; Stefanelo, D.R. e Rocha, E.K. da. (2005) - Fungos antagonistas a Sclerotinia sclerotiorum em pepineiro cultivado em estufa. Fitopatologia Brasileira, 30, 2: 127-133. [ Links ]
Figliolia, M.B.; Piña-Rodrigues, F.C.M. e Nogueira, E.de S. (2007) – Controle de qualidade de sementes florestais: propostas de parâmetros técnicos. In: Piña-Rodrigues, F.C.M. (Ed.) - Parâmetros técnicos para produção de sementes florestais. Seropédica, Brasil, Editora da Universidade Federal Rural do Rio de Janeiro (EDUR), p. 143-187. [ Links ]
Glufke, C. (1999) - Espécies florestais recomendadas para recuperação de áreas degradadas. Porto Alegre, Fundação Zoobotânica do Rio Grande do Sul, 48 p. [ Links ]
Gravel, V.; Antoun, H. e Tweddell, R.J. (2007) - Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation with Pseudomonas putida or Trichoderma atroviride: possible role of indole acetic acid (IAA). Soil Biology and Biochemistry, 39, 8: 1968–1977. [ Links ]
Harman, G.E.; Howell, C.R.; Viterbo, A.; Chet, I. e Lorito, M. (2004a) - Trichoderma species – Opportunistic, avirulent plant symbionts. Nature Reviews Microbiology, 2, 1: 43–56. [ Links ]
Harman, G.E.; Petzoldt, R.; Comis, A. e Chen, J. (2004b) - Interactions between Trichoderma harzianum Strain T22 and maize inbred line Mo17 and effects of these interactions on diseases caused by Pythium ultimum and Colletotrichum graminicola. Phytopathology, 94, 2: 146-153. [ Links ]
Harman, G.E. (2000) - Myths and dogmas of biocontrol. Changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease, 84, 4: 377–393. [ Links ]
Hilgemberg, P.; Dalla Pria, M.; Duda, L.; Sandini, F. e Kamikoga, A. (2007) - Antagonismo de Trichoderma spp. e Trichotecium roseum a fungos de solo. Fitopatologia Brasileira, 32, suplemento, p.121. [ Links ]
Howell, C.R. (2003) - Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts. Plant Disease, 87, 1: 4-10. [ Links ]
Hoyos-Carvajal, L.; Orduz, S. e Bissett, J. (2009) - Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma. Biological Control, 51, 3: 409–416. [ Links ]
Jyotsna; Srivastava, A.; Singh, R.P.; Srivastava, A.K.; Saxena, A.K. e Arora, D.K. (2008) - Growth promotion and charcoal rot management in chickpea by Trichoderma harzianum. Journal of Plant Protection Research, 48, 1: 81-92. [ Links ]
Kruger, T.L. e Bacchi, L.M.A. (1995) - Fungos. In: Filho, A.B. (Ed.) - Manual de Fitopatologia. 3.ª ed. São Paulo, Agronômica Ceres, p. 46–95. [ Links ]
Kunieda-Alonso, S.; Alfenas, A.C. e Maffia, L.A. (2005) - Sobrevivência de micélio e escleródios de Rhizoctonia solani tratados com Trichoderma spp., em restos de cultura de Eucalyptus sp. Fitopatologia Brasileira, 30, 2: 164-168. [ Links ]
Louzada, G.A.S.; Carvalho, D.D.C.; Mello, S.C.M.; Júnior, M.L.; Martins, I. e Braúna, L.M. (2009) - Potencial antagônico de Trichoderma spp. originários de diferentes ecossistemas contra Sclerotinia scleotiorum e Fusarium solani. Biota neotropica, 9, 3: 145–149. [ Links ]
Lopes, R.B. (2009) - A indústria no controle biológico: produção e comercialização de microrganismos no Brasil. In: Bettiol, W. e Morandi, M.A.B. (Ed.) - Biocontrole de doenças de plantas: uso e perspectivas. Jaguariúna, Embrapa Meio Ambiente, p.15-28. [ Links ]
Lorenzi, H. (1998) - Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. 2.ª ed. Nova Odessa, SP, Editora Plantarum, 89 p. [ Links ]
Lorza, R.F.; Souza, F.M. de; e Nakashima, R. (2006) - Pomares de sementes de espécies nativas – situação atual. In: Higa, A.R. e Silva, L.D. - Pomar de sementes de espécies florestais nativas, Curitiba, Fundação de Pesquisas Florestais do Paraná (FUPEF), p. 41-64. [ Links ]
Luz, W.C. da. (2001) - Efeito de bioprotetores em patógenos de sementes e na emergência e rendimento de grãos de milho. Fitopatologia Brasileira, 26, 1: 16-20. [ Links ]
Melo, I.S. (1991) – Potencialidades de utilização de Trichoderma spp. no controle biológico de doenças de plantas. In: Bettiol, W. (Ed.) - Controle biológico de doenças de plantas. Jaguariúna, Embrapa-CNPDA, p. 135-156. [ Links ]
Melo, I.S. de. (1996) - Trichoderma e Gliocladium como bioprotetores de plantas. Revisão Anual de Patologia de Plantas, 4: 261-295. [ Links ]
Melo, I.S. de. (1998) - Agentes microbianos de controle de fungos fitopatogênicos. In: Melo, I.S. de. e Azevedo, J.L. de. (Ed.) - Controle biológico. vol.1. Jaguariúna, Embrapa Meio Ambiente, p. 17–60. [ Links ]
Melo, P.R.B.; Oliveira, J.A.; Pinto, J.E.B.P.; Castro, E.M.; Vieira, A.R. e Evangelista, J.R.E. (2007) - Germinação de aquênios de arnica (Lychnophora pinaster Mart.) armazenados em diferentes condições. Ciência e Agrotecnologia, 31, 1, 75-82. [ Links ]
Menezes, M. e Souza, E.E.B. (1995) – Avaliação de isolados de Trichoderma através da análise eletroforética em gel de poliacrilamida. Fitopatologia Brasileira, 20, suplemento, p.308. [ Links ]
Nóbrega, L.H.P.; Corrêa Junior, C.; Rodrigues, T.J.D. e Carregari, S.M. (1995) – Efeito da luz e da temperatura na germinação de sementes de camomila (Matricaria recutita). Revista Brasileira de Sementes, 17, 2: 137-140. [ Links ]
Piña-Rodrigues, F.C. .; Freire, J.M. e Silva, L.D. (2007) - Parâmetros genéticos para colheita de sementes de espécies florestais. In: Piña-Rodrigues, F.C.M. (Ed.) - Parâmetros Técnicos para Produção de Sementes Florestais. Seropédica, Brasil, Editora da Universidade Federal Rural do Rio de Janeiro (EDUR),. p. 51–102. [ Links ]
Reis, A; Oliveira, S.M.A. e Menezes, M. (1995) - Potencial de isolados de Trichoderma para biocontrole da murcha de Fusarium do feijoeiro. Summa Phytopathologica, 21: 16-20. [ Links ]
Resende, M. de L.; Oliveira, J.A. de; Guimarães, R.M.; Pinho, R.G.V. e Vieira, A.R. (2004) - Inoculações de sementes de milho utilizando o Trichoderma harzianum como promotor de crescimento. Ciência e Agrotecnologia, 28, 4: 793-798. [ Links ]
Silva, A.C.F. da (1997) - Uso da radiação gama para obtenção de mutantes de Trichoderma harzianum Rifai e Trichoderma viride Pers.: Fr. com capacidade melhorada no controle ao Sclerotinia sclerotiorum (Lib.) de Bary. Tese de doutorado. Pracicaba, Universidade de São Paulo, Centro de Energia Nuclear na Agricultura/CENA), 143 p. [ Links ]
Silva, L.D. e Higa, A.R. (2006) - Planejamento e implantação de pomares de sementes de espécies florestais nativas. In: Higa, A.R. e Silva, L.D. (Ed.) - Pomar de sementes de espécies florestais nativas. Curitiba, FUPEF, p. 13–39. [ Links ]
Souza-Junior L.; Wendling, I.; Cunha, A.C.M.C.M. da; Rosa, L.S.da e Quoirin, M. (2005) - Substratos e planta matriz na sobrevivência e crescimento de mudas de cambará. Colombo-PR, Embrapa Florestas. (Comunicado Técnico 148). [ Links ]
Stadnik, M.J. e Bettiol, W. (2000) - Controle biológico de oídeos. In: Melo, I.S. de e Azevedo, J.L. de (Ed.) - Controle biológico. v.3. Jaguariúna, Embrapa Meio Ambiente, p. 95–112. [ Links ]
Stefanello, M.E.A.; Salvador, M.J.; Ito, I.Y. e Macari, P.A.T. (2006) - Avaliação da atividade antimicrobiana e citotóxica de extratos de Gochnatia polymorpha ssp. floccosa. Revista Brasileira de Farmacognosia, 16, 4:525–530. [ Links ]
Vechiato, M.H. (2010) - Importância da qualidade sanitária de sementes de florestais na produção de mudas (em linha). (Acesso em 2011.05.24). Disponível em: http://www.infobibos.com/Artigos/2010_3/SementesFlorestais/index.htm . [ Links ]
Yedidia, I.; Srivastva, A.K.; Kapulnik, Y. e Chet, I. (2001) - Effect of Trichoderma harzianum on microelement concentrations and increased growth of cucumber plants. Plant and Soil, 235, 2: 235–242. [ Links ]
Recebido/Received: 2012.08.20
Aceitação/Accepted: 2013.01.25














