Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer vol.25 no.4 Porto dez. 2016
ARTIGOS DE REVISÃO | REVIEW ARTICLES
Síndrome do Ovário Poliquístico na adolescência
Polycystic Ovary Syndrome in adolescence
Diana BaptistaI; Maria João VieiraI; Carla MeirelesI
I S. de Pediatria do Hospital Senhora da Oliveira, Guimarães. Rua dos Cutileiros, Creixomil. 4835-044 Guimarães. dianbaptista@hotmail.com; mjavieira@gmail.com; csmeireles@gmail.com
Endereço para correspondência
RESUMO
Introdução: A Síndrome do Ovário Poliquístico é a endocrinopatia mais frequente nas mulheres em idade reprodutiva. As manifestações começam habitualmente durante a adolescência; porém o diagnóstico nesta faixa etária é dificultado pela sobreposição das características da síndrome e os achados fisiológicos observados durante a progressão normal da puberdade.
Objetivos: Rever a abordagem diagnóstica e terapêutica da Síndrome do Ovário Poliquístico na adolescência.
Desenvolvimento: Não existem critérios de diagnóstico ou orientações terapêuticas consensuais para a Síndrome do Ovário Poliquístico na população pediátrica. Por outro lado, algumas das manifestações da síndrome, como a acne, irregularidades menstruais e hiperinsulinemia, são achados normais durante a puberdade. A maioria dos autores sugere um diagnóstico baseado na evidência clínica e/ou laboratorial de hiperandrogenismo associada a disfunção ovárica, não explicada por outras etiologias. O doseamento sérico da testosterona livre é o método mais sensível e fiável para a documentação do hiperandrogenismo bioquímico. Já a visualização ecográfica dos ovários poliquísticos, não estabelece o diagnóstico, pois trata-se de um achado frequente em adolescentes saudáveis. A abordagem terapêutica assenta essencialmente na mudança do estilo de vida e no tratamento do hirsutismo/irregularidades menstruais.
Conclusões: A identificação das adolescentes em risco para o desenvolvimento da Síndrome do Ovário Poliquístico é fundamental. Para além de uma abordagem terapêutica adequada, é primordial prevenir as co morbilidades associadas à síndrome, entre elas a obesidade, insulinorresistência, dislipidemia e infertilidade.
Palavras-chave: adolescência, hiperandrogenismo, hirsutismo, Síndrome do Ovário Poliquístico
ABSTRACT
Introduction: Polycystic Ovary Syndrome is recognized as the most common endocrine disorder of reproductive-age women. The syndrome often presents during adolescence, but the diagnosis in this age group is complicated by the overlap between features of the syndrome and physiologic findings observed during the normal progression of puberty.
Objective: To review the diagnosis and treatment of Polycystic Ovary Syndrome in adolescence.
Development: There are no consensual diagnostic criteria or treatment guidelines for Polycystic Ovary Syndrome in pediatric population. Many features of the syndrome, including acne, menstrual irregularities and hyperinsulinemia, are common in normal puberty. Most authors recommend a diagnosis based on clinical and/or biochemical evidence of hyperandrogenism with ovarian dysfunction, not explained by other causes. Measurement of free testosterone level is the more sensitive and reliable method for establishing the existence of androgen excess. Ultrasonographic visualization of polycystic ovary doesnt set the diagnosis, because its a frequent finding in healthy adolescents. Lifestyle changes and treatment of hirsutism and menstrual irregularities are essential hallmarks in the therapeutic approach of Polycystic Ovary Syndrome in adolescents.
Conclusion: Identification of adolescents at risk for Polycystic Ovary Syndrome is critical, not only for an appropriate therapeutic approach, but also to prevent co-morbidities associated with the syndrome, including obesity, insulin resistance, dyslipidemia and infertility.
Keywords: adolescence, hyperandrogenism, hirsutism, Polycystic Ovary Syndrome
INTRODUÇÃO
A coexistência de hirsutismo, disfunção ovárica, infertilidade e aumento do volume dos ovários, foi descrita pela primeira vez em 1935 por Stein and Leventhal, tendo sido chamada de Síndrome de Stein-Leventhal até 1960 quando se começou a usar o termo Síndrome do ovário poliquístico (SOP).1
A sua prevalência varia entre 1,8 a 15% consoante a etnicidade e os critérios de diagnóstico utilizados.2
As manifestações da SOP começam habitualmente durante a adolescência. Contudo, o diagnóstico nesta faixa etária é dificultado pela sobreposição das características da síndrome e os achados fisiológicos observados durante a progressão normal da puberdade. Assim, o diagnóstico de SOP na população pediátrica é controverso e difícil, dada a ausência de critérios de diagnóstico universalmente aceites.3
Por outro lado, a identificação das adolescentes em risco para o desenvolvimento da SOP torna-se pertinente, no sentido de instituir uma intervenção precoce que contribua para travar as morbilidades associadas à síndrome, entre elas a obesidade, insulinorresistência e dislipidemia.3
OBJETIVOS
Revisão sobre a Síndrome do Ovário Poliquístico na adolescência, sua abordagem diagnóstica e estratégias terapêuticas atuais.
DESENVOLVIMENTO
Foram sugeridos três grupos distintos de critérios diagnósticos para a SOP nos adultos.
Os critérios de diagnóstico definidos na conferência do National Institute of Health (NIH) em 1990, incluem a irregularidade menstrual (anovulação crónica ou oligoamenorreia), assim como a evidência clínica e/ou bioquímica de hiperandrogenismo, inexplicados por outras causas.4
Em 2003, a European Society of Human Reproduction and Embryology (ESHRE) e a American Society for Reproductive Medicine (ASRM) definiram os Rotterdam consensus criteria, que exigem dois dos três critérios: disfunção ovárica, evidência clínica e/ou bioquímica de hiperandrogenismo e/ou ovários poliquísticos por avaliação ecográfica.5
Em 2009, a Androgen Excess and POCS Society (AES) definiu SOP como um estado de hiperandrogenismo com disfunção ovulatória e/ou ovários poliquísticos.6
Mais recentemente, o National Institute of Health (NIH) Evidence-Based Methodology Workshop on PCOS recomendou o uso dos critérios de 2003 de Rotterdam, com a identificação de fenótipos específicos no diagnóstico.7
Atualmente, e apesar de ainda não existir consenso universal sobre a definição de SOP na adolescência, os critérios mais utilizados são os do NIH. Esta abordagem é consistente com as guidelines da Endocrine Society que propõem um diagnóstico baseado na oligomenorreia persistente associada a evidência clínica ou laboratorial de hiperandrogenismo (após exclusão de outras causas).8
Contudo, alguns autores destacam a complexidade diagnóstica durante a adolescência, defendendo uma atitude mais expectante que evite diagnósticos errados e excessivos.9
De facto, a puberdade mimetiza os sinais e sintomas observados na SOP. Nesta fase, ocorre uma elevação fisiológica dos níveis de androgénios secretados pela glândula supra-renal que contribuem para o desenvolvimento da pilosidade púbica. Assim, o hiperandrogenismo clínico patológico, evidente sobretudo pelo hirsutismo e acne, não é fácil de valorizar na adolescência. Para além disso, não existe consenso sobre que valores de referência utilizar no doseamento de androgénios neste grupo etário. Outra dificuldade que se levanta, prende-se com o diagnóstico de disfunção ovulatória, uma vez que a irregularidade menstrual é um achado muito comum nos primeiros três anos após a menarca. Já a identificação ecográfica de ovários poliquísticos, ainda não perfeitamente definida na população adolescente, é comum em adolescentes saudáveis.3,9,10
Fisiopatologia
A etiologia da SOP é complexa e ainda não completamente conhecida. Parece estar relacionada com um distúrbio intrínseco da regulação ovárica que leva a um aumento da produção de androgénios em resposta à hormona luteinizante (LH). Por outro lado, a-se um defeito semelhante na resposta androgénica da supra-renal à hormona adrenocorticotrópica (ACTH).11
Existe um padrão de pulsatilidade anormal das gonadotrofinas, com secreção excessiva de LH e normal de FSH, com consequente aumento da relação LH/FSH, sugerindo um defeito no eixo hipotálamo-hipófise. O excesso de androgénios circulantes, parece, por sua vez, estar relacionado com as alterações morfológicas dos ovários, induzindo os ovários poliquísticos.10,11 A resistência à insulina com hiperinsulinemia compensatória leva à estimulação direta da secreção de androgénio adrenal e ovárico, assim como a uma diminuição da síntese hepática de globulina transportadora de hormonas sexuais (SHBG) e, por conseguinte, a um aumento da biodisponibilidade dos níveis de testosterona livre. O hiperandrogenismo hiperinsulínico aumenta o risco cardiovascular a médio e longo prazo contribuindo para o desenvolvimento de anomalias do metabolismo da glicose e Diabetes Mellitus tipo 2 (DM2), obesidade e a hiperlipidemia.2,11 Assim, a SOP parece resultar de fatores ováricos intrínsecos, com provável etiologia poligénica, que se manifestam apenas quando interagem com outros fatores congénitos ou ambientais, sendo a obesidade o fator precipitante mais comum.11
Clínica
Manifestações cutâneas de hiperandrogenismo
Hirsutismo
Definido pela presença de pelo terminal na mulher em áreas de distribuição masculina, é reconhecido como o marcador clínico mais fiável de SOP.13
Nesta síndrome, o hirsutismo tem habitualmente um inicio gradual e intensifica-se com o ganho ponderal.14
É classificado com base no Score de Ferriman e Gallwey (1961) que quantifica o crescimento de pelo em nove zonas sensíveis à ação dos androgénios (Figura 1). Assim, hirsutismo é definido por um score final superior ou igual a 8, sendo que existem variabilidades étnicas a considerar (por exemplo, a pontuação normal é menor em populações asiáticas).15
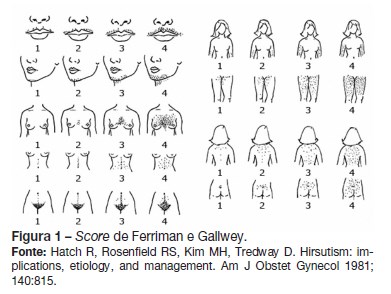
Contudo, há quem defenda que, devido ao menor tempo de exposição aos andrógenios, este cut-off possa ter que ser adaptado à população pediátrica.3
Acne
A acne que surge precocemente, é grave e persistente e não apresenta resposta à terapêutica dermatológica de primeira linha deve fazer suspeitar de hiperandrogenismo.10
Outros
Alopécia androgénica (manifestação rara nos adolescentes), seborreia, hiperhidrose e hidradenite supurativa. O rápido aparecimento e progressão do hirsutismo associado a evidência de virilização deve fazer suspeitar de neoplasia produtora de androgénios, uma vez que é pouco comum na SOP.10
Irregularidades menstruais
As irregularidades menstruais são uma característica comum de SOP nas adolescentes e estão incluídas em todos os critérios diagnósticos nos adultos. Contudo, como já referido, são frequentes em adolescentes saudáveis, tornando a sua utilização, difícil como critério neste grupo etário.3
Com efeito, devido à imaturidade do eixo hipotálamo-hipófise-ovário, os ciclos menstruais irregulares são um achado frequente nos dois/três anos após a menarca. Se as alterações persistirem após esse período, maior é a probabilidade de disfunção ovárica subjacente.14
A infertilidade é a principal implicação clínica da disfunção ovárica na SOP. A hiperplasia e neoplasia do endométrio são também riscos a considerar.14
As seguintes irregularidades sugerem ciclos menstruais anormais na população adolescente:
Amenorreia primária: ausência de menarca aos 15 anos ou mais de três anos após o início do desenvolvimento mamário;
Amenorreia secundária: ausência de cataménio por um período superior a 90 dias;
Oligomenorreia: interlúnios superiores a 45 dias;
Hemorragia uterina anormal: hemorragia a intervalos inferiores a 21 dias ou hemorragia excessiva (mais do que sete dias ou impressão de maior quantidade que o normal).16,17
As irregularidades menstruais mais graves parecem estar associadas a fenótipos de SOP mais severos com níveis de androgénios mais elevados.5
Obesidade, Insulinorresistência e Síndrome metabólico
A SOP está associada a distúrbios metabólicos como insulinorresistência e hiperinsulinismo, intolerância à glicose, risco aumentado de DM2, obesidade, esteatose hepática, síndrome metabólica e doença cardiovascular. Os mecanismos moleculares responsáveis por esta interação não são ainda completamente compreendidos.3,18 Embora não façam parte dos critérios diagnósticos da síndrome, segundo a Endocrine Society devem ser sempre considerados dadas as implicações e riscos a longo prazo.18
A obesidade, sobretudo central, é muito comum nas adolescentes com SOP, estimando-se uma prevalência superior a 60%.19 Ainda não é claro se a SOP predispõe as adolescentes à obesidade ou se esta agrava a síndrome.3
A síndrome metabólica foi definida em 2007 pela International Diabetes Federation. A presença de obesidade central (definida de acordo com percentis para a idade) associada a dois dos seguintes critérios: elevação dos triglicerídeos, da glicose em jejum, da tensão arterial ou colesterol HDL baixo, estabelece o diagnóstico entre os dez e os 16 anos. Acima desta idade, aplicam-se os mesmos critérios dos adultos.20
A prevalência de síndrome metabólica é maior em adolescentes com SOP do que na população geral, estimando-se que ocorra em aproximadamente 25% das adolescentes.10
Distúrbios psiquiátricos
Estudos recentes têm vindo a demonstrar uma maior prevalência de patologia psiquiátrica, tal como ansiedade, depressão e distúrbios do sono, em adultos e adolescentes com SOP.8, 21
Diagnóstico Diferencial
Embora a SOP seja responsável por cerca de 85% dos casos de hiperandrogenismo nas adolescentes, existem muitas outras condições a excluir.10
No quadro 1, constam os principais diagnósticos diferenciais da SOP.

A Hiperplasia Congénita da Supra-renal (HCSR), forma não clássica, é a segunda causa mais comum de hiperandrogenismo na adolescência, sendo responsável por cerca de 2,5 a 5% dos casos.22 Resulta da deficiência ligeira da enzima 21-hidroxilase, que condiciona um hiperandrogenismo moderado. Pode apresentar-se sob a forma de pubarca precoce, hirsutismo na adolescência e/ou sintomas de anovulação. É possível observar ovários poliquísticos e valores de LH aumentados. O diagnóstico é fortemente sugerido pela presença de níveis séricos de 17-hidroxiprogesterona elevados.10
Abordagem diagnóstica
Os objetivos na abordagem da adolescente com suspeita de SOP são documentar o hiperandrogenismo e proceder à sua investigação etiológica.23
1 – História clínica e exame objetivo:
Antecedentes familiares de patologia endócrina, nomeadamente hiperandrogénica;
Antecedentes pessoais relevantes (idade de aparecimento dos caracteres sexuais secundários, menarca);
Despiste de irregularidades menstruais;
Consumo de fármacos/tóxicos que possam mascarar (contracetivos orais, terapêutica para a acne) ou causar os sintomas (esteroides anabolizantes, antiepiléticos);
Despiste de sintomas/características de disfunção tiroideia, acromegalia, Síndrome de Cushing;
Somatometria (peso, altura, índice de massa corporal, perímetro da cintura – superior ao P90 para a idade e sexo ou acima de 88 cm se Tanner 5);
Estadio pubertário;
Distribuição da gordura corporal;
Acantose nigricans;
Hirsutismo e equivalentes (acne, alopécia, seborreia, hiperhidrose e hidradenite supurativa);
Sinais de virilização (hirsutismo grave e rapidamente progressivo, acne, alopecia, voz mais grave, aumento da massa muscular e cliteromegalia) 23;
2 – Documentar laboratorialmente a presença de hiperandrogenismo:
Cerca de metade dos casos de hirsutismo ligeiro não estão associados a hiperandrogenismo e o grau de relação entre acne/níveis séricos de androgénios é ainda mais baixo.24 Assim, e porque na população adolescente o diagnóstico clínico de hiperandrogenismo é difícil, a sua evidência bioquímica é considerada fundamental nesta faixa etária.14
Testosterona total
Dosear de manhã cedo entre o quarto e o décimo dia do ciclo menstrual (fase folicular) nas adolescentes com períodos menstruais regulares, uma vez que os níveis de testosterona sofrem flutuações diurnas e durante o ciclo menstrual. De notar, que os contracetivos orais interferem nos valores de testosterona sérica, pelo que devem ser suspensos no mínimo três meses antes da realização do estudo. Se a testosterona total for superior a 60 ng/dl existe uma boa evidência de hiperandrogenemia. Valores superiores a 200 ng/dl devem fazer suspeitar de uma neoplasia virilizante.23
A testosterona livre é mais fiável e sensível para o diagnóstico de SOP. Contudo, não está disponível em vários laboratórios e não existem valores de referência standard. Está intimamente relacionada com os níveis de SHGB, uma vez que esta última é a principal determinante da fração de testosterona sérica que é livre e, portanto, bioativa. A produção hepática de SHGB é aumentada pelos estrogénios e diminuída pelos androgénios, na obesidade insulinorresistente e no hipotiroidismo.23
Em alternativa, pode ser calculado o índice de androgénios livre (ILA), equivalente à testosterona livre, que é feito através da seguinte forma: Testosterona total (nmol/L) / SHGB (nmol/L) ´ 100.12 Um valor entre 5 e 30 é sugestivo de SOP e superior a 30 de tumor produtor de androgénios.
Nota: ng/dl ´ 0,0347 = nmol/L
3 – Ecografia pélvica:
De acordo com as guidelines da Endocrine Society e do American College of Obstetricians and Gynecologists (ACOG), a avaliação ecográfica deve ser realizada a todos os doentes com hiperandrogenemia confirmada. Ainda que, segundo o NIH, a identificação dos ovários poliquísticos não constitua critério diagnóstico, ajuda a confirmá-lo e pode ainda auxiliar na identificação de outra causa de hiperandrogenismo, como por exemplo um tumor do ovário ou supra-renal.8,25
A ecografia transvaginal é o método preferencial pela sua maior sensibilidade na caracterização morfológica dos ovários. Contudo, nas adolescentes ainda sem início de atividade sexual, deve ser realizada ecografia transabdominal, o que por um lado, possibilita o rastreio de massa supra-renal.26
Os critérios ecográficos mais usados foram propostos por Dewailly e colaboradores e reafirmados no consenso de Roterdão. Estes critérios consideram a presença de 12 ou mais folículos com 2-9 mm de maior diâmetro ou volume ovárico superior a 10 ml em pelo menos um ovário.5,27 Atualmente, com o desenvolvimento de tecnologia ecográfica mais sensível, a AES propôs que o número de folículos a considerar fosse superior a 25, permanecendo o limite do volume ovárico.28 Contudo, alguns autores têm vindo a sugerir limites diferentes na população pediátrica. Presentemente ainda não foram definidos critérios consensuais.3
As limitações ecográficas levaram ao estudo de potenciais marcadores de ovários poliquísticos, tais como a hormona anti-
-Mülleriana (HAM). Esta é secretada pelas células da granulosa de folículos em desenvolvimento e tem uma relação com o número de folículos antrais pequenos. Assim, vários estudos sugerem que os níveis séricos de HAM são superiores nas mulheres com SOP, sendo necessária, contudo, mais investigação.3,29
4 – Outros rastreios endócrinos:
A exclusão de patologias endócrinas que possam mimetizar a SOP constitui parte integrante do processo diagnóstico. De acordo com as guidelines, estabelecidas para a população adulta, devem ser excluídas a hiperplasia congénita da supra-renal, a Síndrome de Cushing, a hiperprolactinemia, a disfunção tiroideia e a acromegalia;5-8, 23
Sulfato de dehidroepiandrosterona (DHEAS): marcador do hiperandrogenismo adrenal. Permite o diagnóstico rápido de patologia supra-renal virilizante (tumor ou deficiência da enzima cortisona redutase). Níveis superiores a 700 mcg/dl ou 13,6 mmol/L são sugestivos de tumor da supra-renal;23,30,31
17-Hidroxiprogesterona (17-OHPG): deve ser doseada às 8h da manhã na fase folicular do ciclo menstrual ou em qualquer altura nas raparigas em anovulação, sem terapêutica com contracetivos orais. Valores séricos superiores a 200 ng/dl são sugestivos de HCSR, forma não clássica. Contudo, a não ser que estes valores sejam superiores a 1000-1500 ng/dl, deve ser realizada uma prova de ACTH;23, 32-34
Cortisol sérico: níveis de cortisol (em amostras colhidas a meio do dia) inferiores a 10 mcg/dl, em adolescentes hiperandrogénicas com obesidade central, tornam muito pouco provável o diagnóstico de Síndrome de Cushing. Porém, na suspeita elevada desta síndrome deve ser colhida urina de 24 horas para doseamento de cortisol;23
Prolactina: Cerca de 40% das mulheres com hiperprolactinemia apresenta hiperandrogenismo, devido aos efeitos da prolactina na produção e metabolismo dos androgénios. Porém, a grande maioria tem outras manifestações, em 85% dos casos, galactorreia.35 Valores de prolactina acima do limite normal superior até 100 ng/mL podem ser encontrados em hiperprolactinemias de qualquer etiologia, enquanto níveis acima de 200 ng/mL normalmente indicam a presença de um prolactinoma, cujo tamanho
se relaciona diretamente com a concentração sérica de prolactina;36
Tiroid stimulating hormone (TSH): as hormonas tiroideias interferem no metabolismo das hormonas sexuais, assim, a disfunção tiroideia pode ser responsável por várias manifestações que mimetizam a SOP, incluindo irregularidades menstruais e ovários poliquísticos.6 Valores de TSH normais, são habitualmente suficientes para excluir disfunção tiroideia. Contudo, nas adolescentes obesas observa-se uma discreta elevação da TSH sérica, o que parece constituir apenas uma consequência da obesidade;23
Insulin-like growth factor (IGF1): o excesso de hormona de crescimento, observado na acromegalia, leva a níveis aumentados de IGF1, que ativa o metabolismo androgénico a nível ovárico e adrenal. Assim, as primeiras manifestações da acromegalia podem sobrepor-se à SOP.23
5 – Outros exames a considerar
Teste de supressão com dexametasona, Prova de ACTH, TAC/RMN abdominal.
Avaliação do risco cardiometabólico
Como já referido, cerca de ¼ das adolescentes com SOP reúne critérios de síndrome metabólica. É, pois, fundamental o seu rastreio, sobretudo nas raparigas com obesidade.10
A avaliação da glicose em jejum, hemoglobina glicosilada (HbA1c) e a prova de tolerância oral à glicose são úteis no rastreio de DM2. O último teste deve ser o escolhido, uma vez que é o que possui maior sensibilidade e especificidade na deteção das alterações no metabolismo da glicose.18
Em condições basais fisiológicas (após jejum noturno) os níveis sanguíneos da insulina e da glicose podem ser correlacionados, permitindo o cálculo de um índice de sensibilidade, ou resistência, à insulina. Destaca-se o HOMA (Homeostasis Model Assesment), calculado da seguinte forma: insulina (mU/L) χ glicose (nmol/L) / 22,5 (glicose em mg/dl χ 0,0555 = mmol/L); com valores médios de 2,06 (± 0,14). Este índice é de simples determinação e tem uma boa correlação com as técnicas mais fiáveis de medição da sensibilidade à insulina, muito difíceis de aplicar na prática clínica.37
O perfil lipídico, incluindo triglicerídeos e colesterol HDL, deve também ser solicitado, sobretudo nas adolescentes com IMC elevado.23
Tratamento
À semelhança do que acontece na abordagem diagnóstica, existem poucos estudos sobre o tratamento da SOP nas adolescentes.2
A maioria dos autores sugere uma abordagem terapêutica dirigida às principais manifestações da síndrome e queixas individuais das adolescentes. Assim, se as irregularidades menstruais são a principal queixa e preocupação, o tratamento deve incidir nesta manifestação. O mesmo deve acontecer para o hirsutismo, acne, obesidade e insulinorresistência.9,38
O tratamento de primeira linha é habitualmente o uso de contracetivos orais combinados (ACO), visto que são eficazes quer no hiperandrogenismo, quer na correção das irregularidades menstruais. Contudo, se o hirsutismo não é satisfatoriamente controlado com os ACO e tratamento cosmético, pode ser adicionada terapêutica anti-androgénica. A modificação do estilo de vida deve ser a abordagem inicial sobretudo no excesso de peso e obesidade. Na presença de insulinorresistência e síndrome metabólica, a metformina deve ser considerada. 8,14
Estilo de vida
As modificações da dieta e o exercício físico são a primeira linha de tratamento nas mulheres obesas.39 A perda de peso nestas doentes pode regular os ciclos menstruais, diminuir a testosterona total, a insulinorresistência e aumentar a SHBG.38
Contracetivos orais combinados (COC)
Os contracetivos orais com estrogénios e progesterona, são usados para a proteção do endométrio e tratamento dos sintomas de hiperandrogenismo.39 Os estrogénios reduzem a produção ovárica de androgénios e aumentam a produção hepática de SHBG, diminuindo os sintomas de hiperandrogenismo e regulando os ciclos menstruais. O componente progestativo inibe a proliferação do endométrio, relevante uma vez que a anovulação prolongada causa estimulação contínua do endométrio pelos estrogénios, aumentando o risco de hiperplasia e neoplasia endometrial.39
No hirsutismo associado a acne e alterações menstruais, as pílulas com 0,030-0,035 mg de etinilestradiol, compostas por progestativo com baixo potencial androgénico ou efeito antiandrogénico (drosperinona, acetato de ciproterona, dienogest) são mais eficazes.14,39,40 (Quadro 2 e 3)
Contudo, o uso de contracetivos orais é discutível pelo facto da maioria das adolescentes com SOP ser obesa e apresentar fatores de risco metabólico. Em adolescentes com baixa estatura e epífises não encerradas, os contracetivos orais não devem ser utilizados pelo risco de encerramento precoce das epífises, induzido pelo estrogénio.39
Progestagénios
O uso isolado de progestagénios pode ser uma opção nas adolescentes com irregularidades menstruais não corrigidas com contracetivos orais combinados. Atua através da inibição da proliferação do endométrio, nao sendo eficaz no tratamento do hirsutismo. Os fármacos disponíveis são o acetato de medroxiprogesterona, desogestrel, etonogestrel e o levonorgestrel.34, 40
Fármacos com potencial anti-androgénico
Os anti-androgénios podem ser usados para bloquear os efeitos do androgénio da unidade pilo-sebácea ou no folículo piloso. A terapêutica anti-androgénica funciona por meio de antagonismo competitivo do recetor de androgénio (espironolactona, acetato de ciproterona, flutamida) ou inibição da 5α-redutase (finasterida) para evitar a conversão de testosterona na sua forma mais potente, 5α-di-hidrotestosterona.14, 39
Devido ao longo ciclo de crescimento dos folículos pilosos sexuais, os efeitos farmacológicos costumam ser evidentes após 9-12 meses de tratamento.12
A espirinolactona é o anti-androgénio mais potente, habitualmente utilizado em associação com os contracetivos orais para potenciar os efeitos anti-androgénicos. Embora considerado seguro, existem poucos estudos na população pediátrica. Com a sua utilização devem ser monitorizados os níveis séricos de potássio.14
O acetato de ciproterona é comummente utlizado em associação com estrogénios nos contracetivos orais combinados embora também esteja disponível em monoterapia.39
Embora se pense que a terapêutica com anti-androgenios possa estar associada a perda de massa óssea, os estudos mais recentes não comprovam essa associação.14
Estes fármacos, habitualmente utilizados nas formas mais graves de hirsutismo, devem ser prescritos em associação com os contracetivos orais, para potenciar o efeito androgénico e evitar os efeitos teratogénicos associados.12, 14, 39
Metformina
A metformina é um fármaco pertencente à classe das biguanidas que reduz a síntese hepática de glicose, diminui a absorção intestinal de glicose e aumenta a sensibilidade à insulina através da melhoria da captação e utilização da glicose periférica.39
Em doentes com SOP, a metformina reduz as concentrações de insulina, promove a ovulação e reduz modestamente os níveis de andrógenos, não o suficiente para melhorar o hirsutismo.41
É utilizada em mulheres jovens e adolescentes com SOP como monoterapia de primeira linha ou em combinação com contracetivos orais combinados e medicamentos anti-andrógenos. Muitas adolescentes que rejeitam o tratamento com contracetivos orais podem beneficiar da terapêutica isolada com metformina.14
De forma a reduzir os potenciais efeitos secundários, deve ser iniciada em doses baixas – 500mg 1id com aumento progressivo conforme a tolerância e efeitos terapêuticos.39
Nas raparigas magras, as doses mais baixas podem ser eficazes na redução dos sintomas da SOP; em adolescentes com sobrepeso ou obesidade, o aumento da dose até 1,5 a 2,5 g por dia será provavelmente necessário.14
Tratamento cosmético e dermatológico
A abordagem cosmética é utilizada no tratamento do hirsutismo, habitualmente em associação com outras modalidades terapêuticas. Existem diversas opções disponíveis no mercado e a sua escolha depende de vários fatores, tais como o preço, a tolerância à dor/desconforto e o risco de complicações.12
Destacam-se os métodos físicos de remoção pilosa, os tratamentos de longa duração (eletrólise, lazer, luz pulsada intensa) e tratamentos químicos (cremes depilatórios, eflornitina).12, 39, 42
O creme de eflornitina pode ser usado isoladamente para o hirsutismo facial.39, 42
CONCLUSÕES
A SOP é um distúrbio comum, que apresenta uma variabilidade fenotípica considerável, mantendo-se controversa a sua definição. Na adolescência, o seu diagnóstico é ainda mais difícil pela sobreposição das características da síndrome e as manifestações fisiológicas da puberdade.
A identificação precoce das adolescentes com SOP é relevante, não só porque permite prevenir as co-morbilidades e riscos associados a longo prazo, como também evita as consequências negativas comuns nesta faixa etária, sobretudo relacionadas com a imagem corporal e sexualidade das adolescentes.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Stein IF. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol 1935; 29: 181. [ Links ]
2. Al Khalifah RM, Flórez ID, Dennis B, Neupane B, Thabane L, Bassilious E. The effectiveness and safety of treatments used for polycistic ovarian syndrome management in adolescentes: a systematic review and network metaanalysis protocol. Systematic Reviews 2015; 4:125 [ Links ]
3. Agapova SE, Cameo T, Sopher AB, Oberfield, SE. Diagnosis and Challenges of Polycystic Ovary Syndrome in Adolescence. Semin Reprod Med. 2014; 32: 194–201. [ Links ]
4. Zawadski, JK.; Dunaif, A. Diagnostic criteria for polycystic ovary syndrome; towards a rational approach. In: Dunaif, A.; Givens, JR.; Haseltine, F., editors. Polycystic Ovary Syndrome. Vol. 1992. Boston, MA: Black-well Scientific; p. 377-84. [ Links ]
5. Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004; 19:1–7. [ Links ]
6. Azziz R, Carmina E, Dewailly D et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril. 2009;91:456. [ Links ]
7. National Institutes of Health. Evidence-Based Methodology Workshop on Polycystic Ovary Syndrome: Executive Summary. Washington: National Institutes of Health; 2012. [ Links ]
8. Legro RS, Arslanian SA, Ehrmann DA, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2013; 98:4565. [ Links ]
9. Legro R. Diagnosis and treatment of polycystic ovary syndrome (PCOS): An interview with Richard Legro. BMC Medicine 2015; 13:64 [ Links ]
10. Rosenfield RL. Definition, clinical features and differential diagnosis of polycystic ovary syndrome in adolescentes. Outubro 2014. (Acedido em 3 fevereiro 2016). Disponível em: http://www.uptodate.com. [ Links ]
11. Rosenfield L. Pathophysiology and etiology of polycystic ovary syndrome in adolescentes. Outubro 2014. (Acedido em 3 fevereiro 2016). Disponível em: http://www.uptodate.com. [ Links ]
12. Souto SB, Carvalho Braga D, Medina JL. Síndrome do ovário poliquístico – do diagnóstico ao tratamento. Rev Port Endocrinol Diabetes Metab. 2008;01: 39-50. [ Links ]
13. Fauser BC, Tarlatzis BC, Rebar RW, et al. Consensus on womens health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril. 2012; 97(Suppl 1):28.e25–38.e25. [PubMed: 22153789] [ Links ]
14. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: guide to the best practices in the evaluation and treatment of polycystic ovary syndrome – part 1. Endocr Pract 2015;21:1291-8. [ Links ]
15. Ferriman D, Gallwey JD. Clinical assessment of body hair growth in women. J Clin Endocrinol Metab 1961; 21:1440. [ Links ]
16. Rosenfield RL. Clinical review: Adolescent anovulation: maturational mechanisms and implications. J Clin Endocrinol Metab 2013; 98:3572. [ Links ]
17. Rodrigues P, Castedo JL. Oligomenorreia na adolescência – Avaliação na prática clínica. Rev Port Endocrinol Diabetes e Metabolismo. 2011;1:53-63. [ Links ]
18. Cink DA, Dilbaz B. What do we know about metabolic syndrome in adolescents with PCOS? J Turk Ger Gynecol Assoc 2014; 15: 49-55. [ Links ]
19. Nicandri KF, Hoeger K. Diagnosis and treatment of polycystic ovarian syndrome in adolescents. Curr Opin Endocrinol Diabetes Obes. 2012; 19:497–504. [PubMed: 23076041] [ Links ]
20. Zimmet P, Alberti KG, Kaufman F, Tajima N, Silink M, Arslanian S, et al. The metabolic syndrome in children and adolescents an IDF consensus report. Pediatr Diabetes 2007; 8: 299-306. [ Links ]
21. Özsoy S. Psychiatric status and approach in polycystic ovary syndrome and hirsutism. Turkiye Klinikleri J EndocrinSpecial Topics 2009; 2: 126-30. [ Links ]
22. EscobarMorreale HF, Sanchón R, SanMillán JL. A prospective study of the prevalence of nonclassical congenital adrenal hyperplasia among women presenting with hyperandrogenic symptoms and signs. J Clin Endocrinol Metab 2008; 93:527. [ Links ]
23. Rosenfield L. Diagnostic evaluation of polycystic ovary syndrome in adolescents uptodate. Outubro 2014. (Acedido em 4 fevereiro 2016). Disponível em: http://www.uptodate.com. [ Links ]
24. Martin KA, Chang RJ, Ehrmann DA, et al. Evaluation and treatment of hirsutism in premenopausal women: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2008; 93:1105. [ Links ]
25. ACOG Committee on Practice BulletinsGynecology. ACOG Practice Bulletin No. 108: Polycystic ovary syndrome. Obstet Gynecol 2009; 114:936. [ Links ]
26. Mendelson EB, BohmVelez M, Joseph N, Neiman HL. Gynecologic imaging: comparison of transabdominal and transvaginal sonography. Radiology 1988; 166:321. [ Links ]
27. Jonard S, et al. Ultrasound examination of polycystic ovaries: is it worth counting the follicles? Hum Reprod 2003; 18: 598603. [ Links ]
28. Dewailly D, Lujan ME, Carmina E, et al. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014;20:334-52. [ Links ]
29. Bachanek M, Abdalla N. Value of ultrasonography in the diagnosis of polycystic ovary syndrome – literature review. J Ultrason 2015; 15: 410–22 [ Links ]
30. Lavery GG, Walker EA, Tiganescu A, et al. Steroid biomarkers and genetic studies reveal inactivating mutations in hexose6phosphate dehydrogenase in patients with cortisone reductase deficiency. J Clin Endocrinol Metab 2008; 93:3827. [ Links ]
31. Lawson AJ, Walker EA, Lavery GG, et al. Cortisonereductase deficiency associated with heterozygous mutations in 11betahydroxysteroid dehydrogenase type 1. Proc Natl Acad Sci U S A 2011; 108:4111. [ Links ]
32. Rosenfield RL, Cohen RM, Talerman A. Lipid cell tumor of the ovary in reference to adultonset congenital adrenal hyperplasia and polycystic ovary syndrome. A case report. J Reprod Med 1987; 32:363. [ Links ]
33. Bidet M, BellannéChantelot C, GalandPortier MB, et al. Clinical and molecular characterization of a cohort of 161 unrelated women with nonclassical congenital adrenal hyperplasia due to 21hydroxylase deficiency and 330 family members. J Clin Endocrinol Metab 2009; 94:1570. [ Links ]
34. EscobarMorreale HF, Sanchón R, San Millán JL. A prospective study of the prevalence of nonclassical congenital adrenal hyperplasia among women presenting with hyperandrogenic symptoms and signs. J Clin Endocrinol Metab 2008; 93:527. [ Links ]
35. Glickman SP, Rosenfield RL, Bergenstal RM, Helke J. Multiple androgenic abnormalities, including elevated free testosterone, in hyperprolactinemic women. J Clin Endocrinol Metab 1982; 55:251. [ Links ]
36. Quaresma L, Oliveira S, Leite AL, Teles A, Marques JS, Campos RA. Hiperprolactinémia – que diagnóstico? Rev Port Endocrinol Diabetes Metab. 2015;10:160-5. [ Links ]
37. Grupo de Estudo da Insulino-Resistência da Sociedade Portuguesa de Endocrinologia, Diabetes e Metabolismo. Manual sobre Insulinorresistência. 3ª Edição. Helena Cardoso. 2013. p. 11-4. [ Links ]
38. Bouzas I. Síndrome dos ovários policisticos na adolescência. Adolescência e Saúde. 2007; 4: 43-7. [ Links ]
39. Rosenfield L. Treatment of polycystic ovary syndrome in adolescentes. Outubro 2014. (Acedido em 5 fevereiro 2016). Disponível em: http://www.uptodate.com. [ Links ]
40. Reunião de Consenso Nacional sobre Contracepção. Sociedade Portuguesa de Ginecologia, Contracepção, e Medicina da Reprodução. Consenso sobre Contracepção 2011. Edições Frist News. 2011. p. 9-23, 25-31. [ Links ]
41. Lord JM, Flight IH, Norman RJ. Insulinsensitising drugs (metformin, troglitazone, rosiglitazone, pioglitazone, Dchiroinositol) for polycystic ovary syndrome. Cochrane Database Syst Rev 2003; CD003053. [ Links ]
42. Randall VA, et al. New dimensions in Hirsutism. Lasers Med Sci 2006; 21: 126-33. [ Links ]
ENDEREÇO PARA CORRESPONDÊNCIA
Diana Baptista
Serviço de Pediatria
Hospital Senhora da Oliveira
Rua dos Cutileiros, Creixomil
4835-044 Guimarães
Email: dianbaptista@hotmail.com
Recebido a 16.03.2016 | Aceite a 17.05.2016














