Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Nutrícias
versão On-line ISSN 2182-7230
Nutrícias no.14 Porto set. 2012
ARTIGO DE REVISÃO
Doença Celíaca: Actualidade vs. Futuro
Celiac Disease: Present vs. Future
Carmen Garcia1, Rita Jorge2
1 Enfermeira, Hospital do Espírito Santo de Évora, E.P.E.
2 Dietista, Associação Portuguesa de Celíacos
RESUMO
O único tratamento para a doença celíaca aceite até à data consiste numa dieta isenta em glúten para toda a vida, contudo, novas investigações apontam no sentido do desenvolvimento de fármacos (orais e injectáveis) que poderão proporcionar aos celíacos novas oportunidades no campo alimentar.
Palavras-Chave: Doença celíaca, Dieta isenta em glúten, Vacina
ABSTRACT
The only treatment for celiac disease is a lifelong adherence to a gluten-free diet. However, further investigation pointed towards the development of drugs (oral and injectable) that may provide new opportunities in the celiac diet.
keywords: Celiac disease, Gluten-free diet, Vaccine
Introdução
Doença Celíaca
A Doença Celíaca (DC) é uma enteropatia auto-imune que ocorre em indivíduos com predisposição genética como resultado de uma resposta imune ao glúten, um conjunto de proteínas ricas em prolaminas e glutaminas, as principais proteínas do trigo, aveia, centeio e cevada (1-3). Esta resposta surge na lâmina própria e no epitélio do intestino delgado (1,2), e caracteriza-se pela inflamação crónica da mucosa e submucosa (4-6). Originalmente considerado um síndrome de malabsorção rara em crianças, a DC é actualmente reconhecida como uma condição comum que pode ser diagnosticada em qualquer idade e afecta vários sistemas de órgãos (1-3,7). O desenvolvimento de DC envolve a interacção de factores ambientais, genéticos e imunológicos (5,6).
A quantidade e a fase em que o glúten é administrado na infância e a amamentação são factores que influenciam o aparecimento da patologia (3,8). Tanto a introdução precoce de glúten (antes dos 4 meses de idade) como a tardia (após os 7 meses de idade) estão associadas ao aparecimento de DC. Contudo, estudos confirmam que a introdução de pequenas porções de glúten ainda durante a amamentação pode reduzir o risco de desenvolver DC (8,9).
O desenvolvimento da DC está associado à presença do antigénio dos leucócitos humanos (HLA) DQ2 – existente em 95% dos indivíduos com DC, enquanto que o HLA-DQ8 está presente nos restantes (2,10). As moléculas DQ2 e DQ8 conferem susceptibilidade para a DC pela apresentação de péptidos de glúten específicos às células T do sistema imunitário no intestino (11-13). A DC está também fortemente relacionada com a activação da enzima tecidual transglutaminase (tTG) (3). Esta enzima altera a gliadina por desaminação, originando péptidos com maior afinidade para as moléculas de HLA-DQ2 e HLA-DQ8, sendo reconhecidos pelas células T intestinais, produzindo uma resposta imunitária (13-15). Por sua vez, as citocinas libertadas pelos linfócitos aumentam a expressão do HLA-DQ2 no epitélio do intestino delgado, permitindo que mais gliadina seja apresentada aos linfócitos sintetizados (14).
O risco de desenvolvimento de DC é elevado (aproximadamente 10%) em parentes de primeiro grau de indivíduos com esta patologia (3,12,16), portadores de diabetes tipo 1 (12,16,17), doenças auto-imunes, síndrome de Down (3,12,16), dermatite herpetiforme, síndrome de Turner, síndrome de Williams e deficiência selectiva da IgA (12,16). Mundialmente, a prevalência de DC é mais elevada nos indivíduos de género feminino, numa proporção de 2:1 (3). Na Europa, esta patologia ocorre em, aproximadamente, 1% da população (18-20), mais especificamente, um em cada 79-200 indivíduos têm DC (20). Em Portugal a prevalência é de 1:134, reportando-se este dado a um estudo realizado na região Norte (21). No entanto, a DC é ainda uma patologia subdiagnosticada que merece ser rastreada caso o indivíduo apresente sintomas compatíveis (21). A incidência em adultos é actualmente mais frequente que em crianças (22) e 25% dos novos casos diagnosticados ocorre em indivíduos com mais de 60 anos (10).
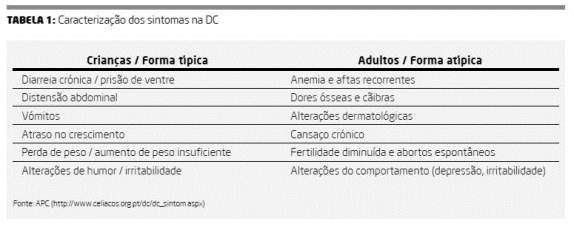
A DC é caracterizada por uma sintomatologia multissistémica, sendo as suas manifestações clínicas variáveis. Os sintomas mais comuns variam conforme a idade, sendo que, dentro de cada faixa etária, podem também diferenciar-se em frequência e intensidade, como descritos na Tabela 1 (16,23).
O critério de diagnóstico da DC assenta, essencialmente, em:
• Sinais e sintomas sugestivos de DC
• Testes serológicos:
- Anti-transglutaminase (TTG)
- Anti-gliadina (AGA)
- Anti-endomísio (EMA)
• Biópsia intestinal para confirmação de diagnóstico (24,13)
O diagnóstico deve ser realizado quando o indivíduo não está a praticar uma dieta isenta em glúten (DIG) (24,13).
O único tratamento aceite actualmente para esta patologia consiste numa DIG para toda a vida, a qual requer a eliminação dos quatro cereais com glúten (1,11,25-27).
A DIG tem por objectivos diminuir os sintomas gastrointestinais, melhorar os parâmetros serológicos e histológicos (13,28,29) e o estado nutricional do indivíduo (30). Por consequência, o diagnóstico e a dieta devem ser estabelecidos precocemente, uma vez que a DIG implementada na infância protege os adultos celíacos de efeitos adversos clínicos e comportamentais (31). A análise aos anticorpos antitransglutaminase tecidual (TTG) deve ser realizada seis meses após o tratamento com DIG, pois uma diminuição nos valores deste anticorpo é um indicador indirecto da adesão à dieta e consequente recuperação do indivíduo com DC (2).
O cumprimento da DIG é actualmente dificultado pelo facto de a farinha de trigo estar presente numa grande variedade de produtos alimentares (12). Os indivíduos com DC enfrentam ainda problemas como a fraca palatibilidade dos produtos alimentares sem glúten, a ausência de sintomas após a transgressão da dieta e a dificuldade em encontrar produtos sem glúten fora de casa (26,32-34). Estes factores, bem como o facto do custo estimado de uma DIG ser superior a uma dieta com glúten, podem levar a uma menor adesão à DIG (26,35). Quando é feito o diagnóstico de DC, os indivíduos sentem medo, ansiedade e tristeza, sentimentos que podem piorar a relação do doente com o profissional de saúde e isso encontra-se inversamente correlacionado com o cumprimento da DIG (28). Um estudo coordenado pelo gastrenterologista Aziz Imran, publicado em 2011, procurou perceber qual o grau de satisfação dos pacientes celíacos em relação à DIG e, de acordo com os dados recolhidos, é perceptível que a grande maioria dos celíacos se encontra descontente com a mesma (cerca de 42% dos celíacos classifica a DIG como pobre ou muito pobre) pelo que urge encontrar novas soluções (36). É, contudo, importante assimilar que apesar das boas perspectivas actuais, os novos métodos de tratamento da DC se encontram ainda em processo de experimentação. Com o conhecimento de que actualmente dispomos, podemos apenas supor que os novos métodos funcionarão como uma espécie de tratamento complementar não substituindo, para já, a DIG e a sua importância (37).
Medicação via oral: Uma realidade distante
Vários estudos demonstram que, nos seres humanos, as proteínas glúten e gliadina são resistentes à digestão quer pelo suco gástrico quer pelas enzimas pancreáticas e, como consequência, estas permanecem intactas no seu trajecto até ao intestino delgado (38). Em 2006 investigadores da Universidade de Stanford publicaram um artigo onde descreviam um “cocktail” combinado de duas enzimas que conseguiriam digerir e inactivar as moléculas glúten e gliadina. Estas duas moléculas seriam a EP-B2, proveniente da cevada, e a PEP, uma enzima que trabalha no duodeno. Em condições laboratoriais cuidadosamente controladas, semelhantes às duodenais, o cocktail enzimático funcionou num período de dez minutos sendo esta uma das perspectivas de evolução no tratamento da DC que mais expectativa tem criado nos celíacos de todo o mundo e da qual se aguardam novos desenvolvimentos (39).
Vacina: O próximo passo
Em Maio de 2011, uma equipa de investigadores de Melbourne, Austrália, revelou que procedeu à identificação dos três péptidos constituintes do glúten que são tóxicos para os celíacos encontrando-se, neste momento, a desenvolver uma vacina (nexvax2) que possa dessensibilizar os doentes celíacos (e que se prevê que seja eficaz em aproximadamente 90% dos casos de DC causados pelo antigénio DQ2). Esta parece ser uma excelente notícia para a maioria dos celíacos que, de acordo com estudos realizados, apontam a vacina como a sua primeira escolha de tratamento em caso de sucesso confirmado da mesma (36).
Actualmente, a vacina já terminou a fase I de testagem seguindo-se agora a fase II na qual será inoculada em celíacos humanos. O resultado esperado é o da redução dramática na taxa de rejeição corporal à dieta com glúten. Caso se confirme que os péptidos utilizados na vacina são, como tudo aponta até agora, os correctos, ficará aberta a porta a todo um novo campo de possibilidades para os celíacos. Prevê-se que, em caso de sucesso, a vacina esteja disponível no mercado aproximadamente em 2017 (40).
Análise crítica
A DIG correctamente cumprida devolve/mantém qualidade de vida, permitindo uma vida completamente normal, não devendo o celíaco alterar o seu quotidiano, vida social ou prática de exercício físico; no entanto, uma vez que a DIG é de difícil cumprimento pelas limitações sociais e económicas que pode provocar, várias alternativas têm vindo a ser testadas nas últimas décadas. Nenhuma delas, contudo, se assumiu ainda como opção fiável à DIG.
Conclusões
Ainda que o mercado tenha sido inundado de fármacos facilitadores da digestão do glúten nenhum dos mesmos se mostrou eficaz/seguro em indivíduos com DC pelo que é papel importante de todos os profissionais de saúde fornecerem apoio através de ensinos programados aos celíacos, seja no esclarecimento de questões relacionadas com a alimentação seja na diminuição de sintomatologia física e psicológica relacionada com a DC e as suas co-morbilidades. Devido ao incremento do número de diagnosticados nos últimos anos, a DC apresenta-se como uma doença cada vez mais conhecida e estudada o que tem permitido e, acredita-se, virá a permitir ainda mais, que os celíacos ganhem qualidade de vida e possam aproximar a sua dieta da praticada pelos indivíduos não-celíacos seja através de formas de tratamento oral ou de inoculação de injectáveis dessensibilizantes. Apesar da sua carga genética, ambiental e da afectação multisistémica que provoca, a DC parece caminhar em direcção ao conhecimento da chave dos seus mecanismos mais específicos e, consequentemente, à sua cura / anulação.
Referências Bibliográficas
1. Green PH, Cellier C. Celiac disease. N Engl J Med 2007; 357(17): 1731 - 43
2. [ Links ] Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40(1): 1 - 19
3. [ Links ] World Gastroenterology Organisation Practice Guidelines. WGO Practice Guidelines Doença Celíaca 2005
4. Green PH, Shane E, Rotterdam H, Forde KA, Grossbard L. Significance of unsuspected celiac disease detected at endoscopy. Gastrointest Endosc 2000; 51: 60 - 5
5. [ Links ] Schuppan D, Esslinger B, Dieterich W. Innate immunity and celiac disease. Lancet 2003; 362(9377): 3 - 4
6. [ Links ] Sollid LM. Molecular basis of celiac disease. Annu Rev Immunol 2000; 18: 53 - 81
7. [ Links ] Rodrigo L. Celiac disease. World J Gastroenterol 2006; 12(41): 6585 - 93
8. [ Links ] Ivarsson A, Hernell O, Stenlund H, Persson LA. Breast-feeding protects against celiac disease. Am J Clin Nutr 2002; 75: 914 - 21
9. [ Links ] Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B, et al. Complementary Feeding: A Commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2008; 46(1): 99 - 110
10. [ Links ] Green PHR, Stavropoulos SN, Panagi SG, Goldstein SL, McMahon DJ, Absan H, Neugut AI. Characteristics of adult celiac disease in the USA: Results of a national survey. Am J Gastroenterol 2001; 96: 126 - 31
11. [ Links ] Kupper C. Dietary guidelines and implementation for celiac disease. Gastroenterol 2005; 128(4 Suppl 1): S121 - 7
12. [ Links ] NIH Consensus Development Conference on Celiac Disease. Bethesda, Md.: U.S. National Institutes of Health 2004; 27 - 31
13. Fasano A, Catassi C. Current Approaches to Diagnosis and Treatment of Celiac Disease: An Evolving Spectrum. Gastroenterol 2001; 120: 636 - 51
14. [ Links ] Abdulkarim AS, Murray JA. Review article: the diagnosis of coeliac disease. Aliment Pharmacol Ther 2003; 17: 987 - 95
15. [ Links ] Tollefsen S, Arentz-Hansen H, Fleckenstein B, Molberg O, Ráki M, Kwok WW, et al. HLA-DQ2 and -DQ8 signatures of gluten T-cell epitopes in celiac disease. J Clin Invest 2006 Aug;116:2226-36
16. [ Links ] Rashid M, Cranney A, Zarkadas M, Graham ID, Switzer C, Case S, et al. Celiac Disease: Evaluation of the Diagnosis and Dietary Compliance in Canadian Children. Pediatrics 2005; 116(6): e754 - 9
17. [ Links ] Talal AH, Murray JA, Goeken JA, Sivitz WI. Celiac disease in an adult population with insulin-dependent diabetes mellitus: use of endomysial antibody testing. Am J Gastroenterol 1997; 92: 1280 - 4
18. [ Links ] Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: A large multicenter study. Arch Intern Med 2003; 163: 286 - 92
19. [ Links ] Maki M, Mustalahti K, Kokkonen J, Kulmala P, Haapalahti M, Karttunen T, et al. Prevalence of celiac disease among children in Finland. N Engl J Med 2003; 348: 2517 - 24
20. [ Links ] Dube C, Rostom A, Sy R, Cranney A, Saloojee N, Garritty C, et al. The prevalence of celiac disease in average-risk and at-risk Western European populations:A systematic review.Gastroenterol 2005; 128(suppl 1): S57 - 67
21. [ Links ] Antunes H, Abreu AH, Nogueiras I, Sá A, Gonçalves C, Cleto C, et al. Primeira determinação de prevalência de doença celíaca numa população portuguesa. Acta Med Port 2006; 19: 115 - 20
22. [ Links ] Green PH, Jabri B. Coeliac disease. Lancet 2003; 362: 383 - 91
23. [ Links ] Chand N, Mihas A. Celiac disease: Current concepts in diagnosis and treatment. J Clin Gastroenterol 2006; 40: 3 - 14
24. [ Links ] Presutti RJ, Cangemi JR, Cassidy HD, Hill DA. Celiac Disease. Am Fam Phys 2007; 76(12): 1795 - 802
25. [ Links ] Case S. The Gluten-Free Diet: How to Provide Effective Education and Resources. Gastroenterol 2005; 128: S128 - 34
26. [ Links ] Leffler DA, Edwards-George J, Dennis M, Schuppan D, Cook F, Franko DL, et al. Factors that Influence Adherence to a Gluten-Free Diet in Adults with Celiac Disease. Dig Dis Sci 2007; 53(6): 1573 - 81
27. [ Links ] Meyer KG, Fasshauer M, Nebel IT, Paschke R. Comparative analysis of conventional training and a computer-based interactive training program for celiac disease patients. Pat Educ Couns 2004; 54(3): 353 - 60
28. [ Links ] Pietzak MM. Follow-up of patients with celiac disease: Achieving compliance with treatment. Gastroenterol 2005; 128(4 suppl 1): S135 - 41
29. [ Links ] Williamson D, Marsh MN. Celiac disease. Mol Biotechnol 2002; 22(3): 293 - 9
30. [ Links ] Murray JA, Watson T, Clearman B, Mitros F. Effect of a gluten-free diet on gastrointestinal symptoms in celiac disease. Am J Clin Nutr 2004; 79(4): 669 - 73
31. [ Links ] Ciacci C, Iovino P, Amoruso D, Siniscalchi M, Tortora R, Gilio AD, et al. Grown-up coeliac children: the effects of only a few years on a gluten-free diet in childhood. Aliment Pharmacol Ther 2005; 21: 421 - 9
32. [ Links ] Anson O, Weizman Z, Zeevi N. Celiac disease: parental knowledge and attitudes of dietary compliance. Pediatrics 1990; 85(1): 98 - 103
33. [ Links ] Cranney A, Zarkadas M, Graham ID, Switzer C. The Canadian celiac health survey—the Ottawa chapter pilot. BMC Gastroenterol 2003; 3(8)
34. Jackson PT, Glasgow JF, Thom R. Parents’ understanding of coeliac disease and diet. Arch Dis Child 1985; 60: 672 - 4
35. [ Links ] Lee AR, Ng L, Zivin J, Green PH. Economic burden of a gluten-free diet. J Hum Nutr Diet 2007; 20(5): 423 - 30
36. [ Links ] Aziz I, Evans KE, Papageorgiou V, Sanders DS. Are patients with coeliac disease seeking alternative therapies to a gluten-free diet Gastrointestin Liver Dis 2011; 20(1): 27 - 31
37. [ Links ] Crespo Pérez L, Castillejo de Villasante G, Cano Ruiz A, León F; Non-dietary therapeutic clinical trials in coeliac disease. Eur J Intern Med 2012; 23(1): 9 - 14. Epub 2011 Sep 29
38. [ Links ] David L Burns, MD, “100 Questions & Answers About Celiac Disease and Sprue: A Lahey Clinic Guide”. Jones & Bartlett Publishers, U.S.A. 2008
39. Chem Biol., Rational design of combination enzyme therapy for celiac sprue. 2006; 13(6): 649 - 58
40. Walter and Eliza Hall Institute (2011, May 9). Celiac disease vaccine shows promising results in Phase I trial. ScienceDaily. Retrieved January 12, 2012
Endereço para correspondência
Rita Jorge
Av. Júlio Dinis, n.º 23, S/L,
1050-130 Lisboa
dietista@celiacos.org.pt
Recebido a 14 de Janeiro de 2012
Aceite a 4 de Abril de 2012














